Практикумы 3, 4 и 5
В работе могут присутствовать ошибки.
В этом практикуме была рассмотренна запись в базе PDB с pdb_id: 1B9H, а так же взаимодействия между аминокислотными остатками.
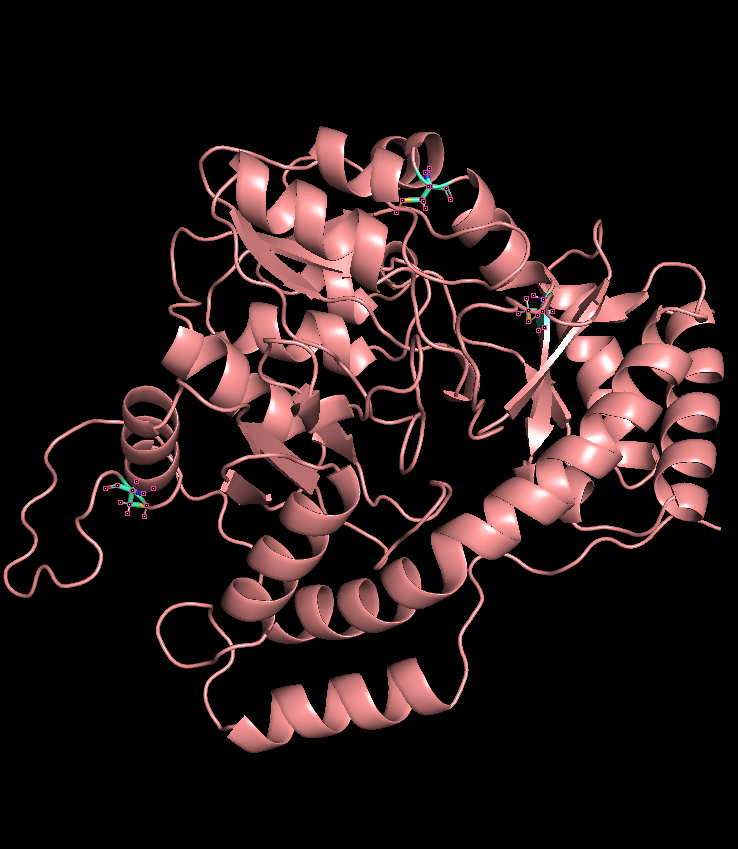
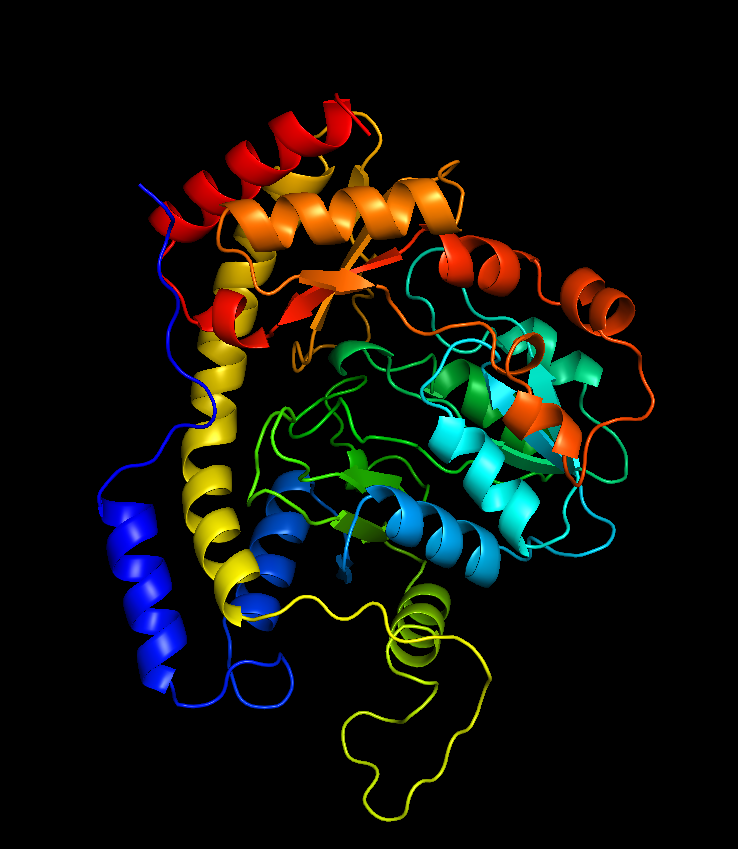
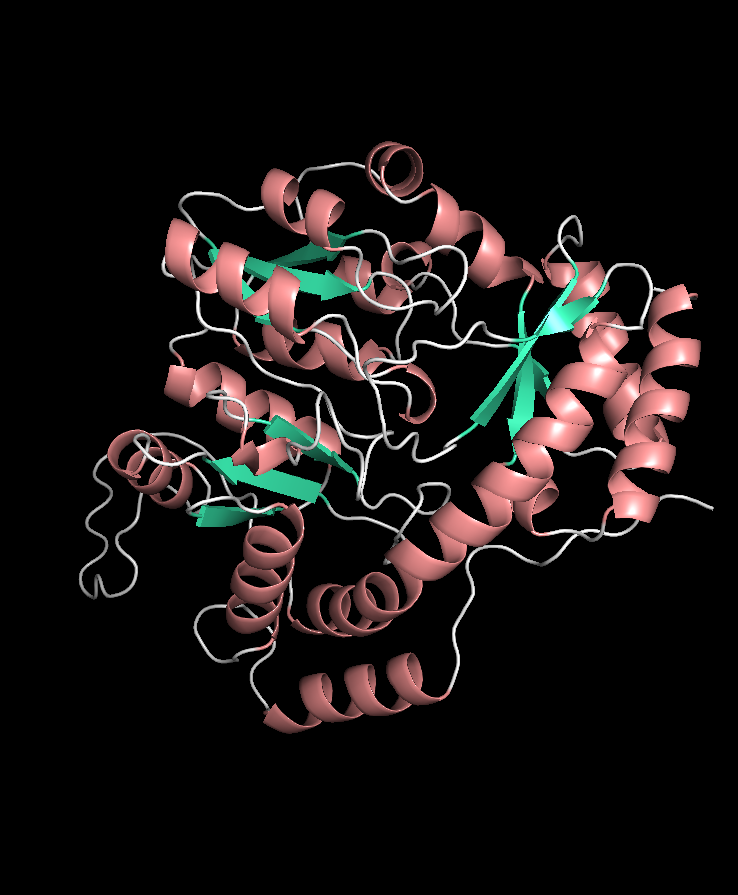
Структура в целом
Тип макромолекулы: белок (синтаза 3-амино-5-гидроксибензойной кислоты (AHBA synthase))
Полимерных цепей в структуре: одна (цепочка A)
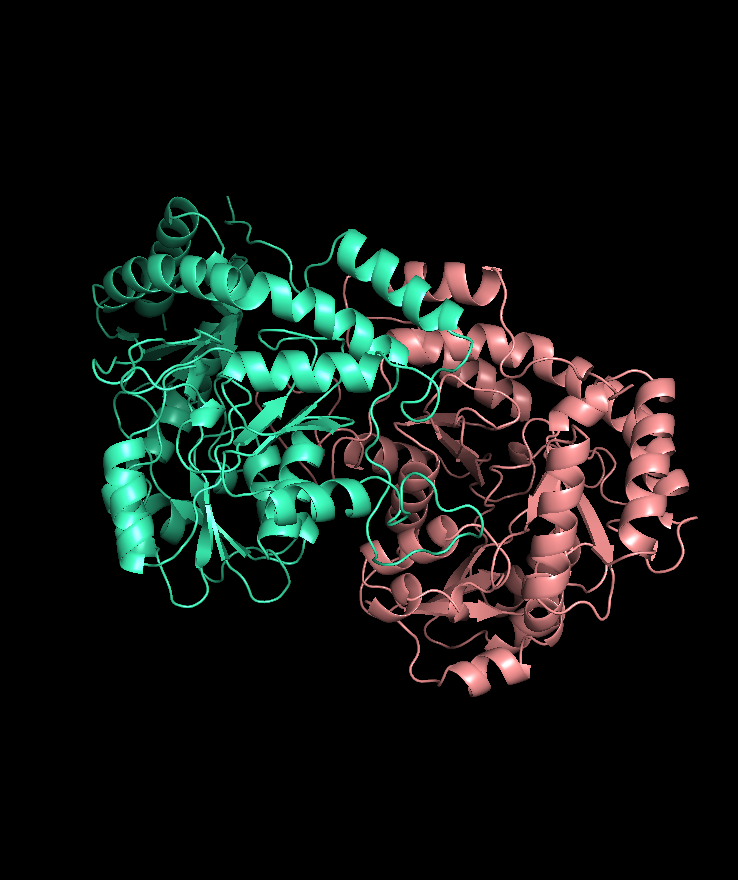
Цепи входящие в одну биологическую единицу: две гомолологичных ассиметричных субъединицы, в каждой — единственная цепь А
Отдельные цепи
Цепочка А
Организм, к которому относится данная макромолекула: Amycolatopsis mediterranei (грамположительная бактерия)
Uniprot_id: O52552
Название по базе Uniprot: 3-амино-5-гидроксибензоат синтаза
Функции: 1. Катализатор дегидратации и ароматизации 5-амино-5-дезокси-3-дегидрошикимата (aminoDHS) до 3-амино-5-гидроксибензоата (AHBA)
2. Трансаминаза, вводящая азот в промежуточный продукт первого пути, UDP-3-keto-D-glucose, с образованием UDP-kanosamine (в комплексе с RifL RifK)
Количество мутаций в последовательности относительно референса из Uniprot: 10 мутаций
Модифицированные аминокислотные остатки: присутствуют в позиции 188. Ссылка на файл с соответствующими строками
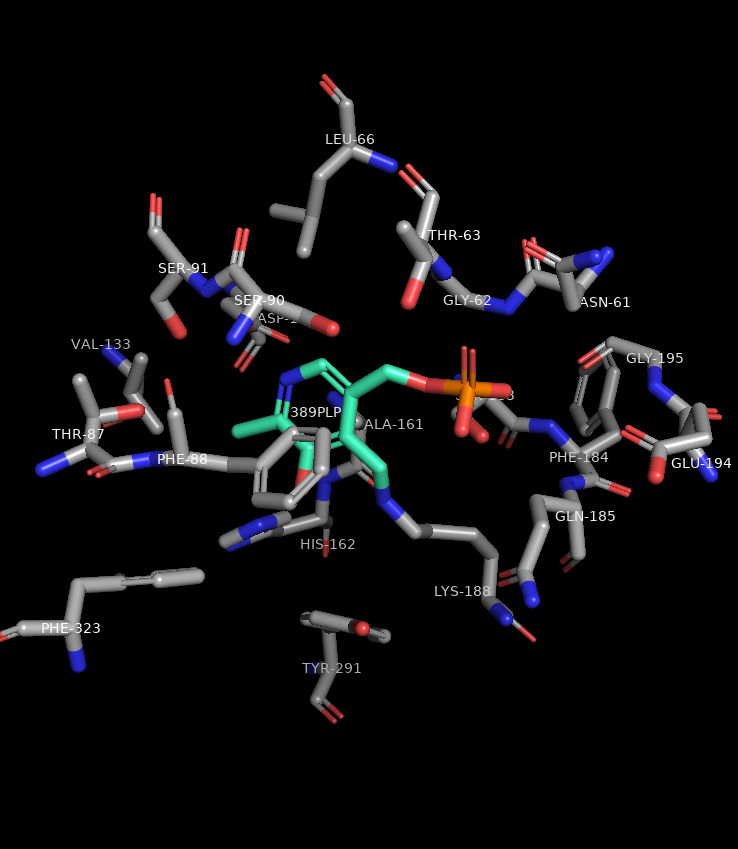
Малые молекулы
PLP
Краткое наименование: PLP
Полное наименование: Pyridoxal-5’-Phosphate
Ссылка на файл pdp с микромолекулой
Взаимодействия между аминокислотными остатками
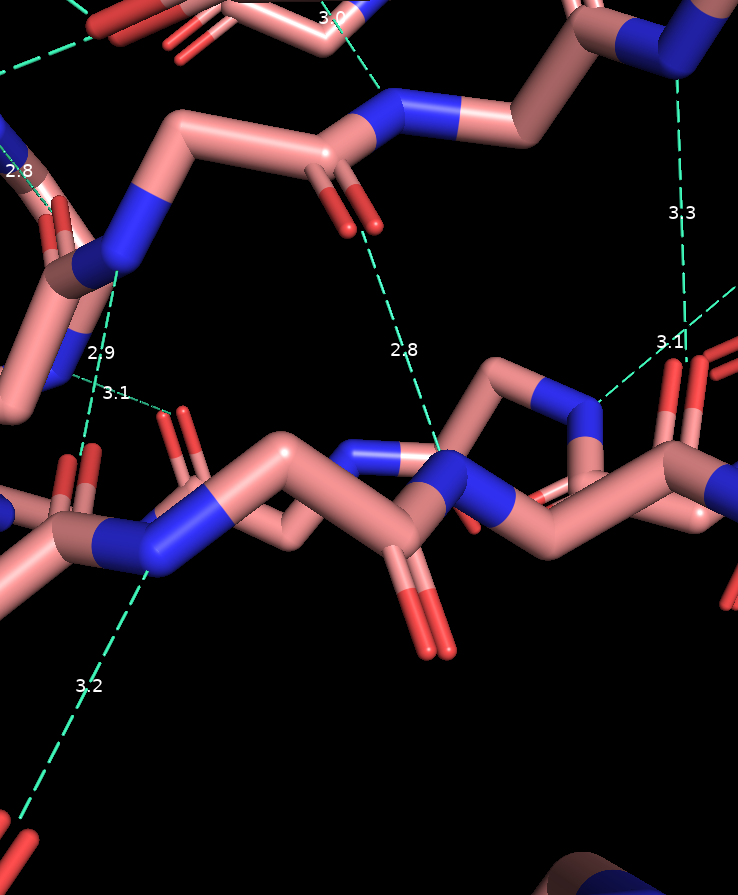
Водородная связь, затрагивающая атомы остова белка
Образуют вторичную структуру булка (α-спирали и β-листы)
Длина: 2.5-3.5 Å
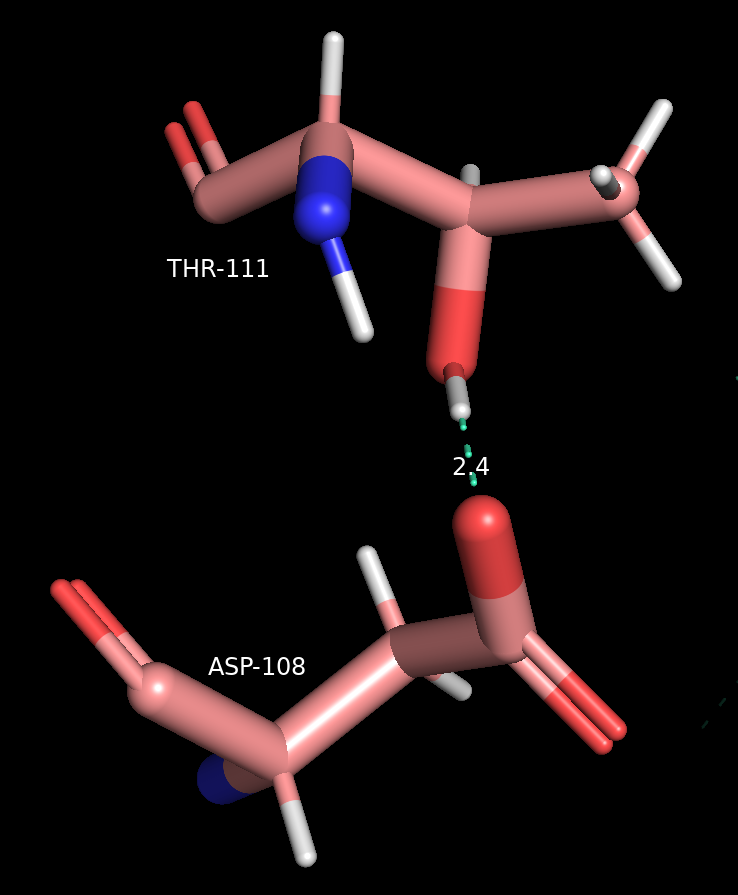
Водородная связь, затрагивающая атомы боковых радикалов аминокислот
Донорно-акцепторная связь между электроотрицательным атомом, содержащим неподеленную электронную пару, и водородом, ковалентно связанным с другим электроотрицательным атомом.
Длина: 2.5-3.5 Å
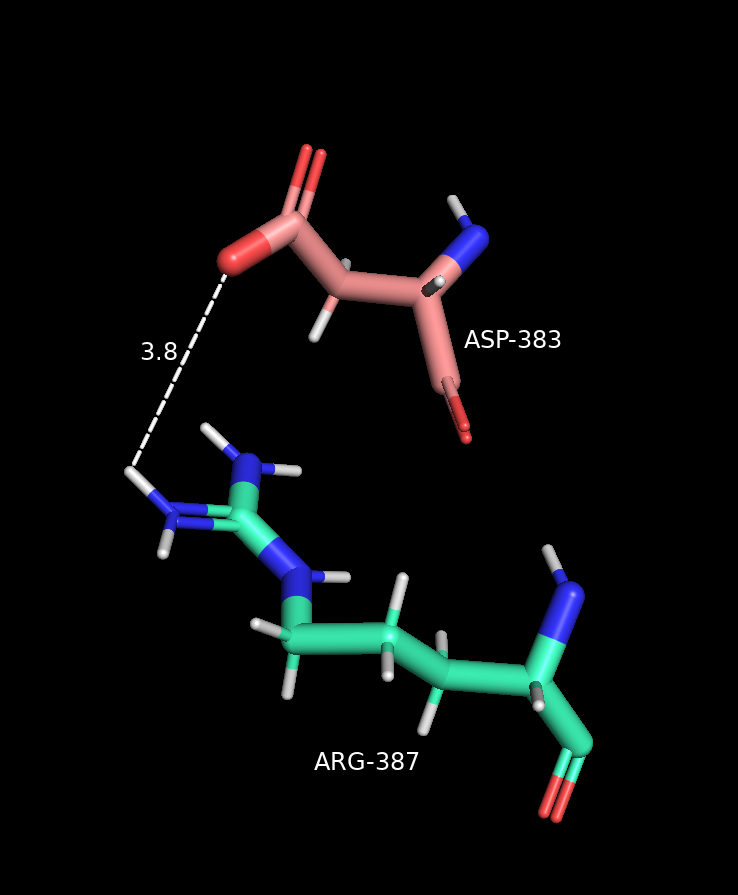
Солевой мостик
Связь на основе электростатических взаимодействий между разнозаряженными атомами.
Длина: 3-4.5 Å
Дисульфидная связь
Связь между атомами серы цистеинов, которая поддерживает третичную структуру белка.
В AHBA синтазе дисульфидная связь отсутствует, так как цистеины располагаются далеко друг от друга.
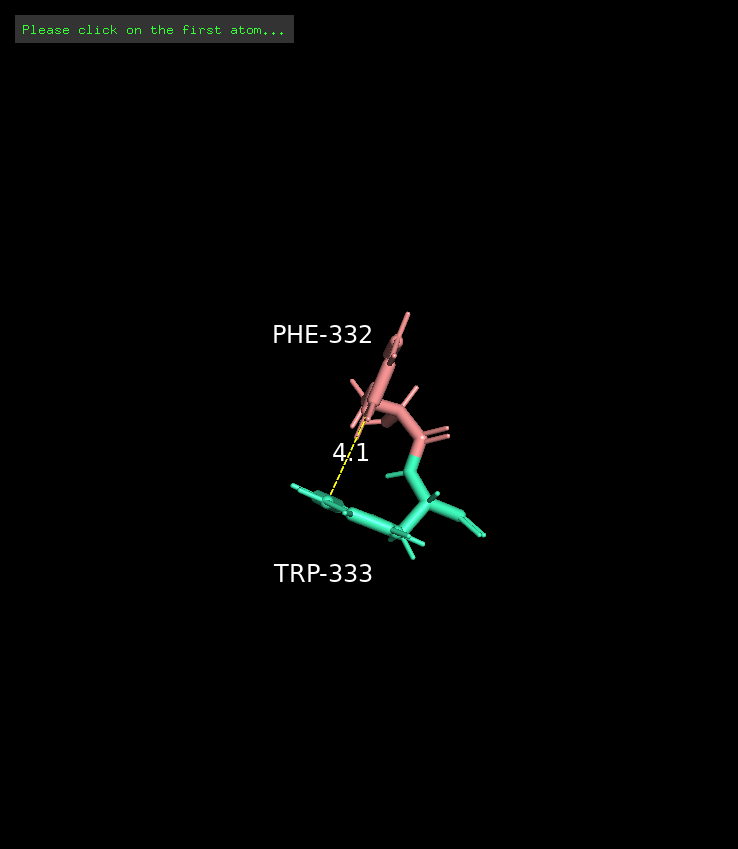
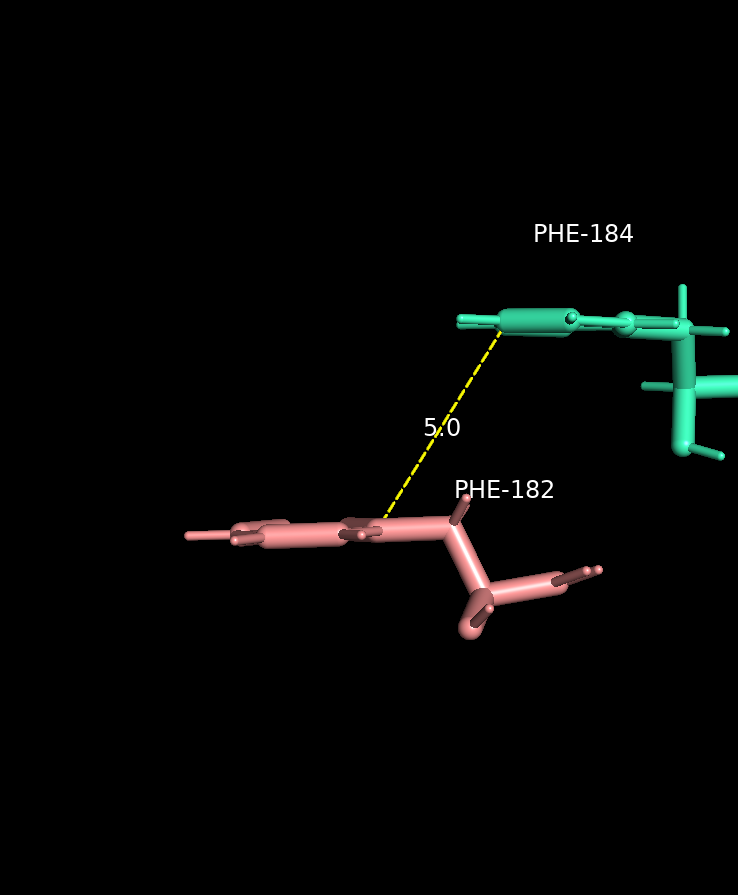
Стекинг
Связь, основанная на электростатических взаимодействиях, между ароматическими кольцами. Сущетсвует три вида стекинга: параллельно сдвинутый, T-стекинг и π-катионный.
Длина: 4-6 Å
Список литературы
- Eads JC, Beeby M, Scapin G, Yu TW, Floss HG. Crystal structure of 3-amino-5-hydroxybenzoic acid (AHBA) synthase. Biochemistry. 1999 Aug 3;38(31):9840-9. doi: 10.1021/bi990018q. PMID: 10433690.
- Kim CG, Yu TW, Fryhle CB, Handa S, Floss HG. 3-Amino-5-hydroxybenzoic acid synthase, the terminal enzyme in the formation of the precursor of mC7N units in rifamycin and related antibiotics. J Biol Chem. 1998 Mar 13;273(11):6030-40. doi: 10.1074/jbc.273.11.6030. PMID: 9497318.