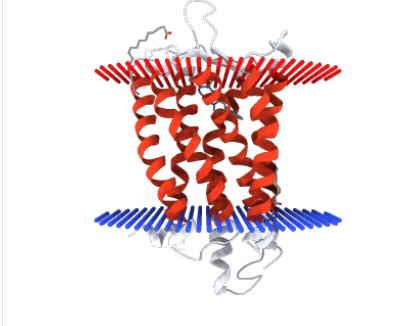
Мембранные белки.
Рецепторы, сопряжённые с G-белком,
также известные как серпентины, составляют большое семейство трансмембранных рецепторов.
Опиоидные рецепторы — разновидность рецепторов нервной системы, относящихся к рецепторам,
сопряжённым с G-белком. Основная их функция в организме — регулирование болевых ощущений. В настоящее время различают
четыре основные группы опиоидных рецепторов: μ- (мю), δ- (дельта), κ- (каппа) и ноцицептиновые (ORL1) рецепторы. Они связываются
как с эндогенными (вырабатываемые в организме), так и с экзогенными (поступающими извне) опиоидными лигандами.
Опиатные рецепторы широко распространены в головном, спинном мозге, а также в желудочно-кишечном тракте и других органах.
История открытия:
К середине 1960-х годов, анализируя результаты фармакологических исследований, учёные стали предполагать, что опиоиды, вероятно,
действуют на специфические рецепторы. Первое
такое исследование было опубликовано в 1971 году. Это исследование было признано как первое точное обнаружение опиоидных рецепторов,
хотя вскоре после него в этом же году были проведены два других подобных исследования.В начале 1990-х
годов в молекулярно-биологических исследованиях выяснили структуру и механизм действия опиоидных рецепторов. Четыре различные кДНК
были выделены как представители семейства опиоидных рецепторов.Три из них соответствуют µ-, δ- и κ-рецепторам, а четвёртая —
новому типу рецепторов — ноцицептивным.
N/OFQ опиоидный рецептор в комплексе с пептидом-миметиком.
В отличие от "классических" опиоидных рецепторов, δ, κ и μ (δ-OR, κ-OR и μ-OR), которые были определены фармакологическими
критериями в 1970-х и 1980-х годах, пептидный рецептор ноцицептин(N/OFQ) (NOP,
также известный как ORL-1) был обнаружен относительно недавно путем молекулярного клонирования.Хотя он
имеет высокое сходство последовательности с классическими опиоидными подтипами GPCR (≈60%), NOP имеет заметно различную фармакологию,
отличающуюся активацией эндогенным пептидом N/OFQ и уникальной селективностью для экзогенных лигандов.
Этот белок мы имеет кристаллическую структуру в комплексе с пептидным миметическим антагонистом.
Данный белок выбран путем поиска серпентинов, пройденных нами недавно на ФЧЖ.
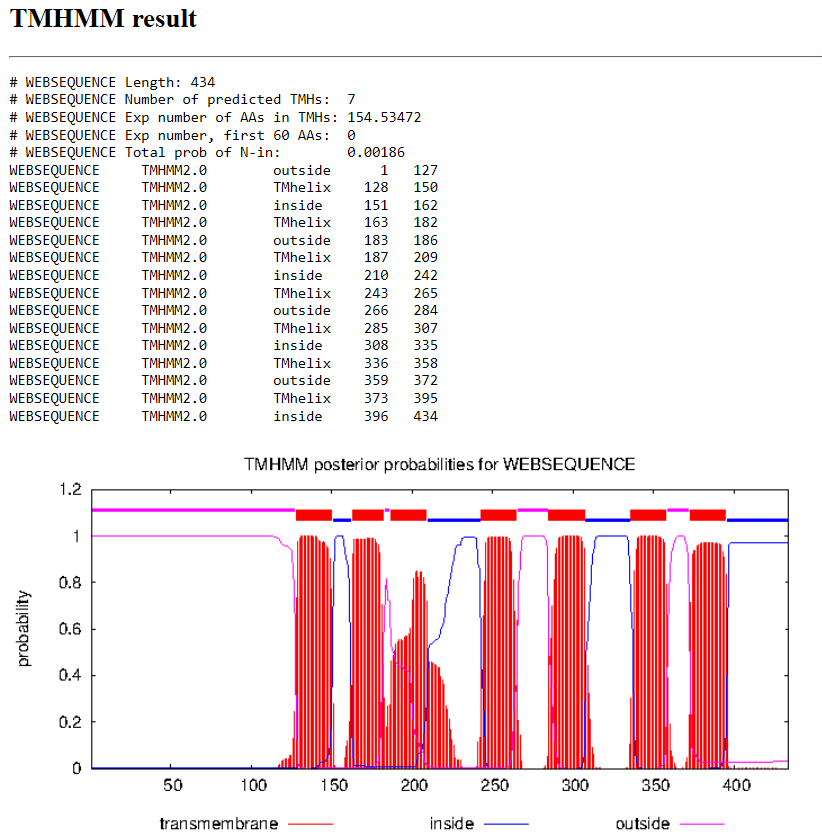
Всего в данной выдаче наблюдается 7 трансмембранных участков. Это с высокой вероятностью трансмембранный белок, так как чередуются
экстрацеллюлярные и интроцеллюлярный фрагменты. Алгоритм валиден. Неровный 3й фрагмент может объясняться, к примеру,
изменением сродства к мембране со временем.
Структура белка в RCSB PDB: