 |
 |
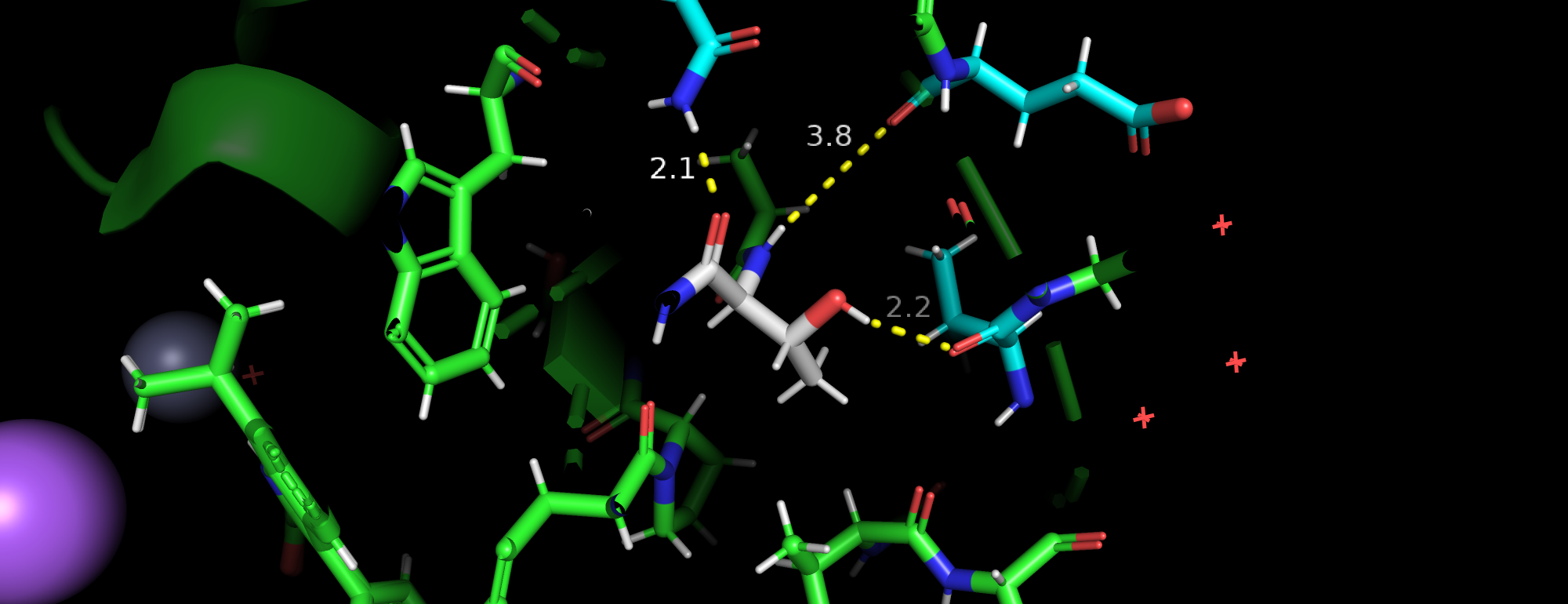
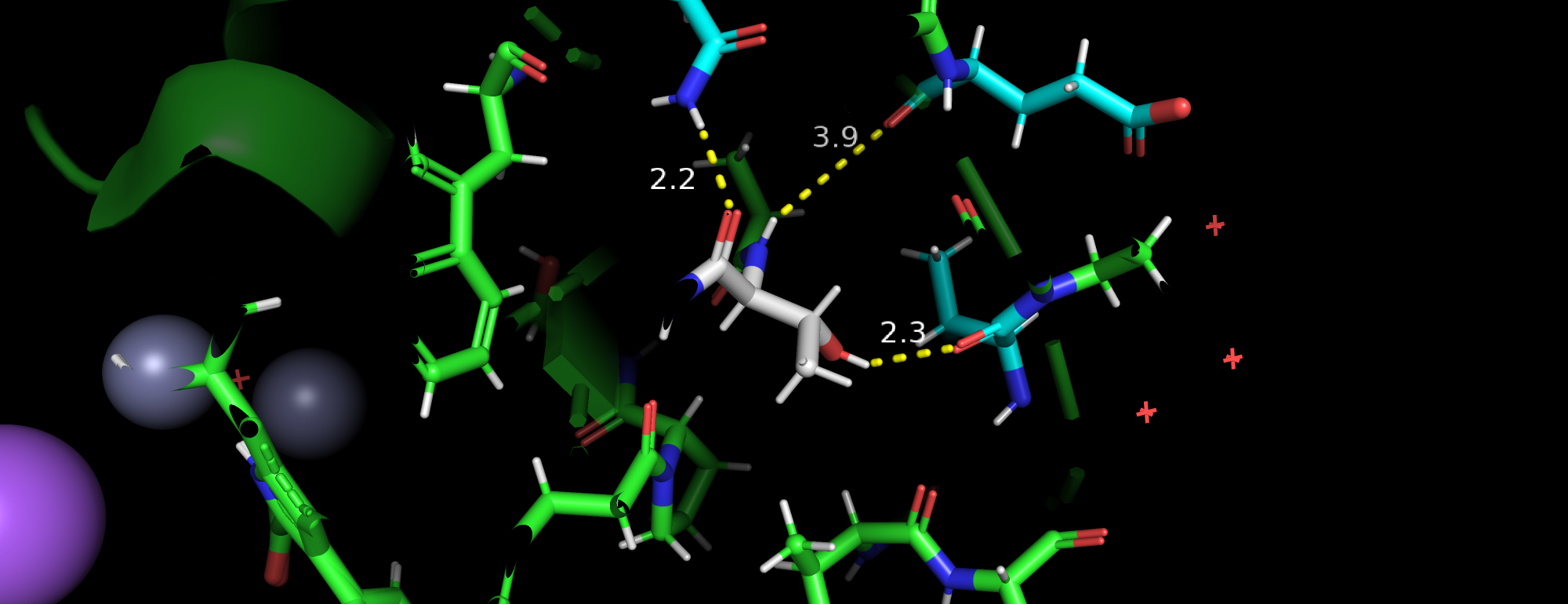
| Рис 1.Конформация А и конформация B. |
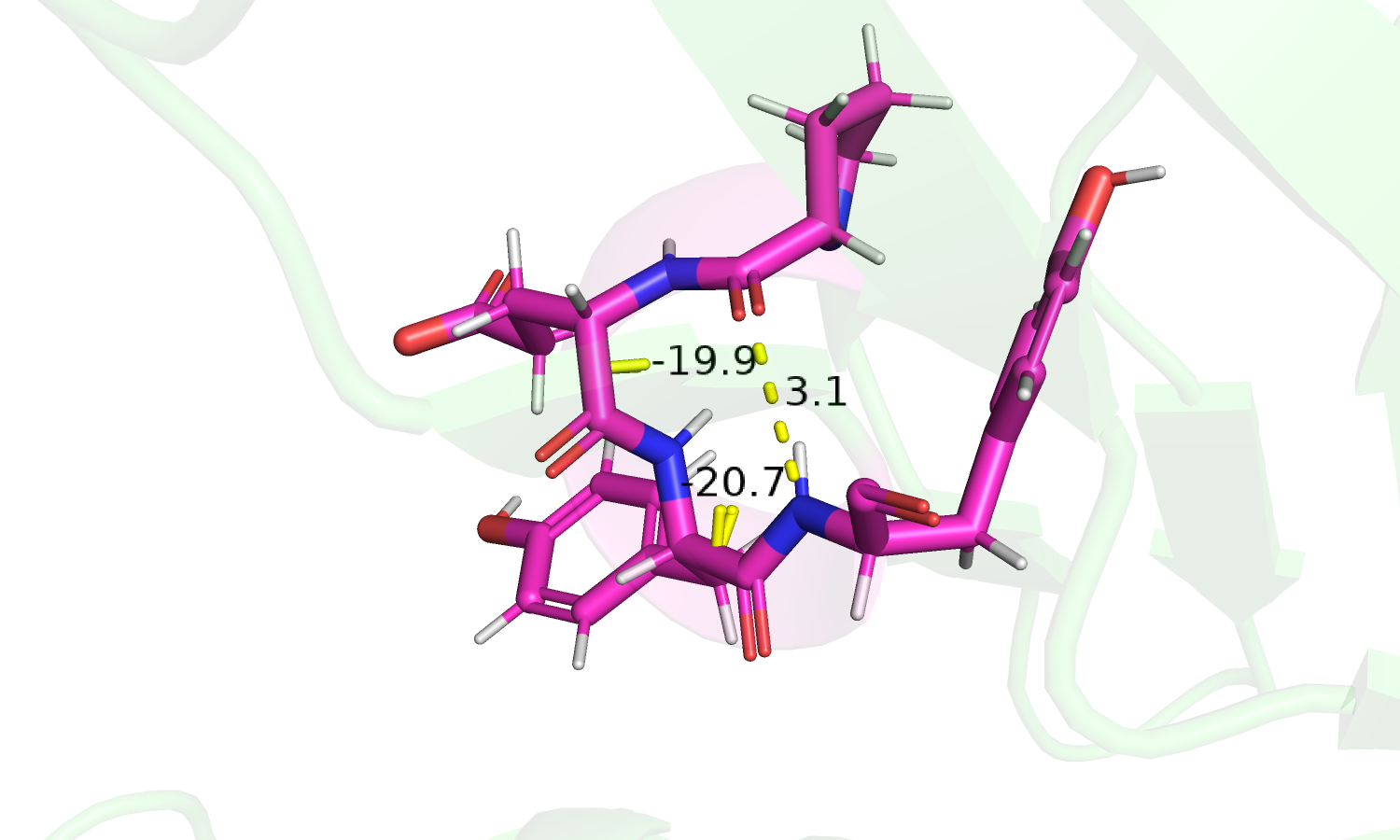 |
| Рис 2. Остов с покраской по B-фактору. |
 |
 |
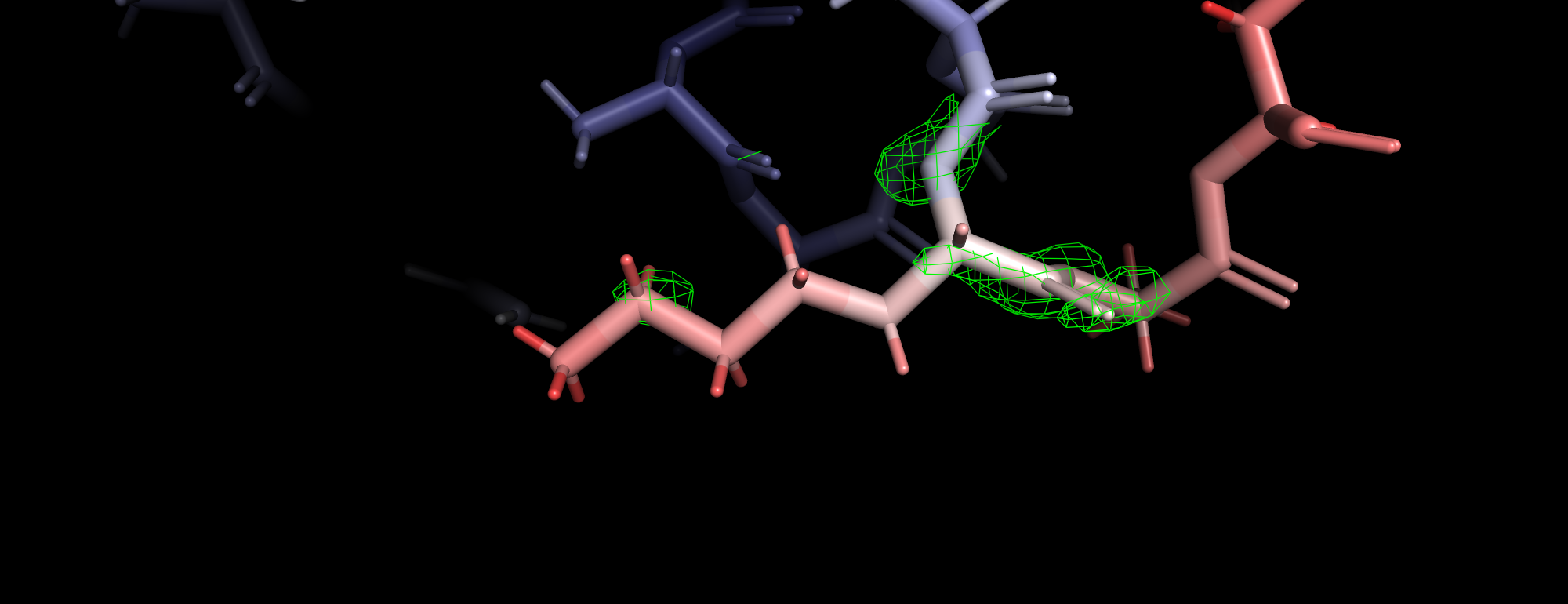 |
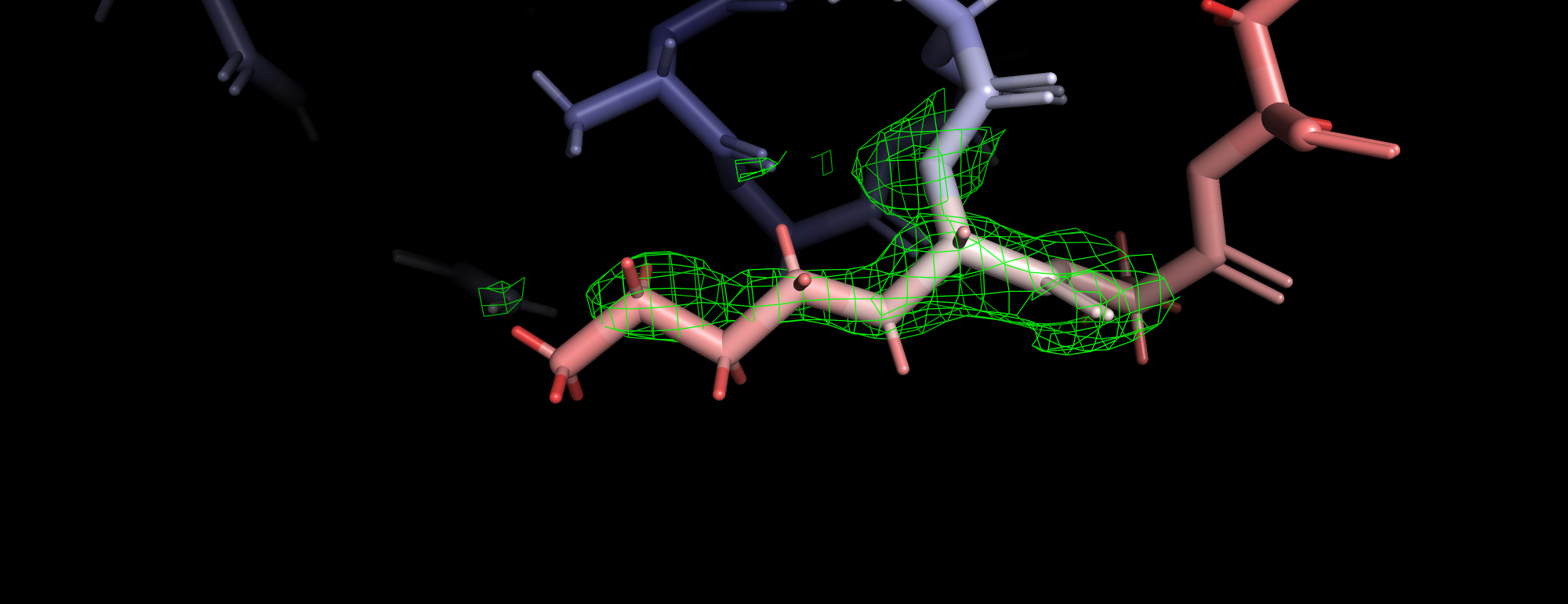
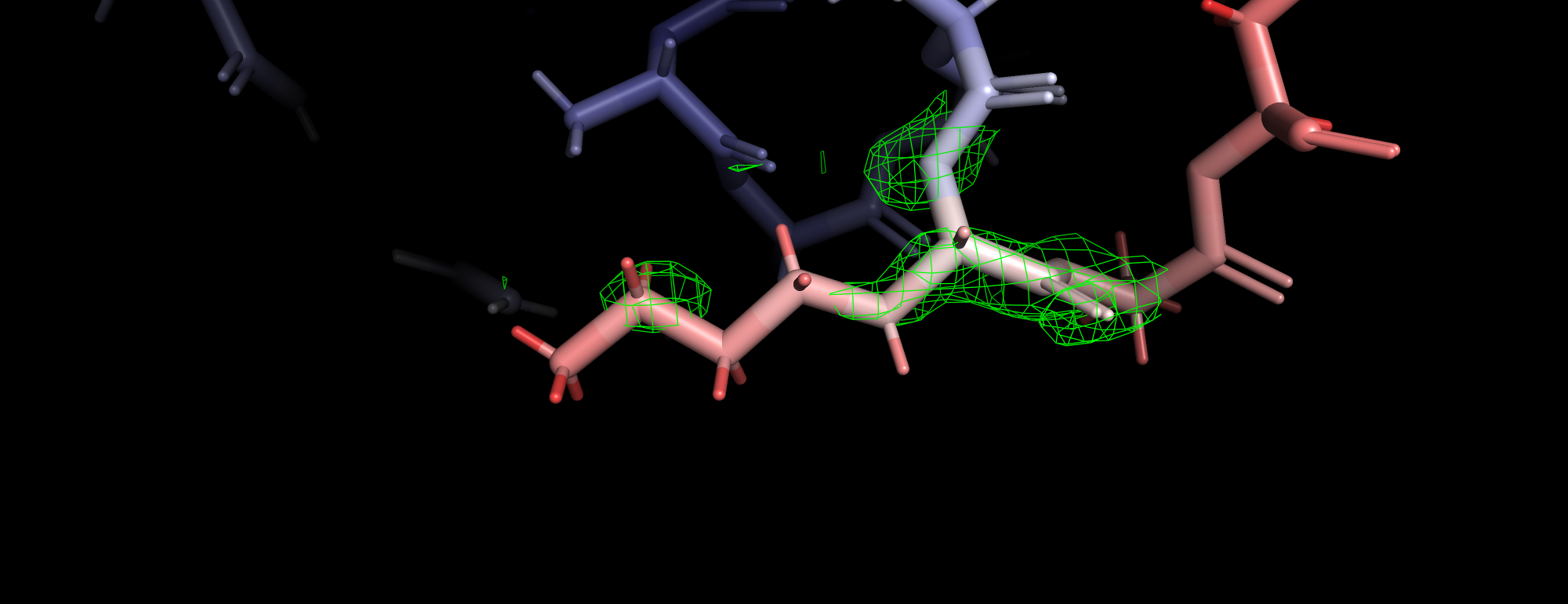
| Рис 3. Уровень подрезки 1, уровень подрезки 1.5, уровень подрезки 2 (carve 1.3). |
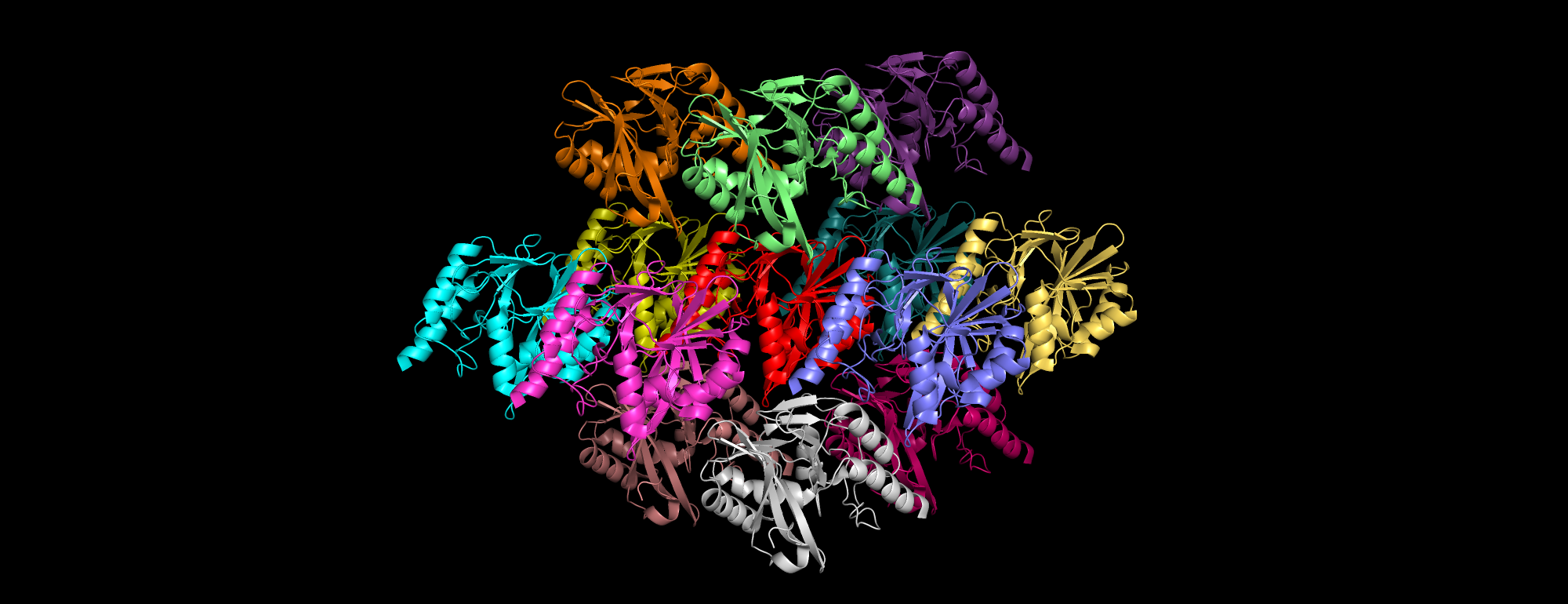 |
| Рис 4. Участок кристалла. |
 |
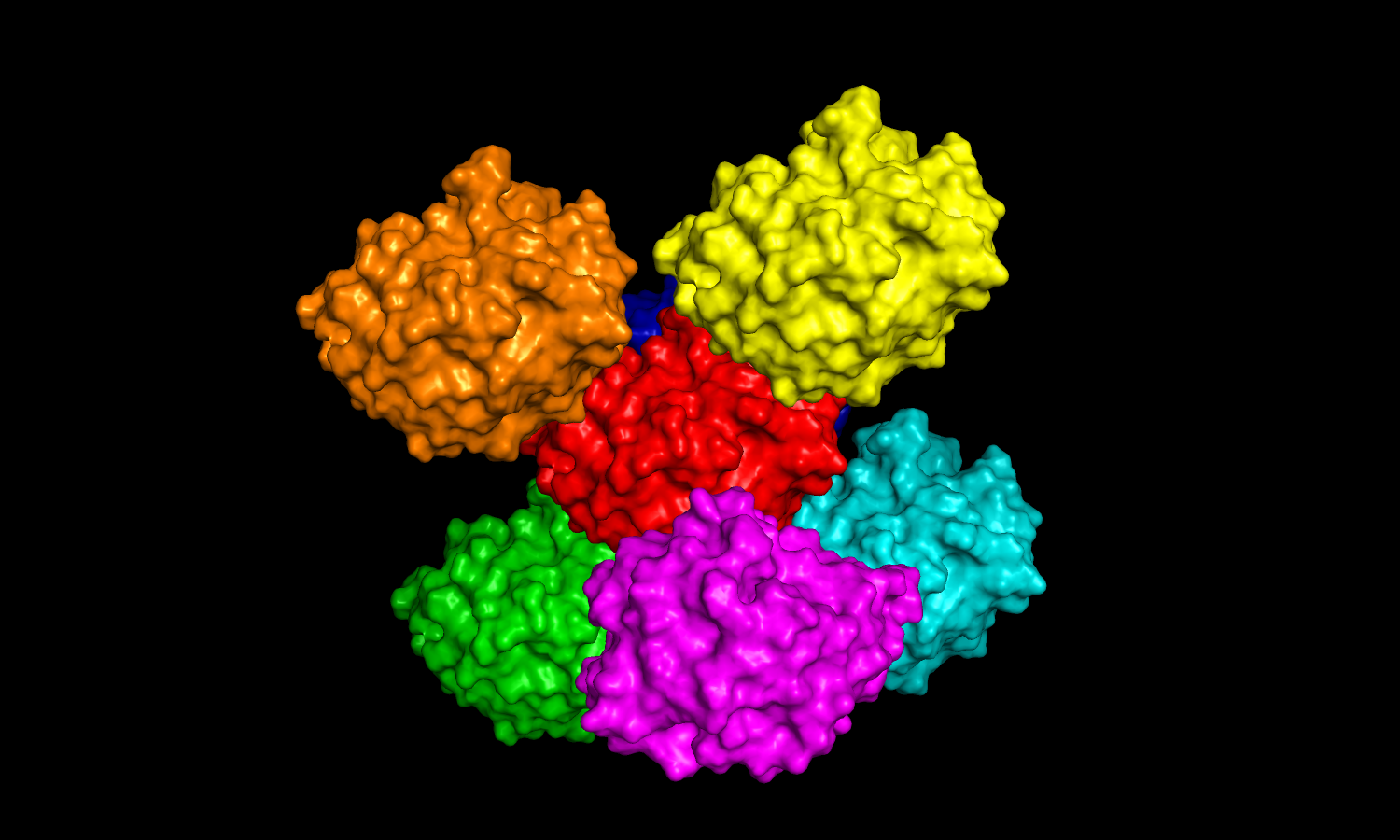 |
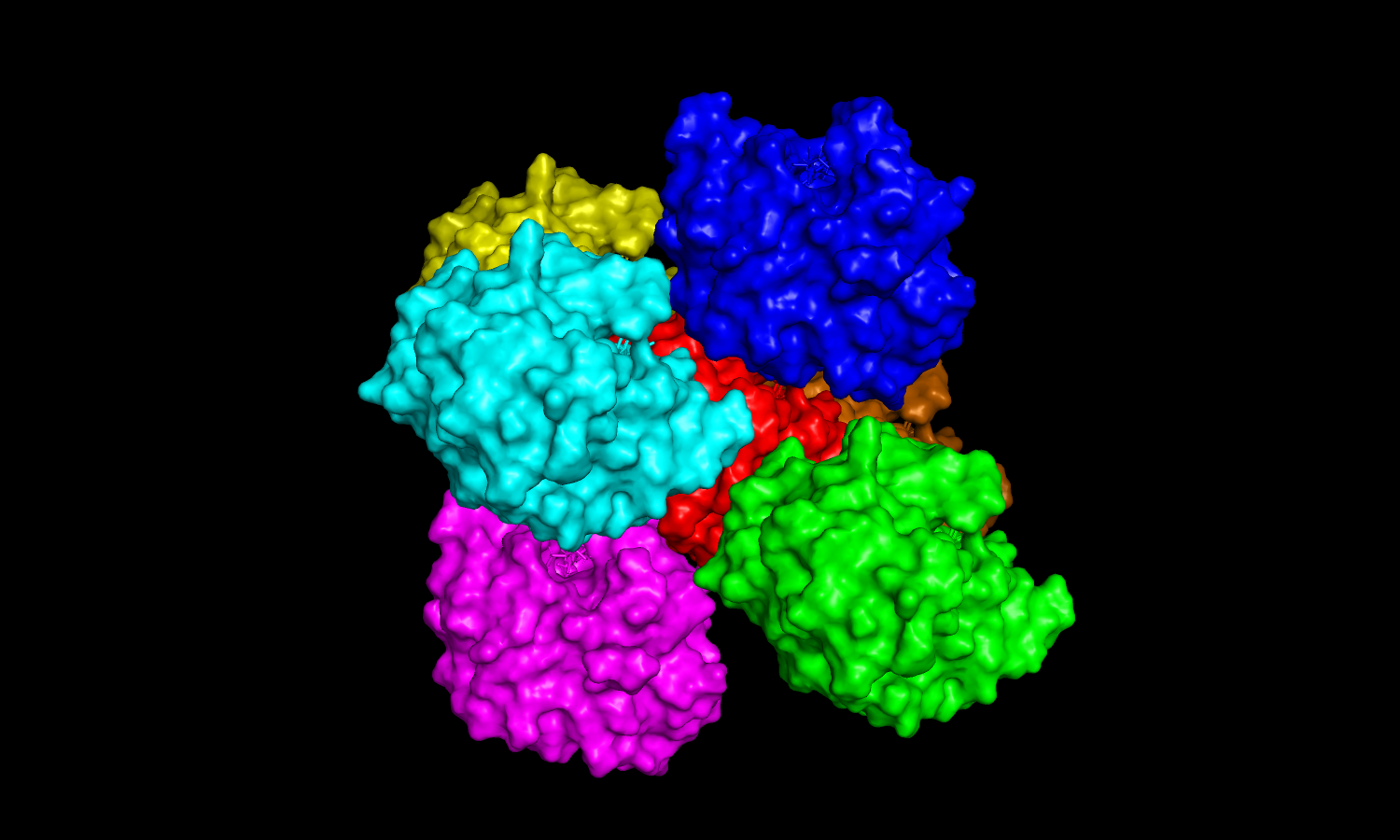
| Рис 5. Соседи с одной стороны. | Рис 5. Соседи с другой стороны. |