 |
 |
 |
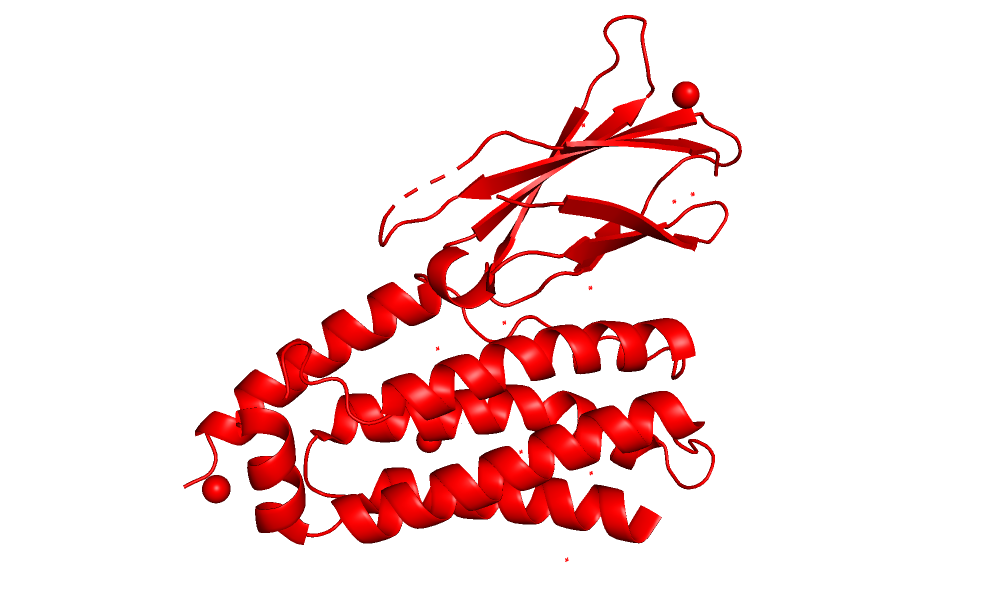
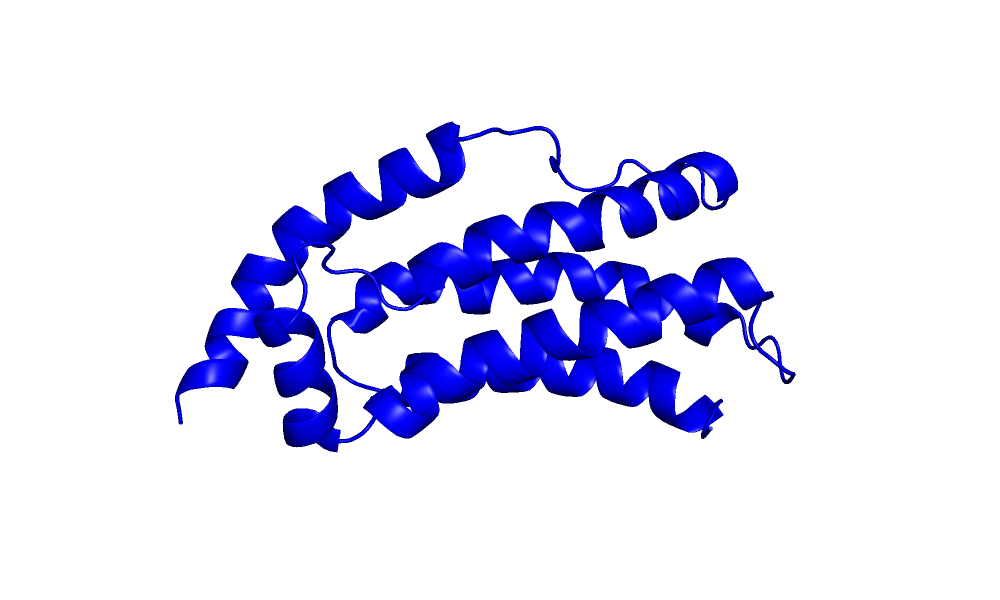
| Рис 2.Выравнивание моделей.Красная - Рса, синяя - ЯМР. |
 |
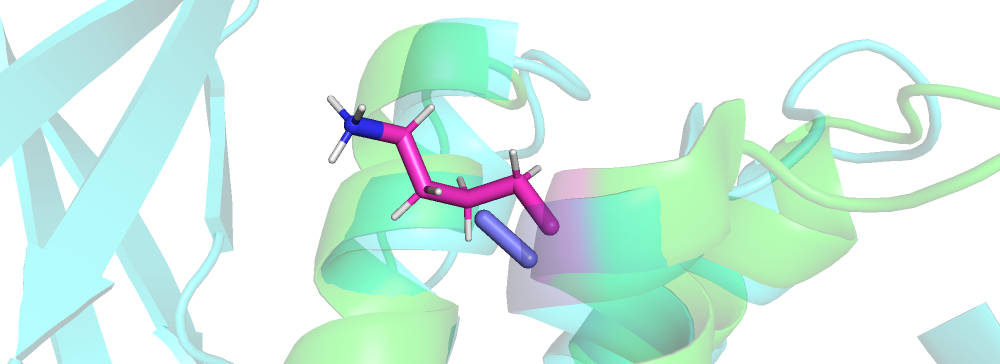 |
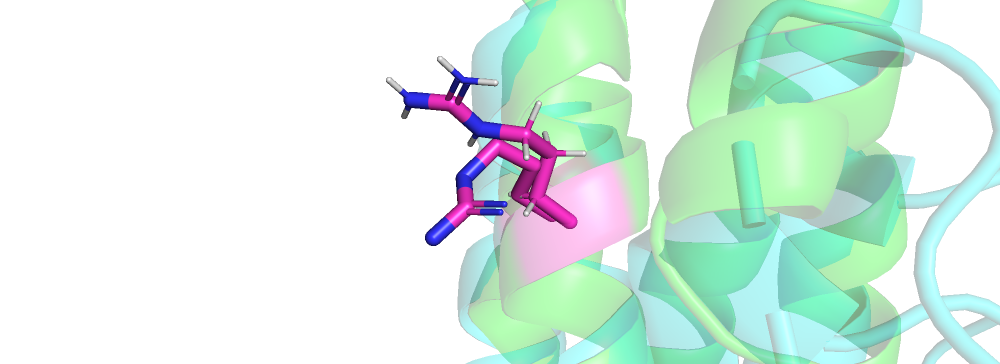
| Рис 4.Arg'57 | Lys'103 |
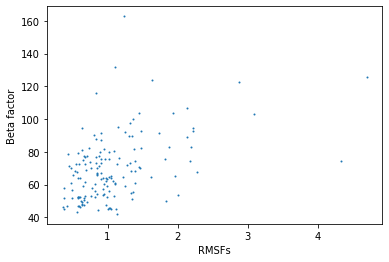 |
| Рис 4.Зависимость средних B-факторов модели РСА от средних RMSF для остатков в модели ЯМР. |
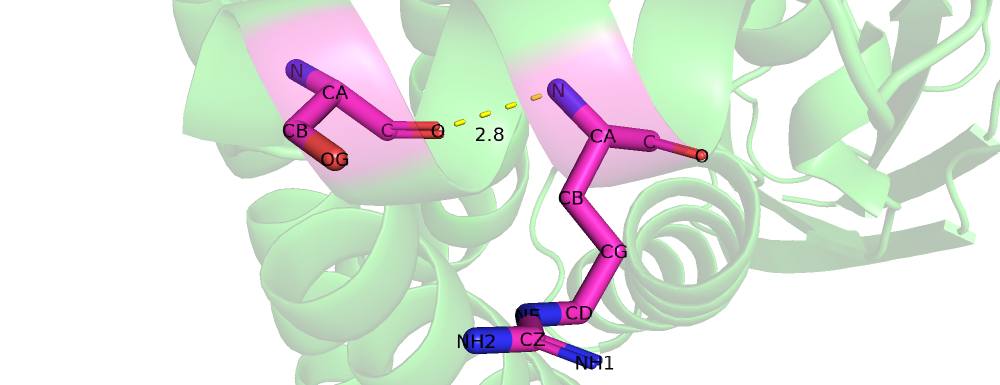 |
| Рис 5. Gly'32, Leu'36 |
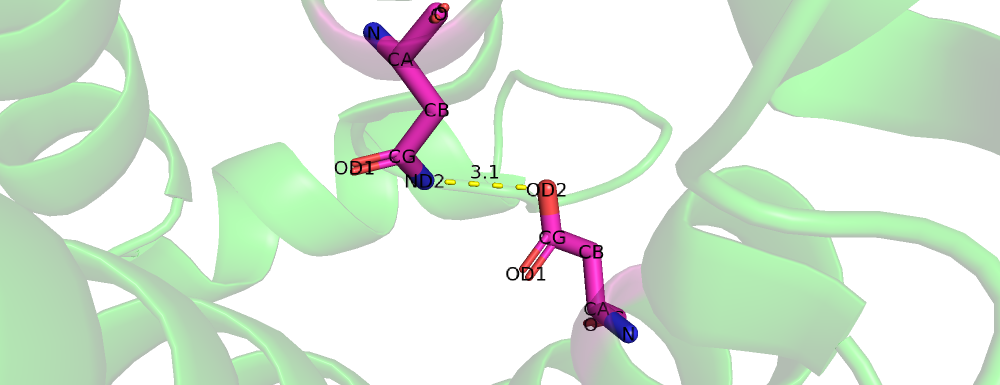 |
| Рис 5. Asn'102, Asp'137 |
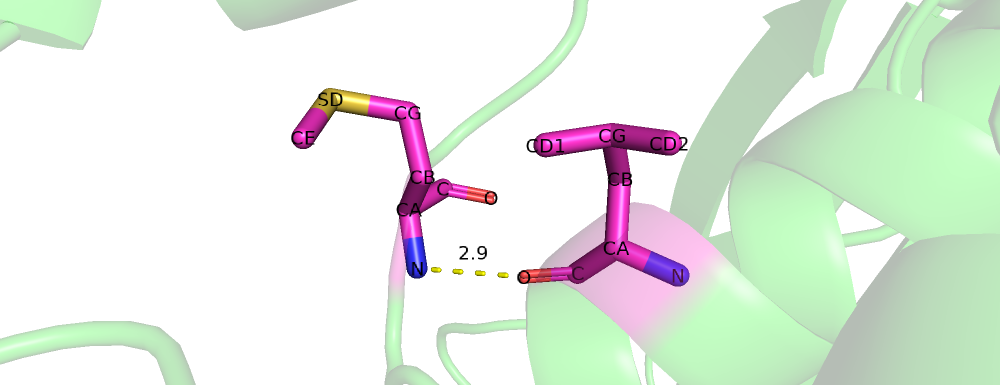 |
| Рис 5. Met`122,Leu`116 |
| Остатки | Расстояния в РСА | Процент водородных связей(ЯМР) | min | max | mean |
| Gly'32, Leu'36 | 3.1 | 95% | 2.74 | 3.55 | 2.98 |
| Asn'102, Asp'137 | 3.1 | 50% | 2.76 | 4.77 | 3.56 |
| Met`122,Leu`116 | 2.9 | 5% | 3.38 | 4.05 | 3.68 |