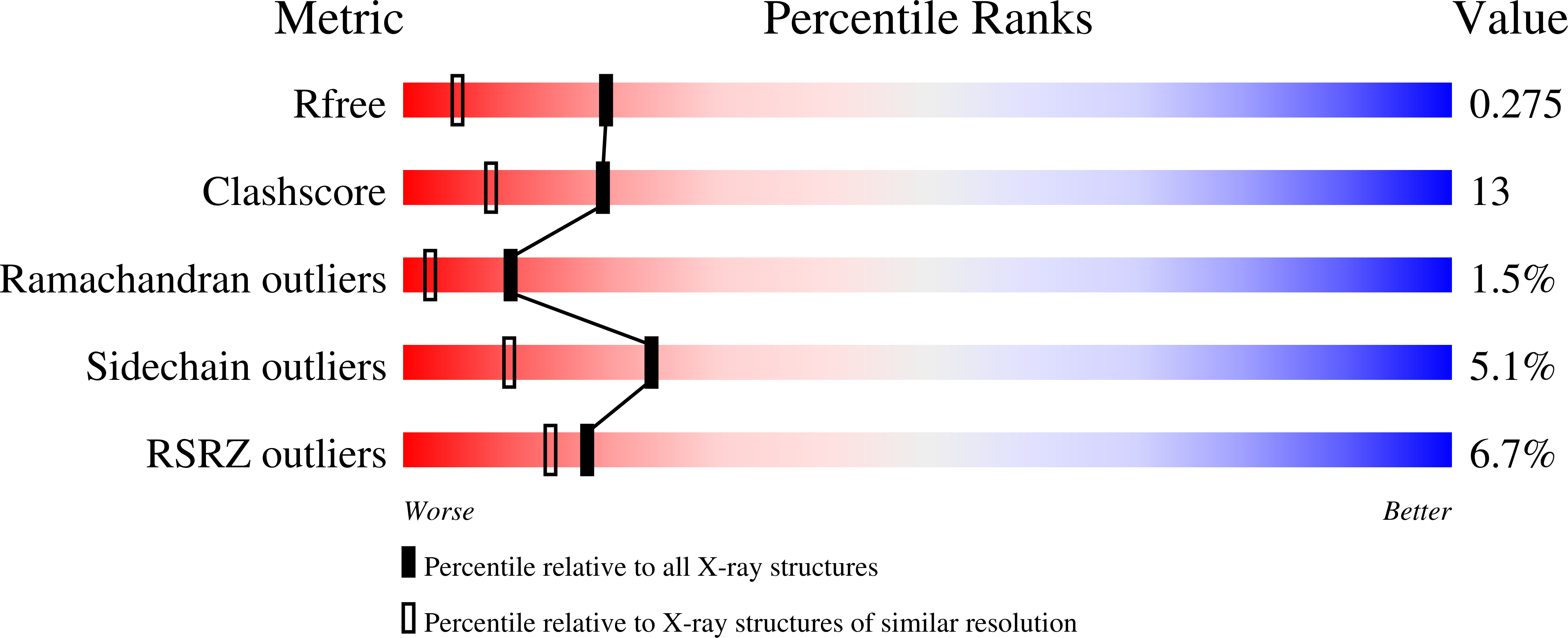
 |
| Рис.1 Для каждой метрики определено два значения:процентильный ранг записи в сравнении со всем архивом pdb и ранг в сравнении с записями, определенными тем же экспеиментальным методом. Чем ближе показатель к голубой области, тем лучше. |
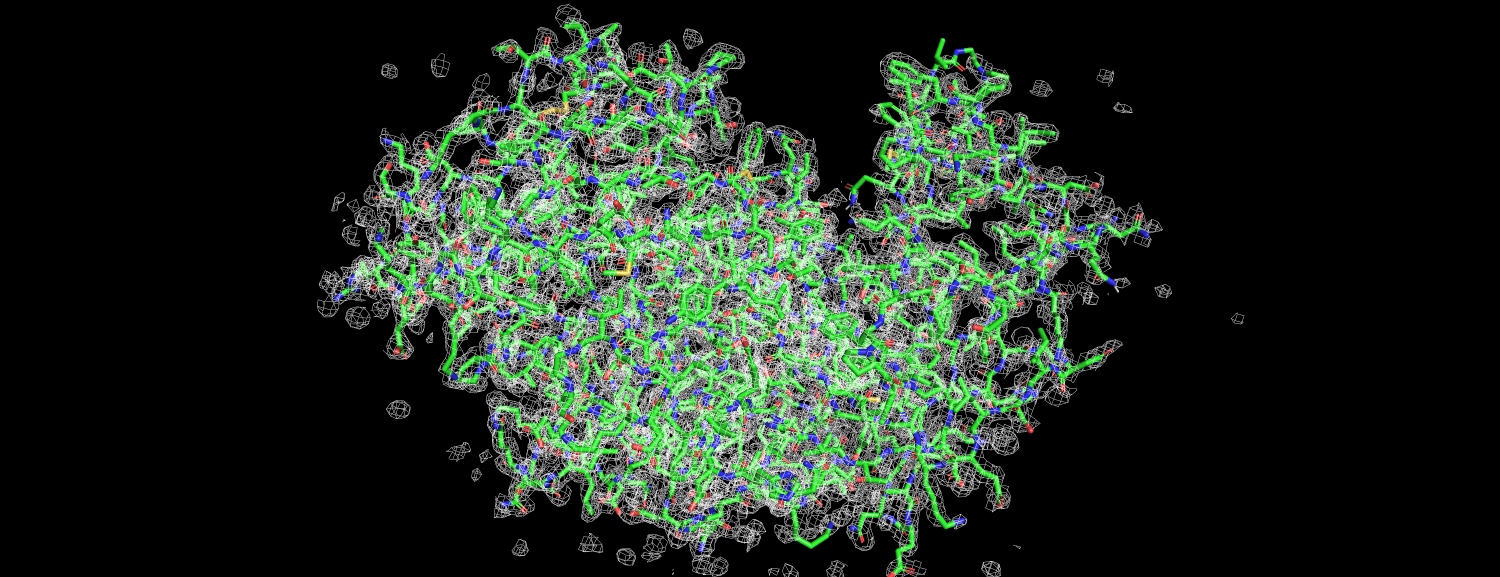 |
| Рис.2 Структура 1LF2; carve = 1.2, mesh = 1 |
.png) |
| Рис 3. Lys'327, маргинал по критерию "боковые цепи"; carve = 1.4, mesh = 1. |
| Рис 4. Карта Рамачандрана для изолейцина 277. |
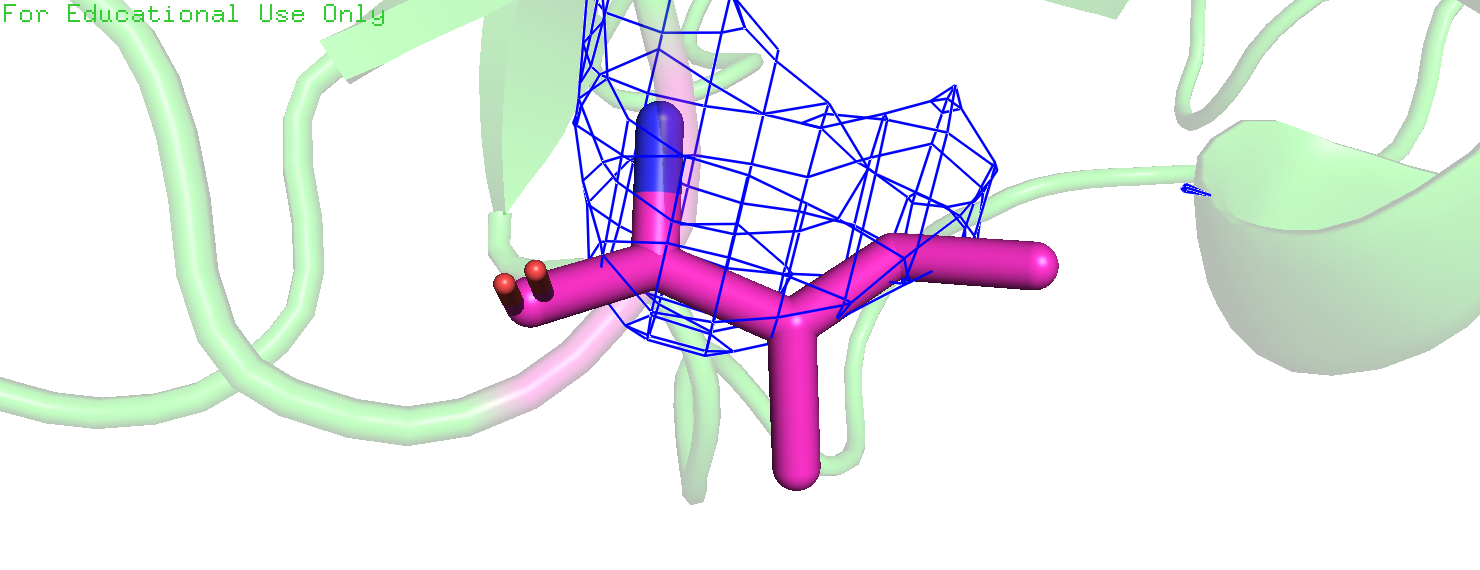 |
| Рис 5. Ile'277, маргинал по критерию "Торсионные углы"; carve = 2, mesh = 1. |
.png) |
| Рис 6. Met'286, маргинал по критерию "длина связи". carve = 1.5, mesh = 1. |
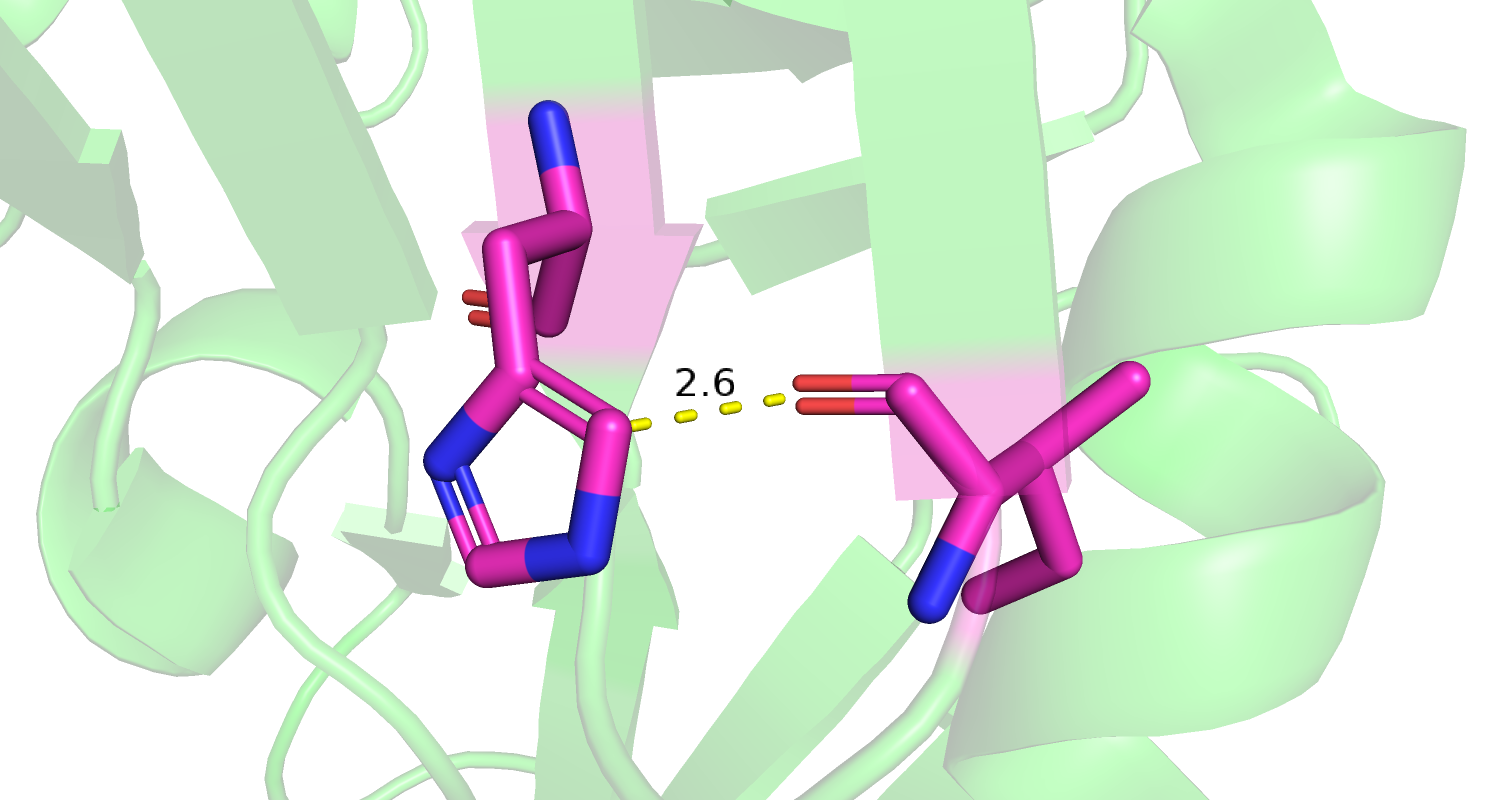 |
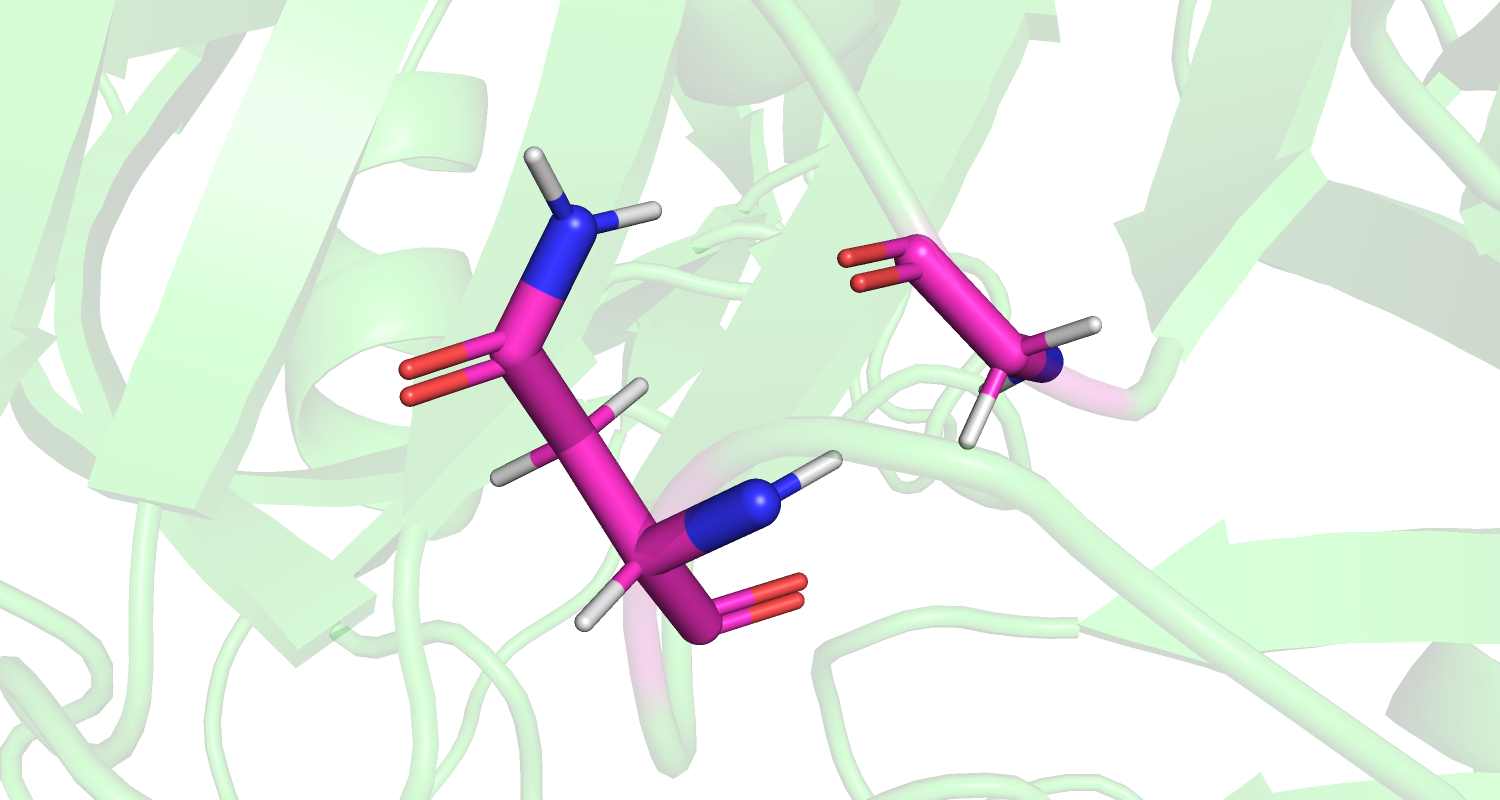
| Рис 7. His'200, Ile'204, маргиналы по критерию Clashscore. |
 |
| Рис 8.Gly'171 и Asn'151; маргинал Asn'151, который являвется инверсией. |
 |
 |
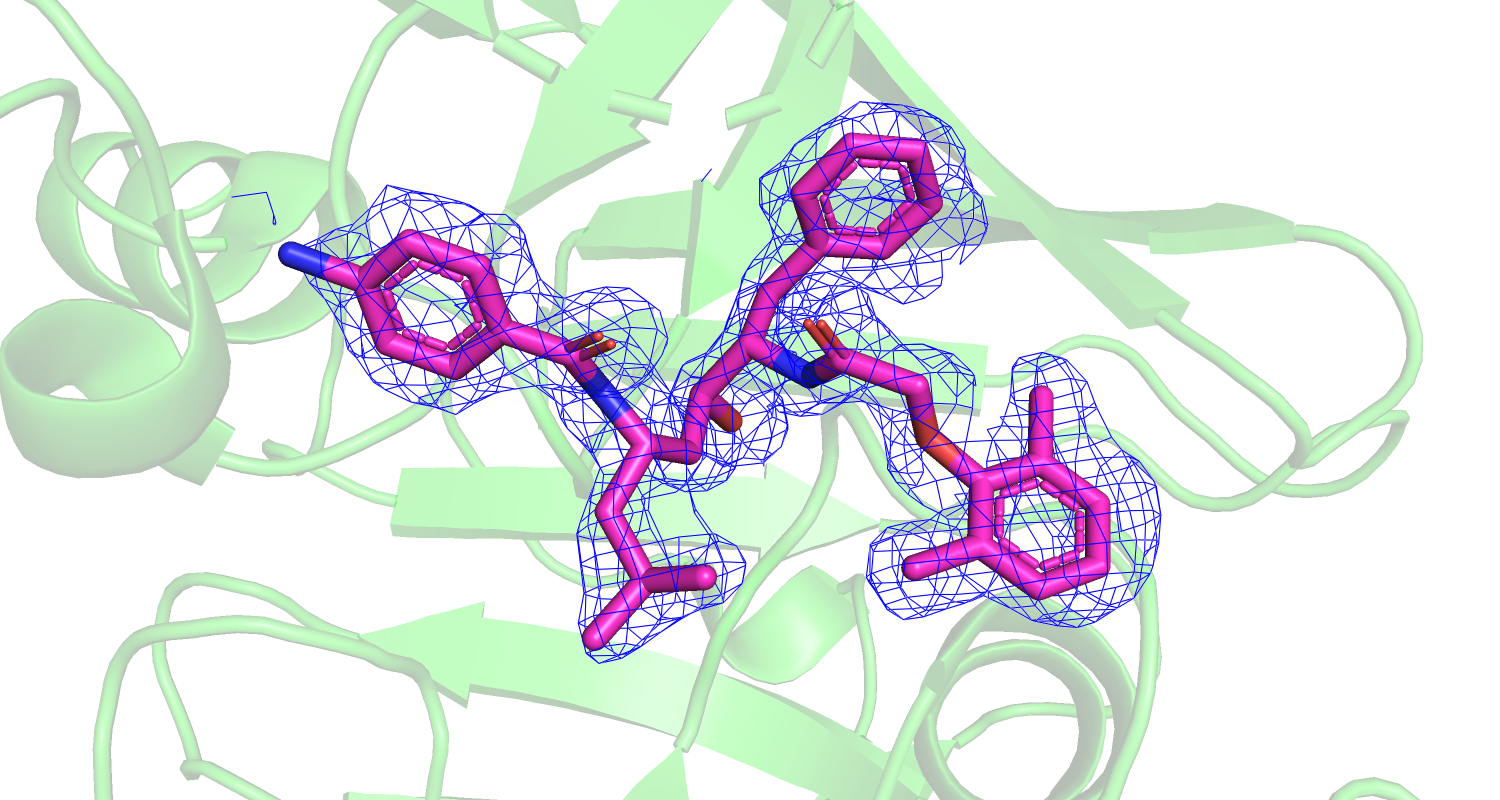
| Рис 9. Электронная плотность ингибитора | Рис. 10 Электронная плотность и водородная связь с лигандом активного сайта Asp34 и Asp214. |
 |
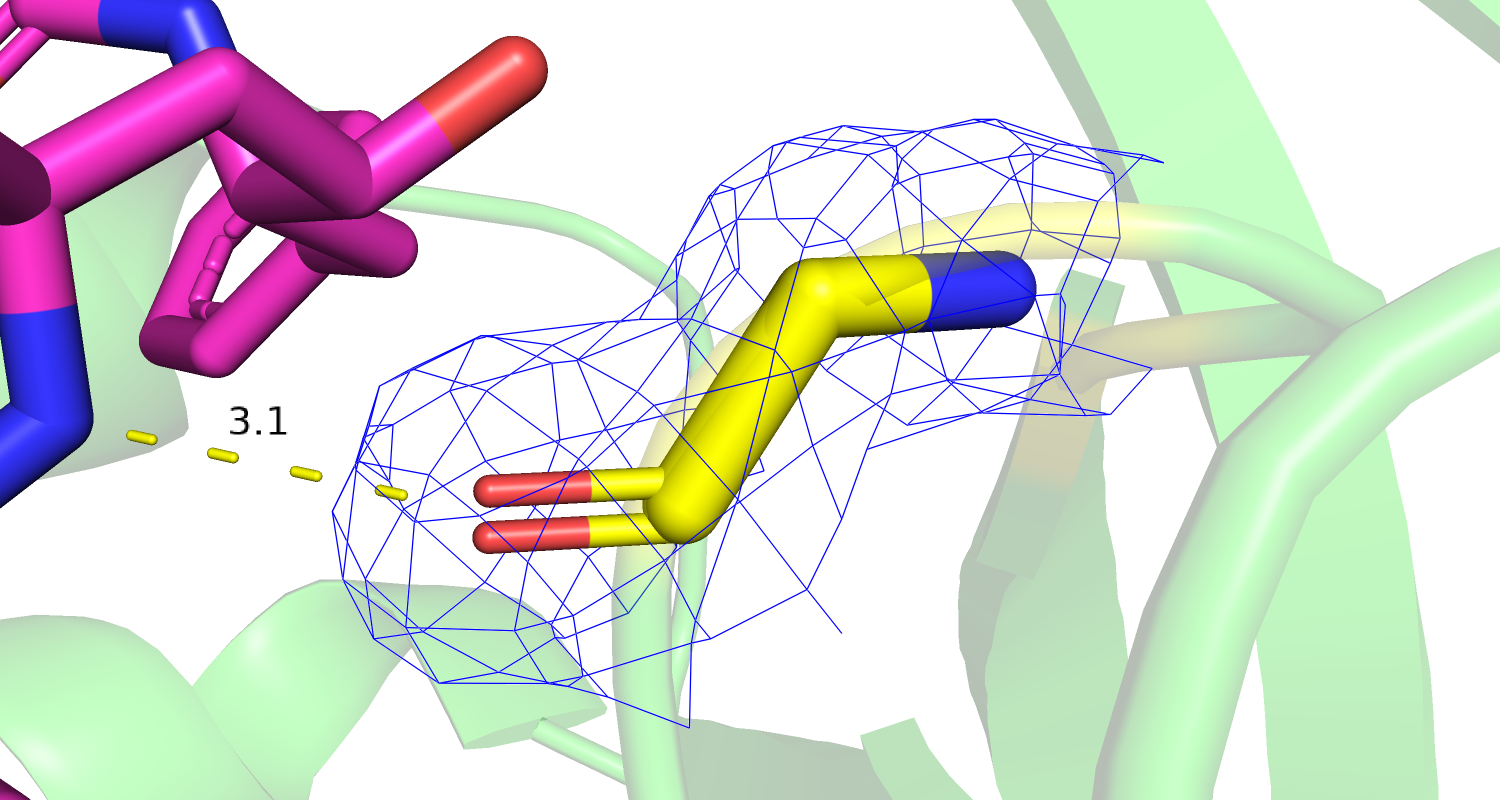 |
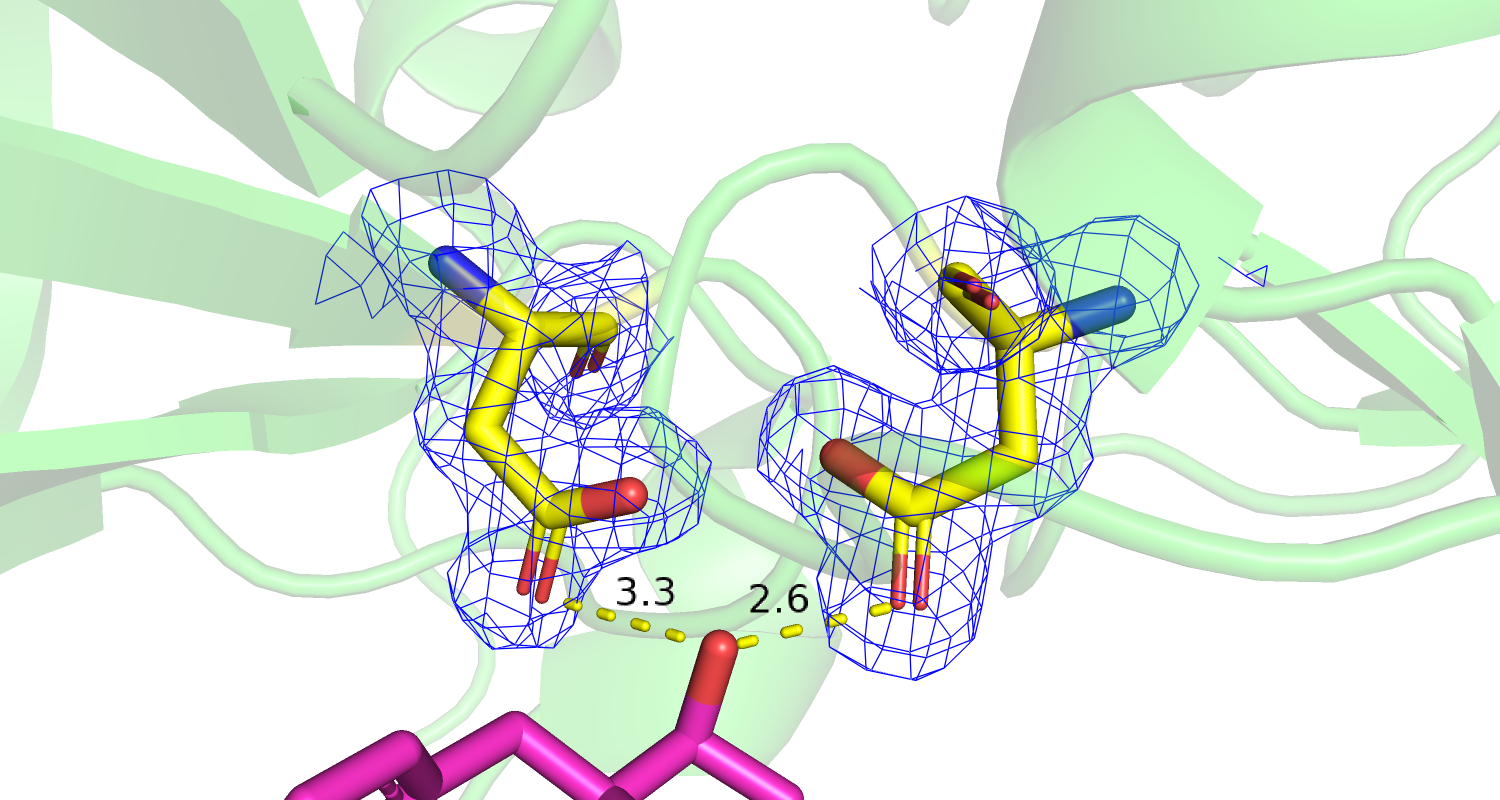
| Рис 11. Электронная плотность и водородная связь с лигандом остатков Val78 and Ser79. | Рис 12. Электронная плотность и водородная связь с лигандом остатка Gly36. |
| Рис 13. Карта Рамачандрана с отражением остатков PDB(синие) и PDB-REDO(оранжевые). |
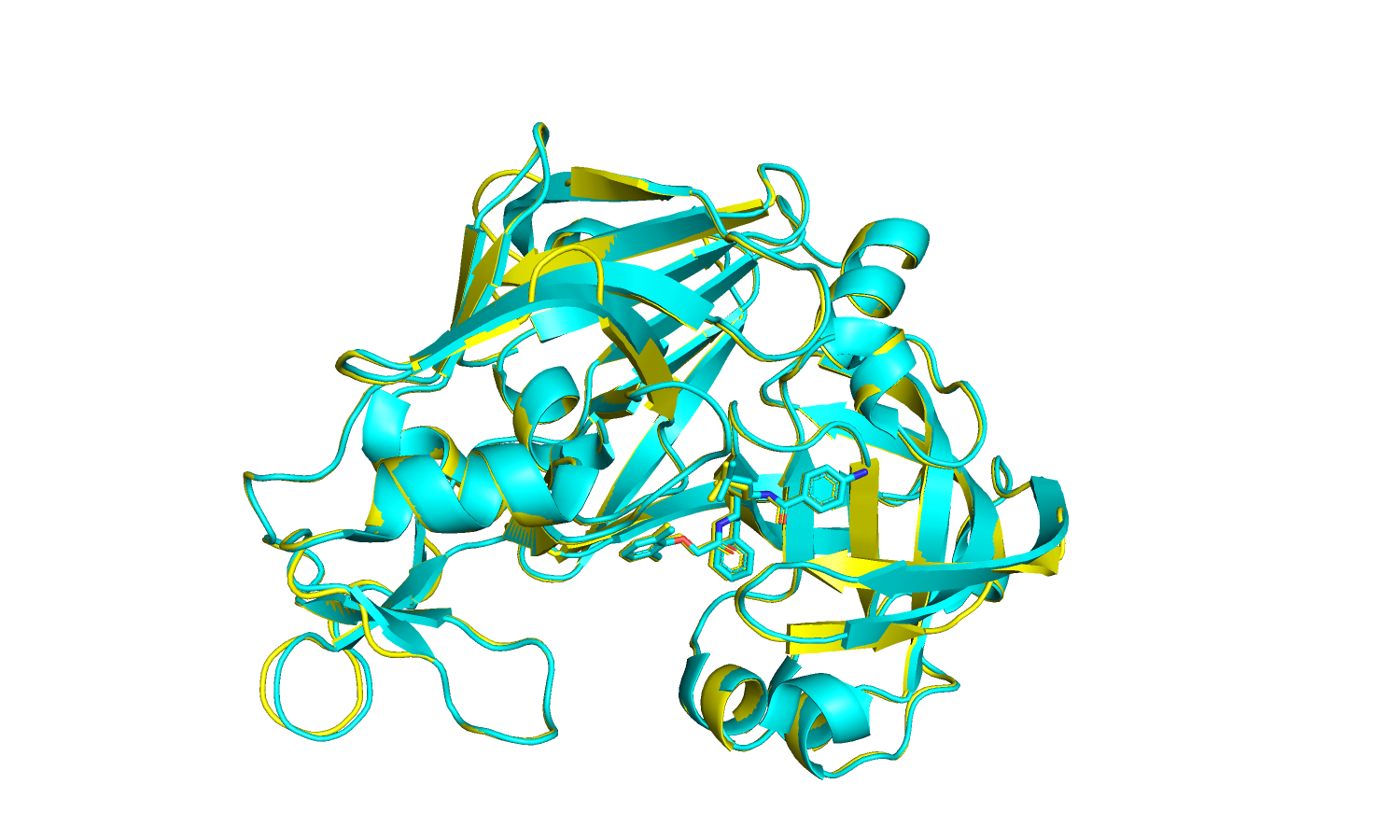 |
| Рис 14. PDB - голубая модель, PDB-REDO - желтая. |
 |
 |
| Рис 15. Asp'162, желтым цветом изображен оптимизированный остаток. | Рис 16. Val'280, желтым цветом изображен оптимизированный остаток. |
.png) |
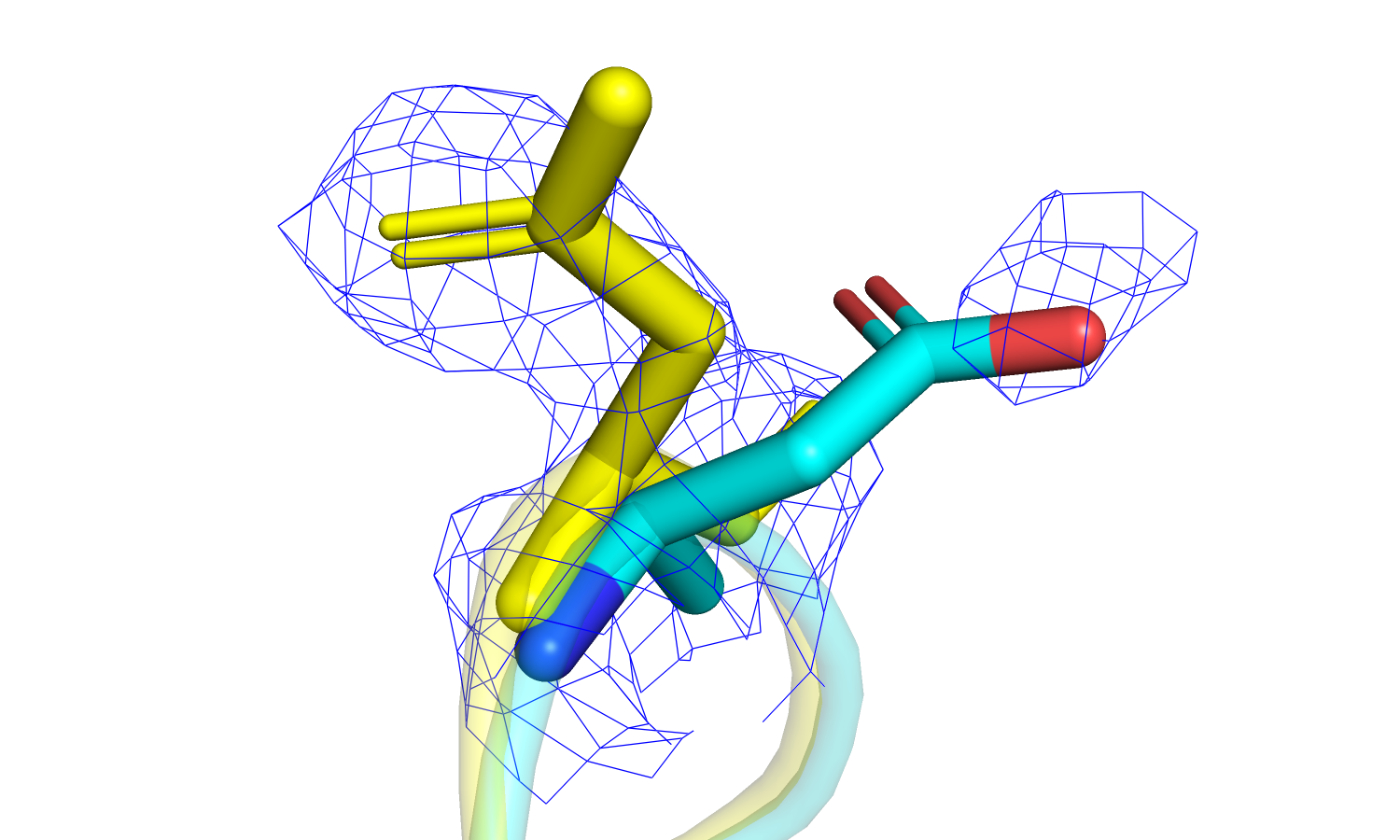
| Рис 17. Электронная плотность остатка Met'286; PDB - голубая модель, PDB-REDO - желтая. |
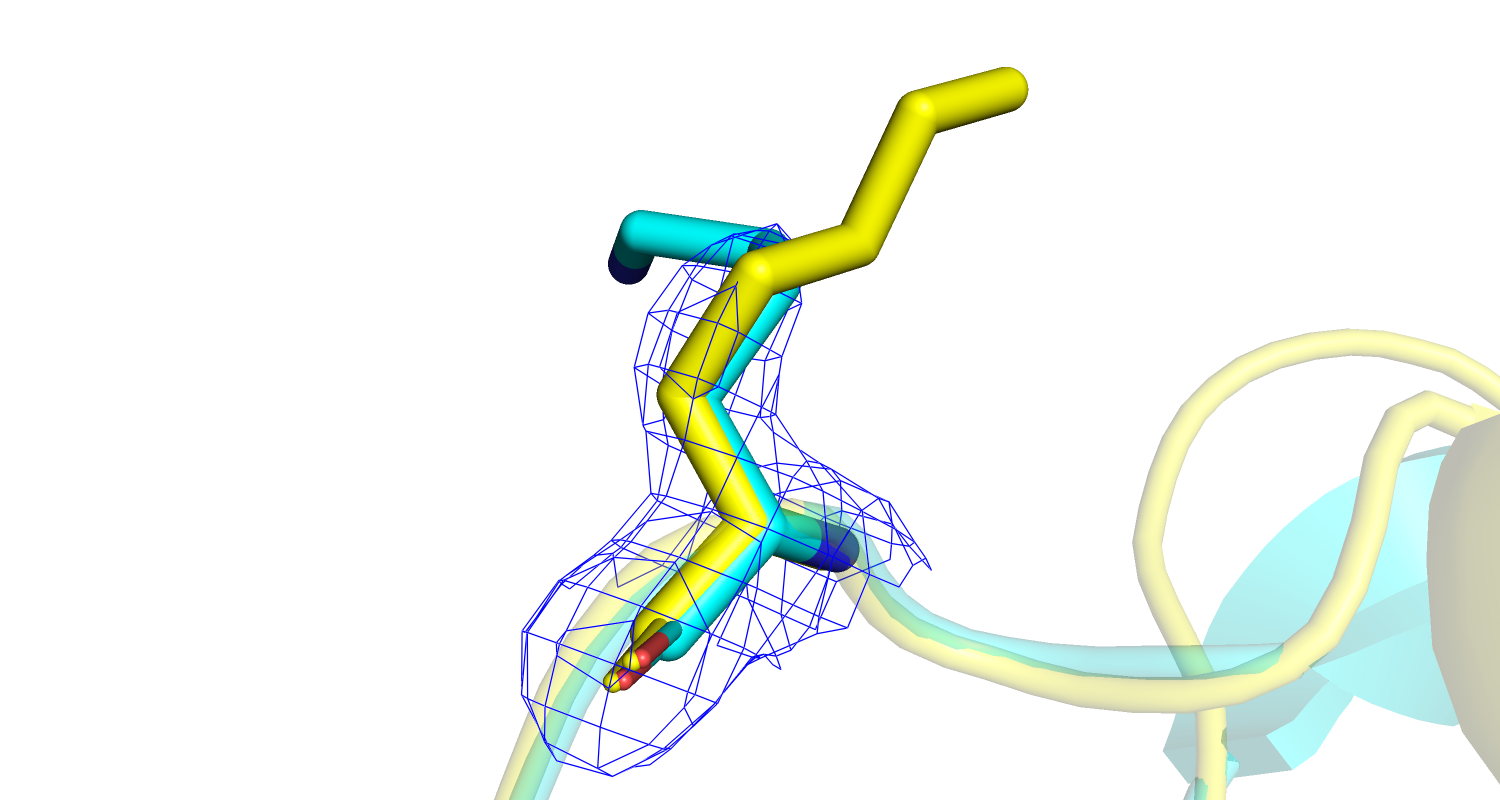 |
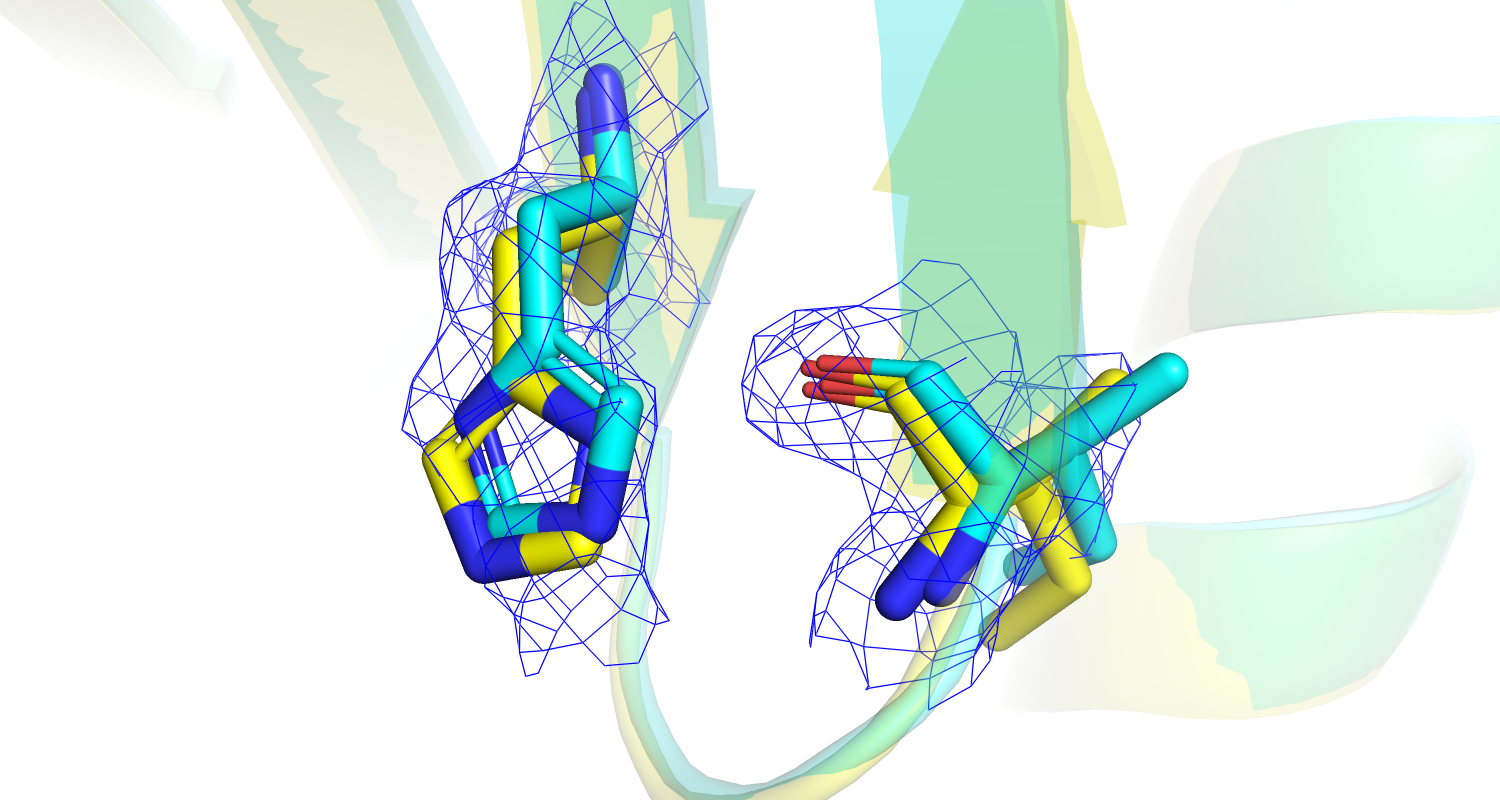 |
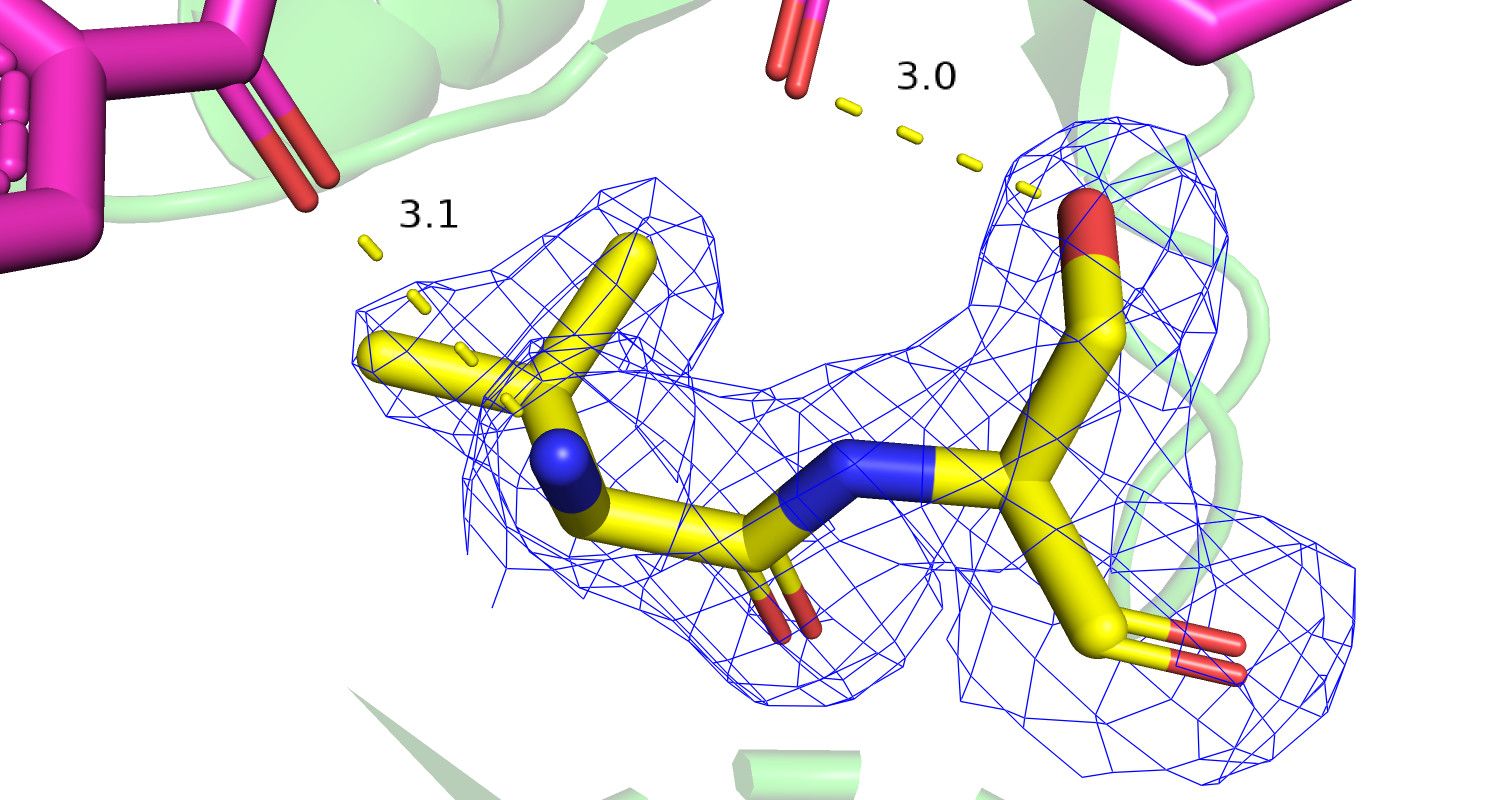
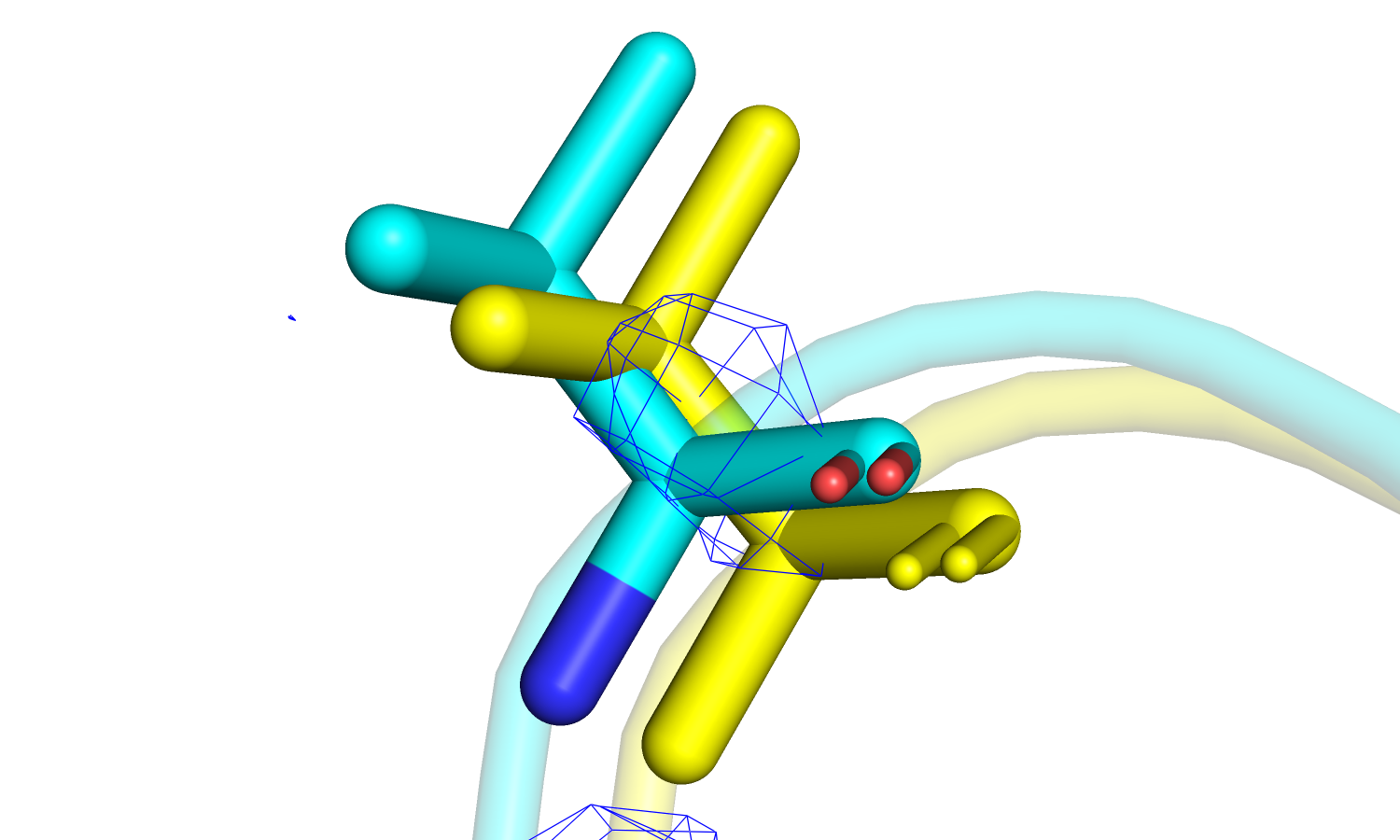
| Рис 18. Электронная плотность остатка Lys'327, желтым цветом изображен оптимизированный остаток. | Рис 19.Электронная плотность остатков His'200 и Ile'204, желтым цветом изображены оптимизированные остатки. |