 |
 |
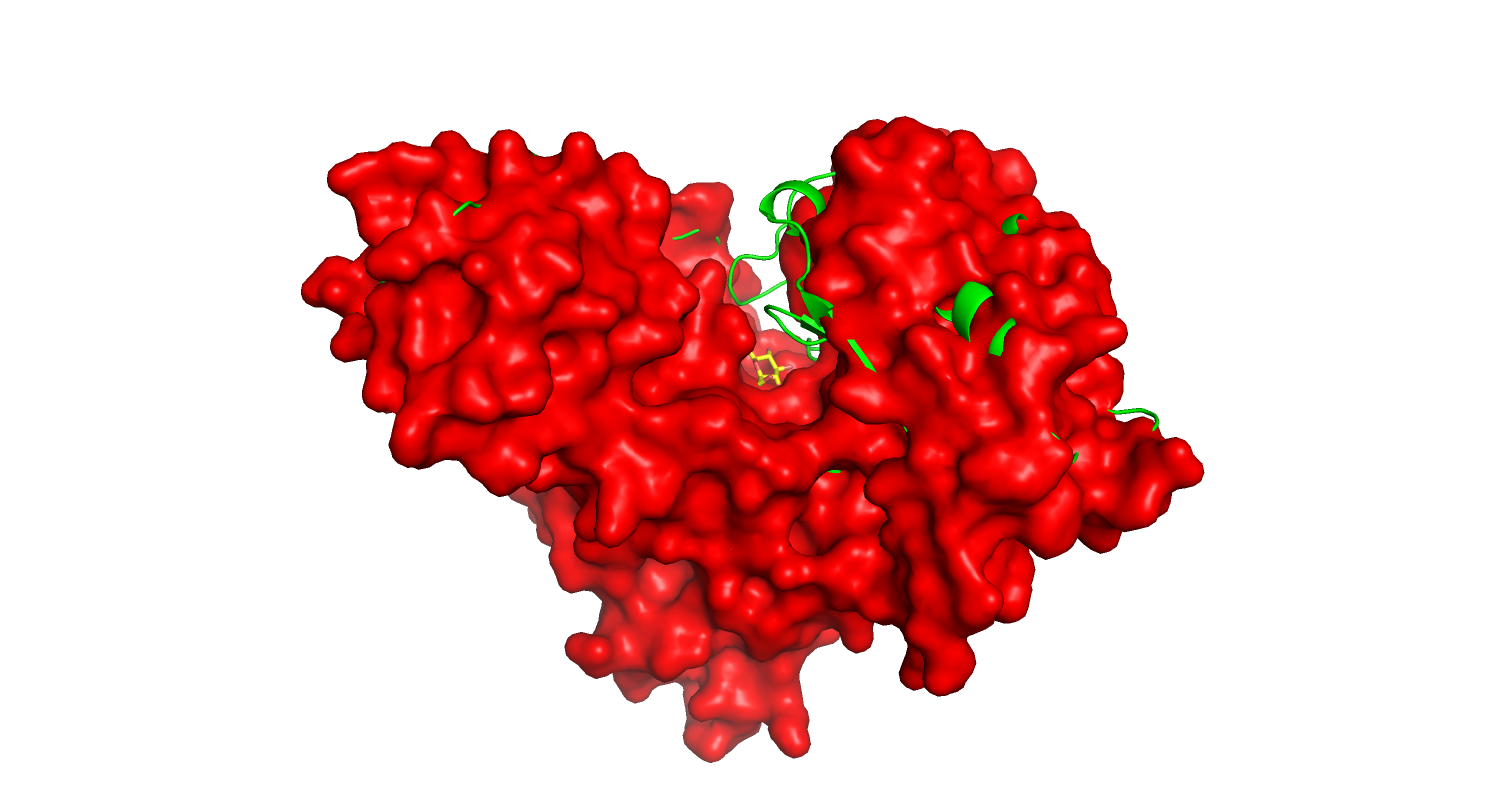
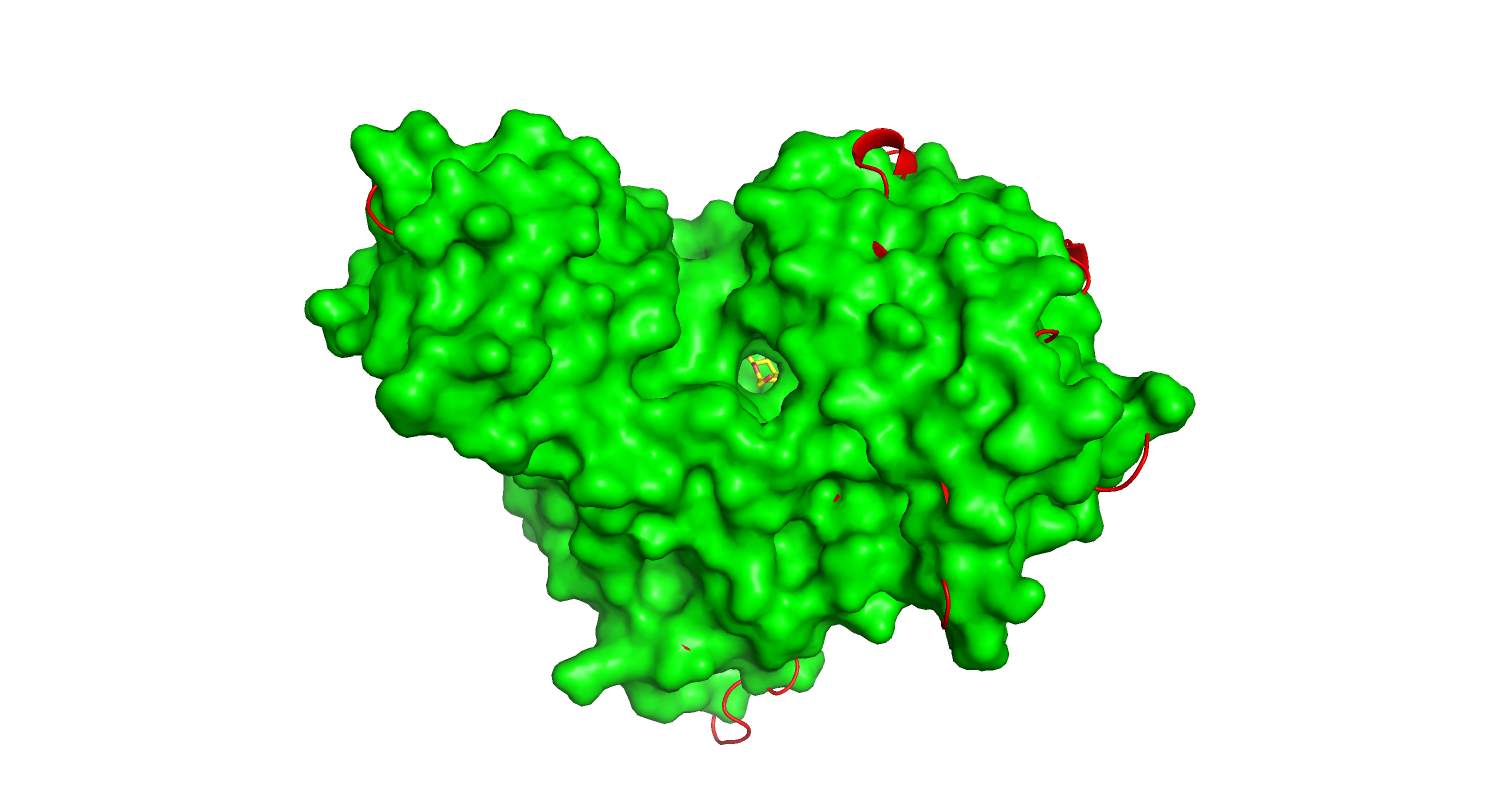
| Рис.1. Свободная форма, красная. | Рис.2. Связанная форма, зеленая. |
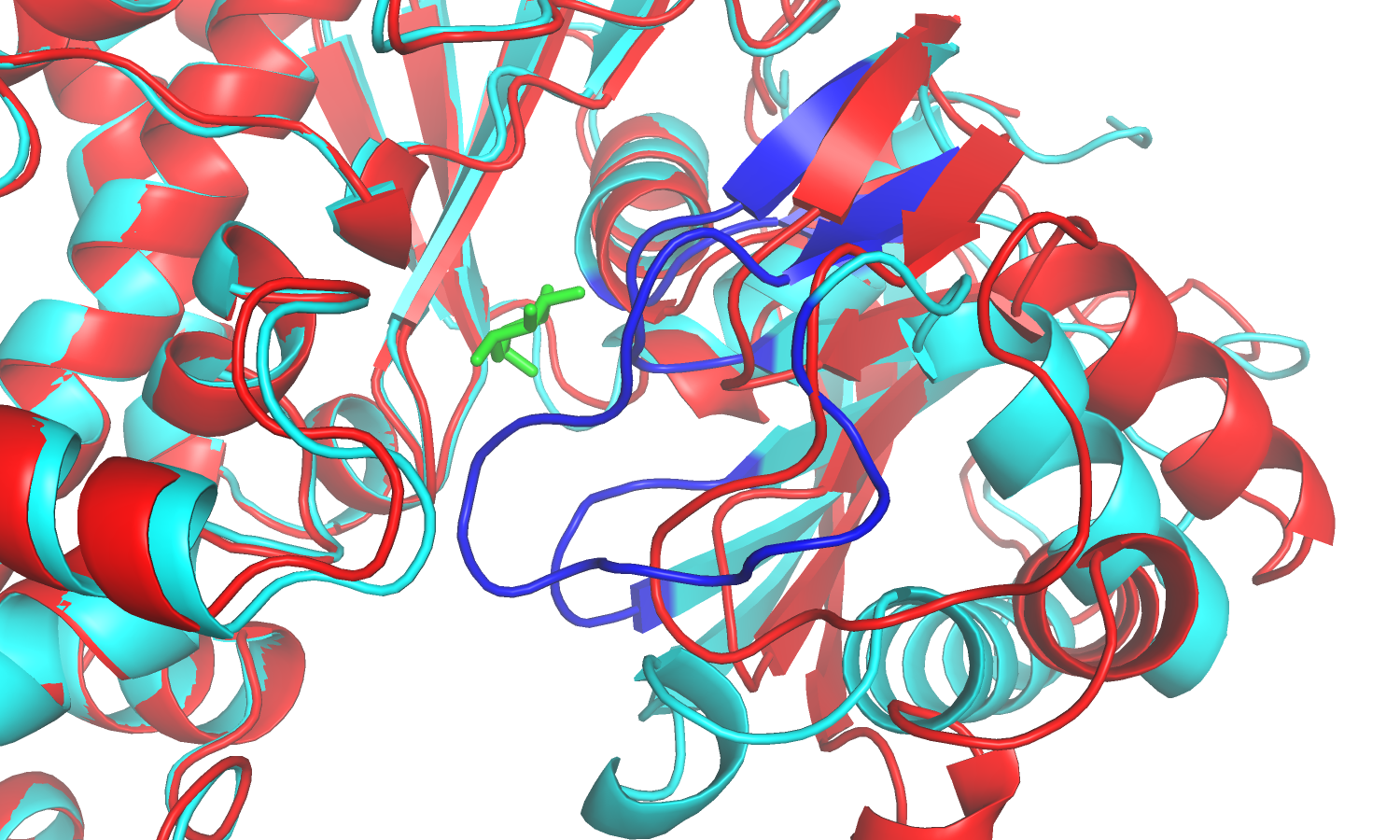 |
| Рис.3. Связанная и свободная форма белка; синие петли принадлежат связанной форме, окрашенной в бирюзовый цвет; красным цветом отмечена свободная форма. |
 |
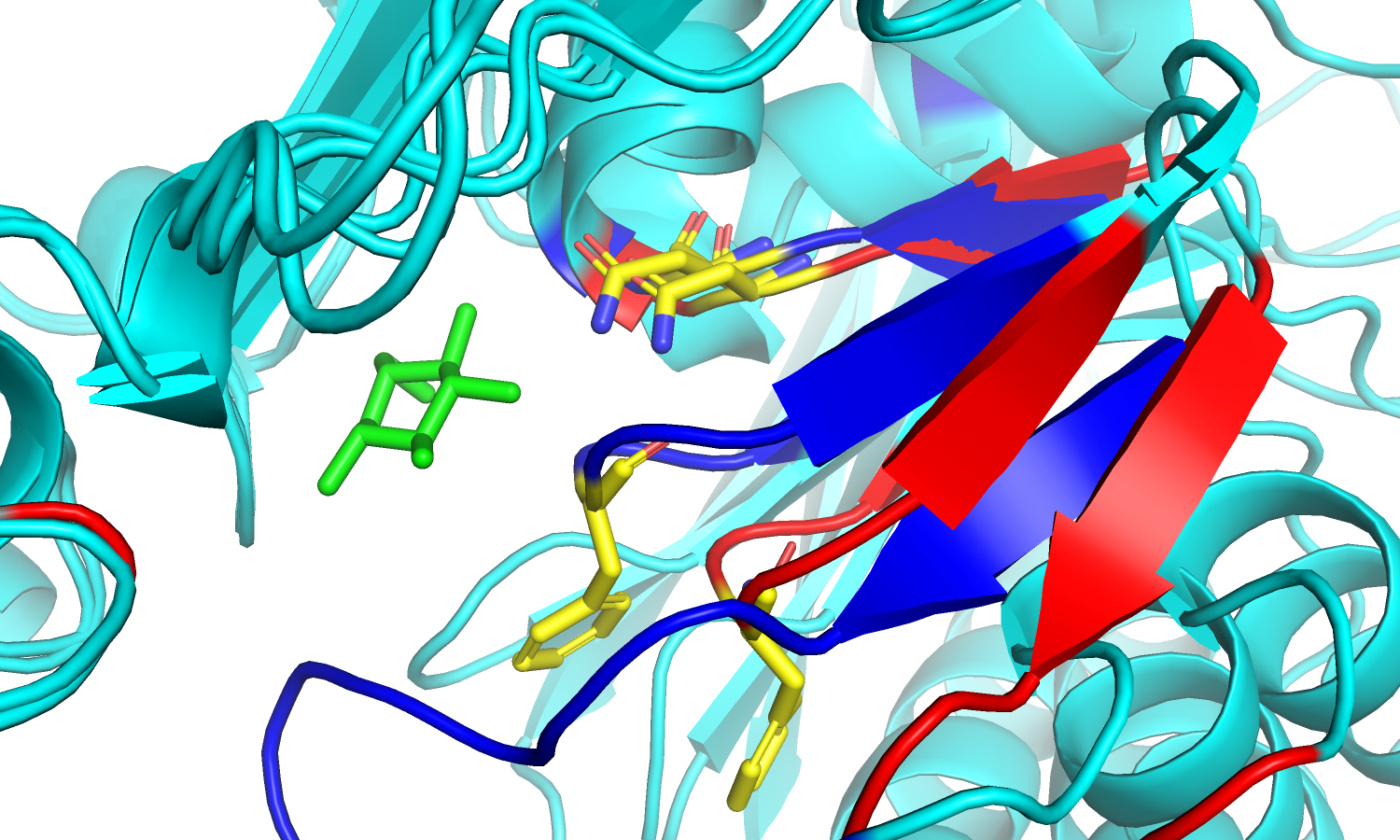 |
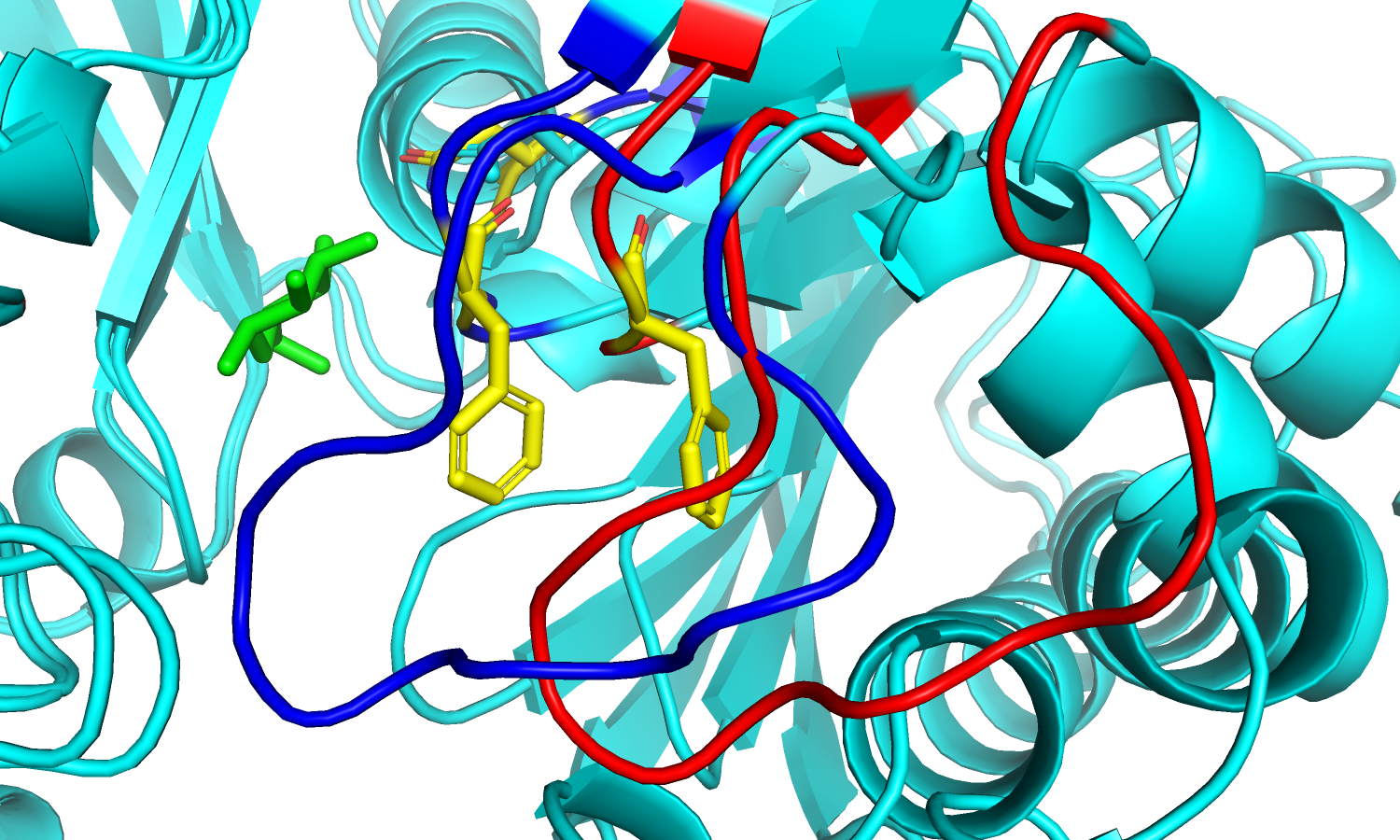
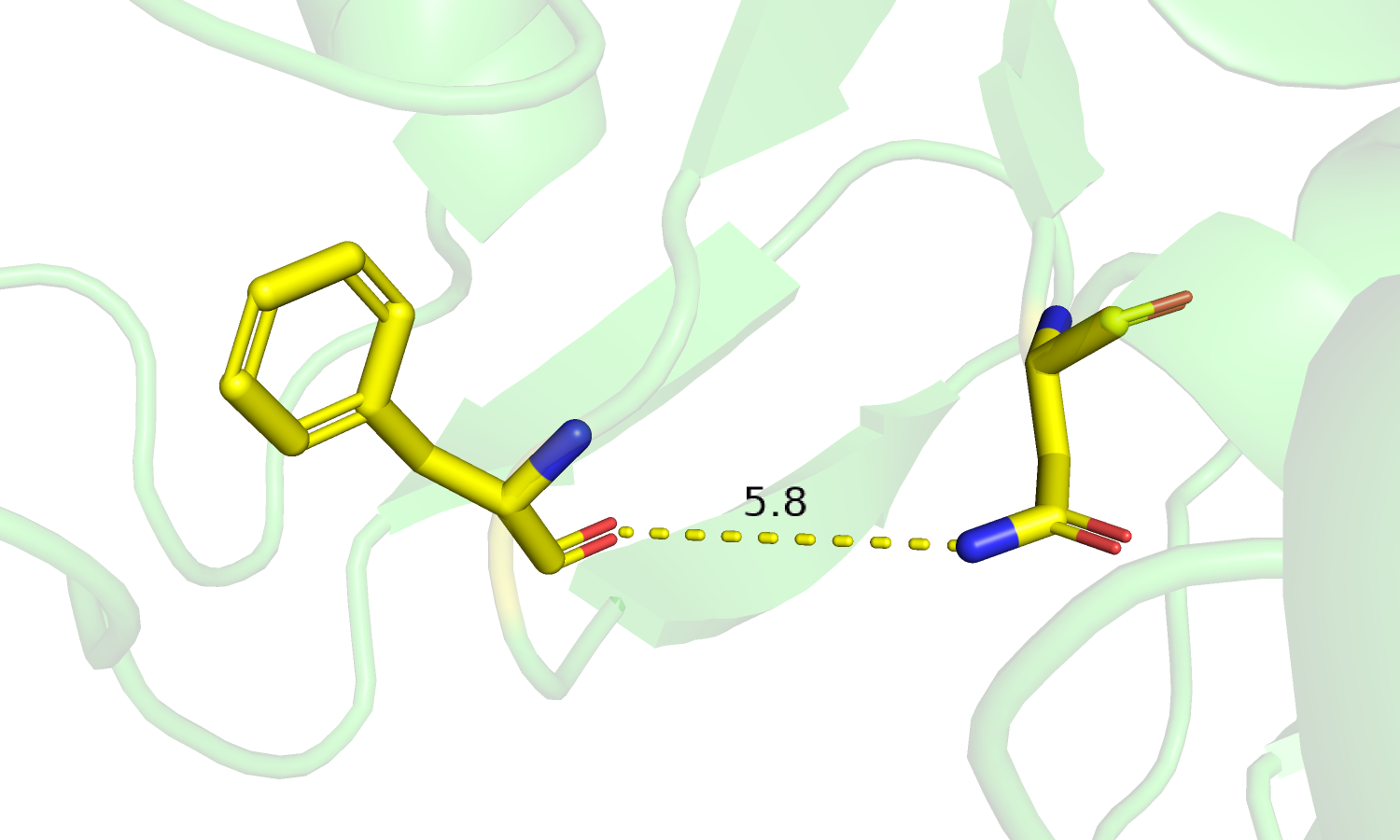
| Рис.4. Изменение положения петель и Phe'186 в разных формах белка. | Рис.5. Изменение положения петель и остатков Asn'237. |
 |
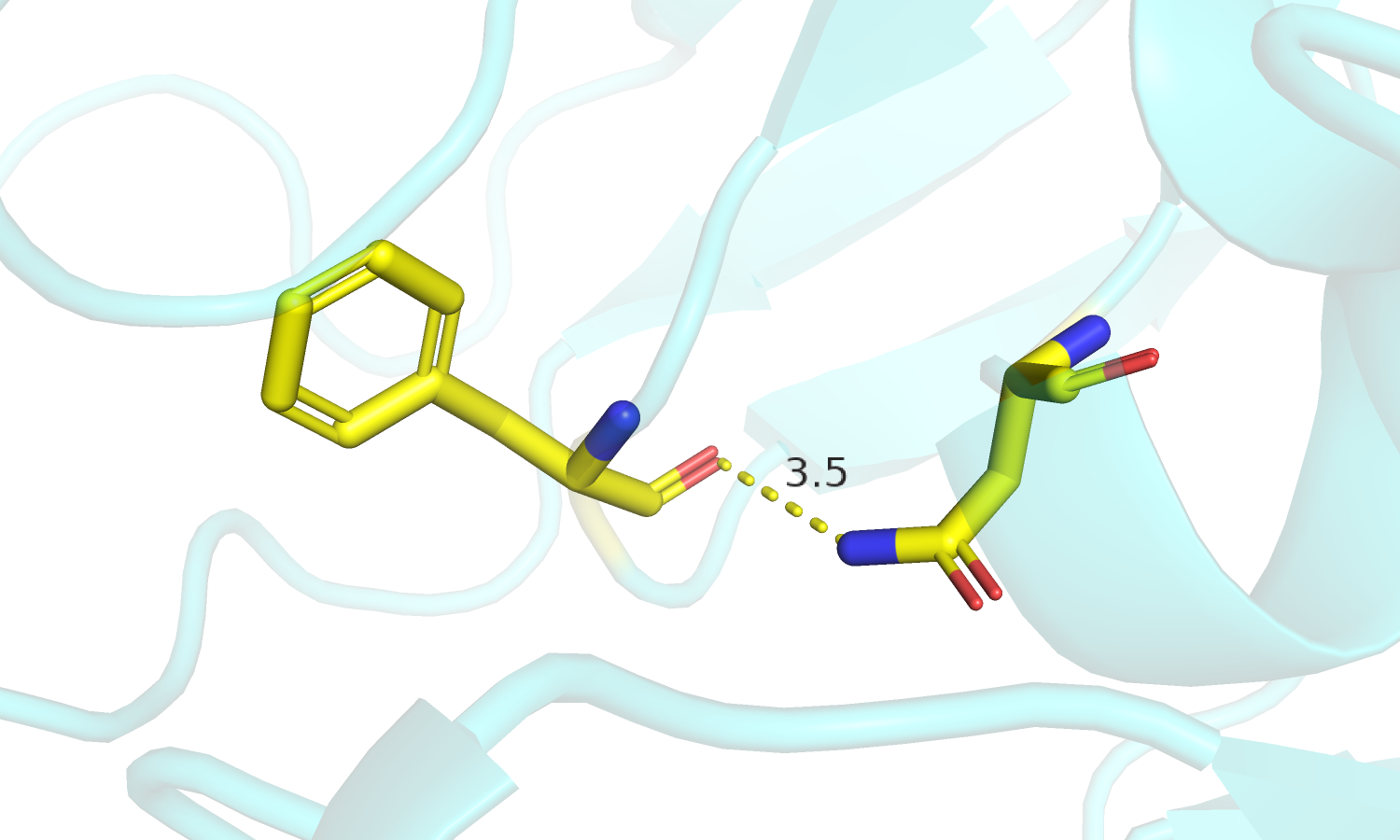 |
| Рис.6. Phe'186, Asn'237 Свободная форма. | Рис.7. Phe'186, Asn'237 Связанная форма. |
 |
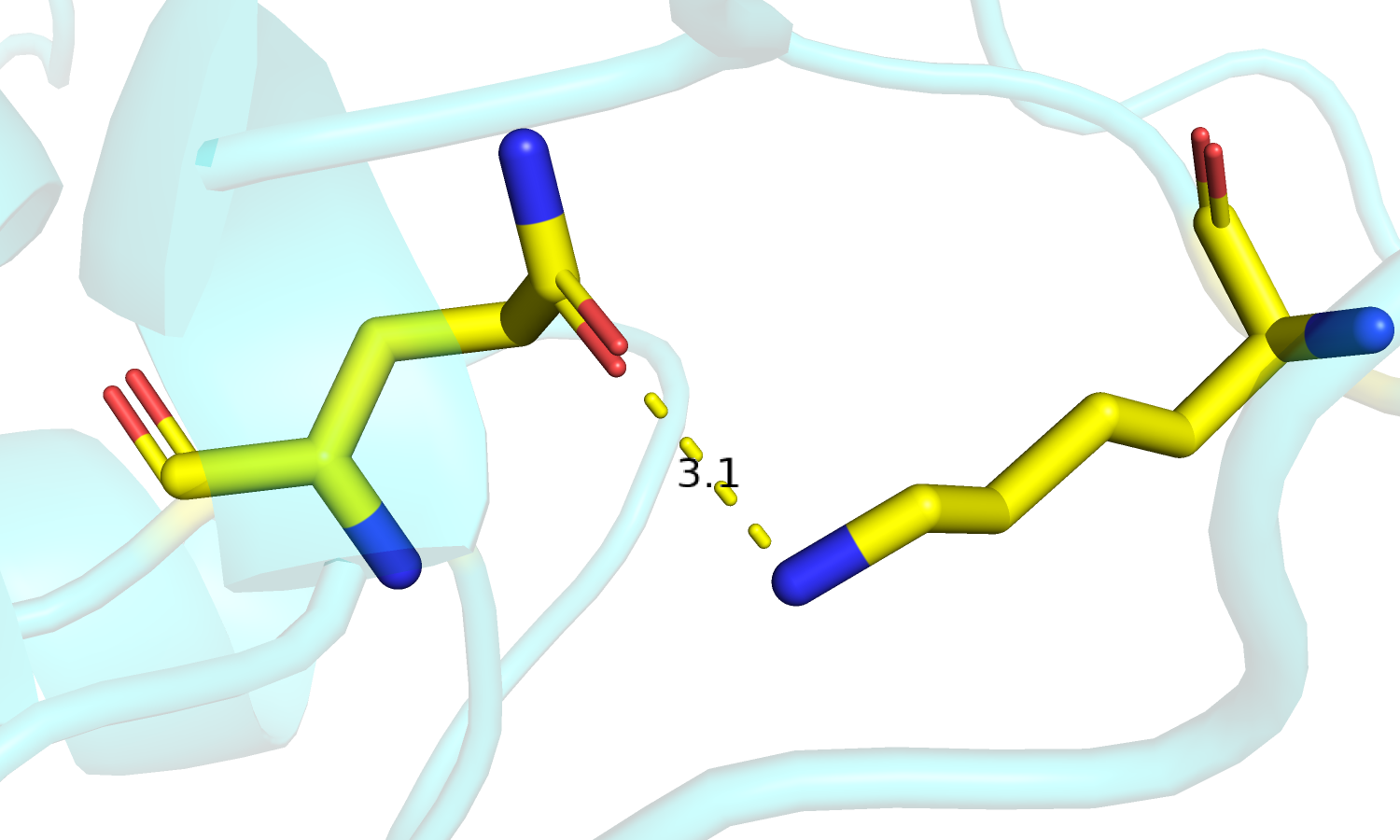 |
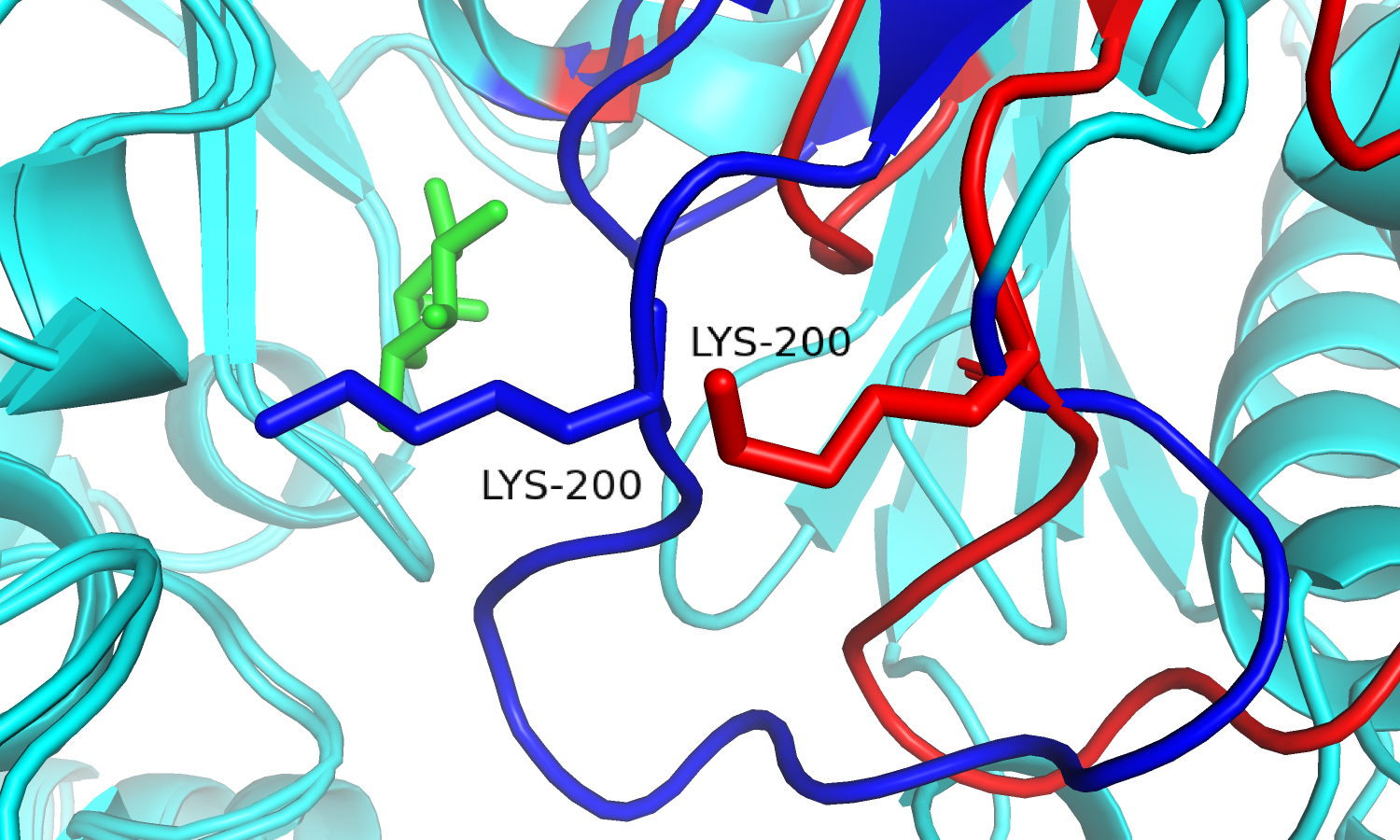
| Рис. 8. Движение петли с остатком лизина. | Рис. 9. Lys'200Gln'320. Связанная форма. |
 |
 |
||
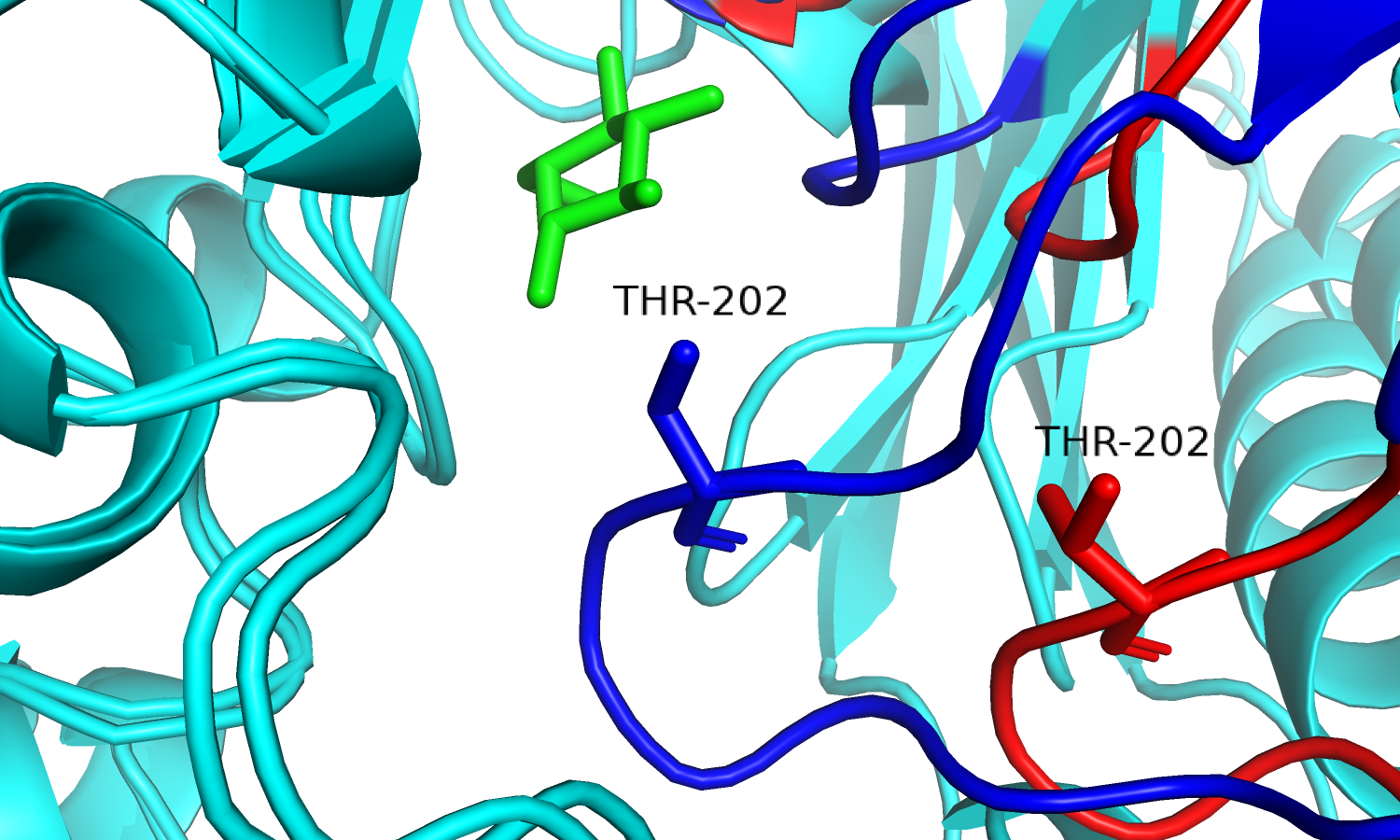
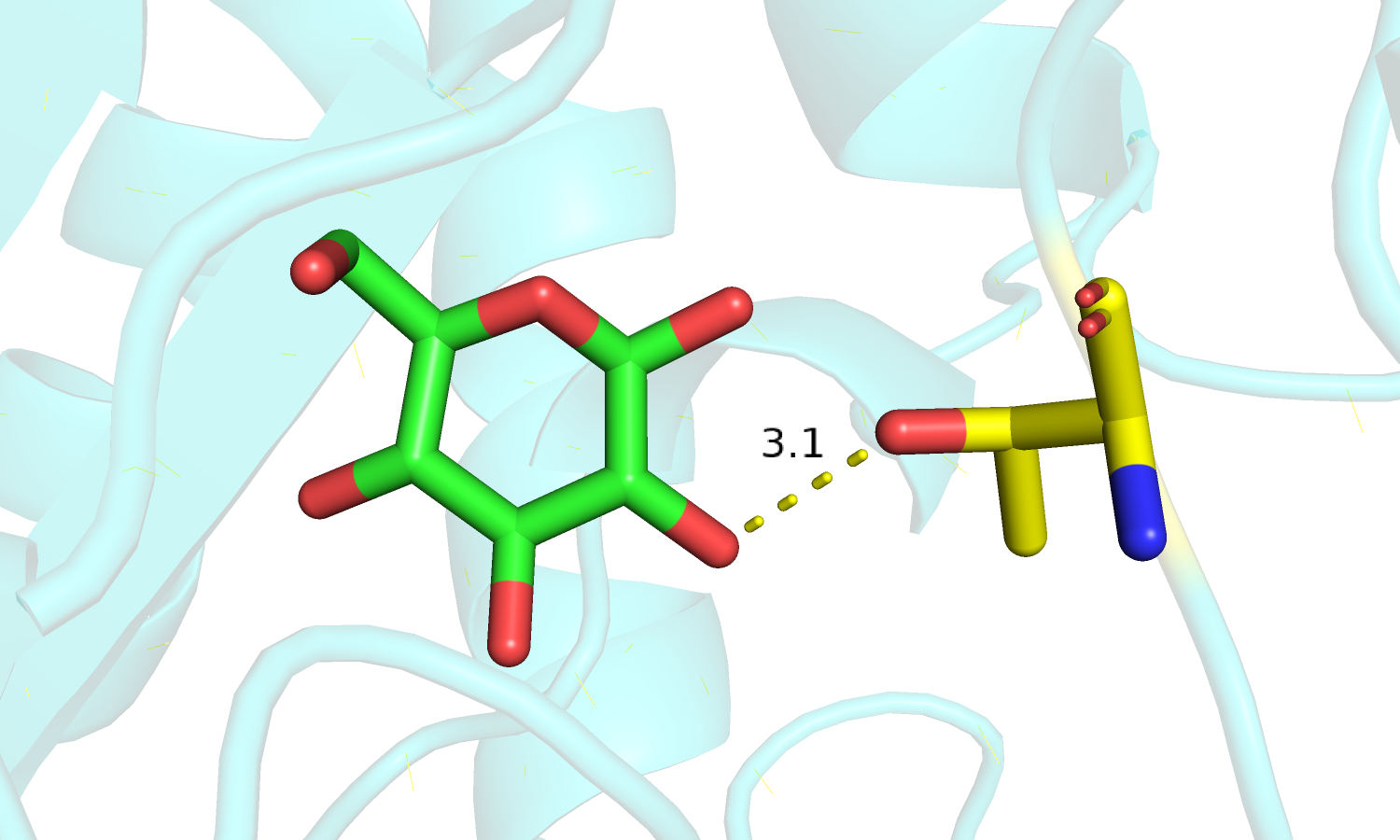
| Рис. 8. Движение петли с остатком треонина. | Рис. 9. Thr'202 и лиганд. Связанная форма. |
| free ID | Volume | bound ID | Volume |
| 496 | 366 | 174 | 408 |
| 280 | 145 | 335 | 341 | 179 | 119 | 149 | 196 |
| 484 | 93 | 466 | 95 |
| 119 | 62 | 589 | 72 |
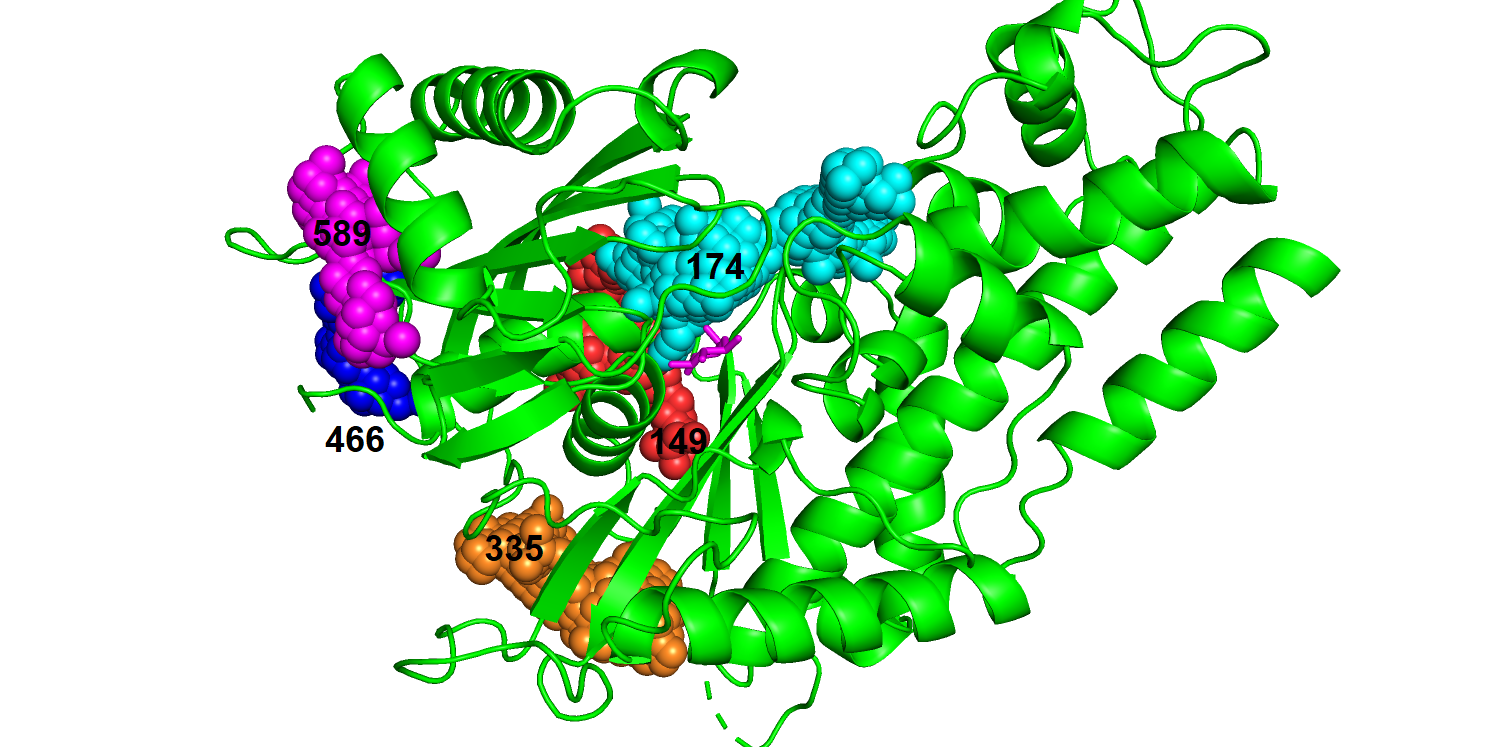 |
| Рис. 12. Связанный белок с топ-5 карманами с использованием surface. |
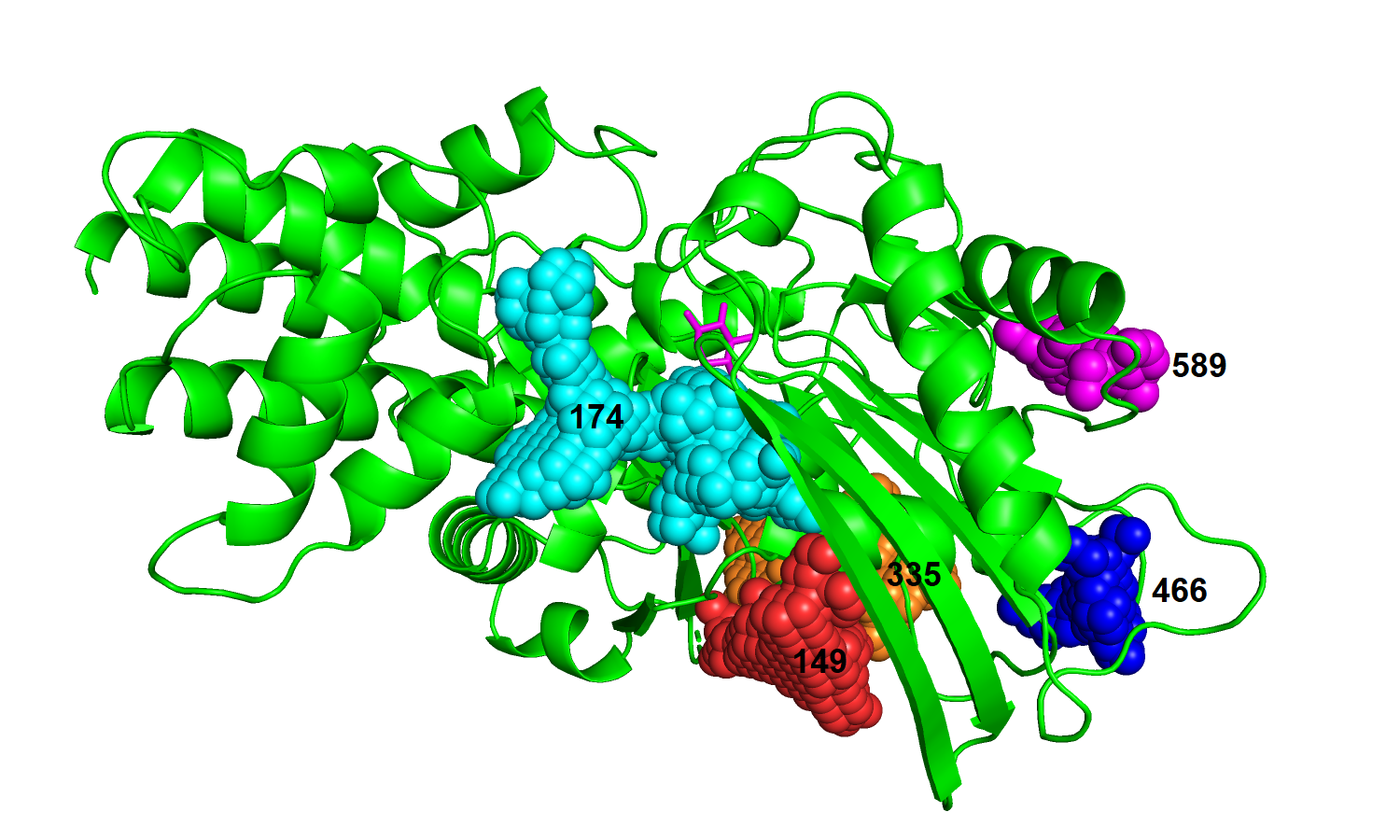 |
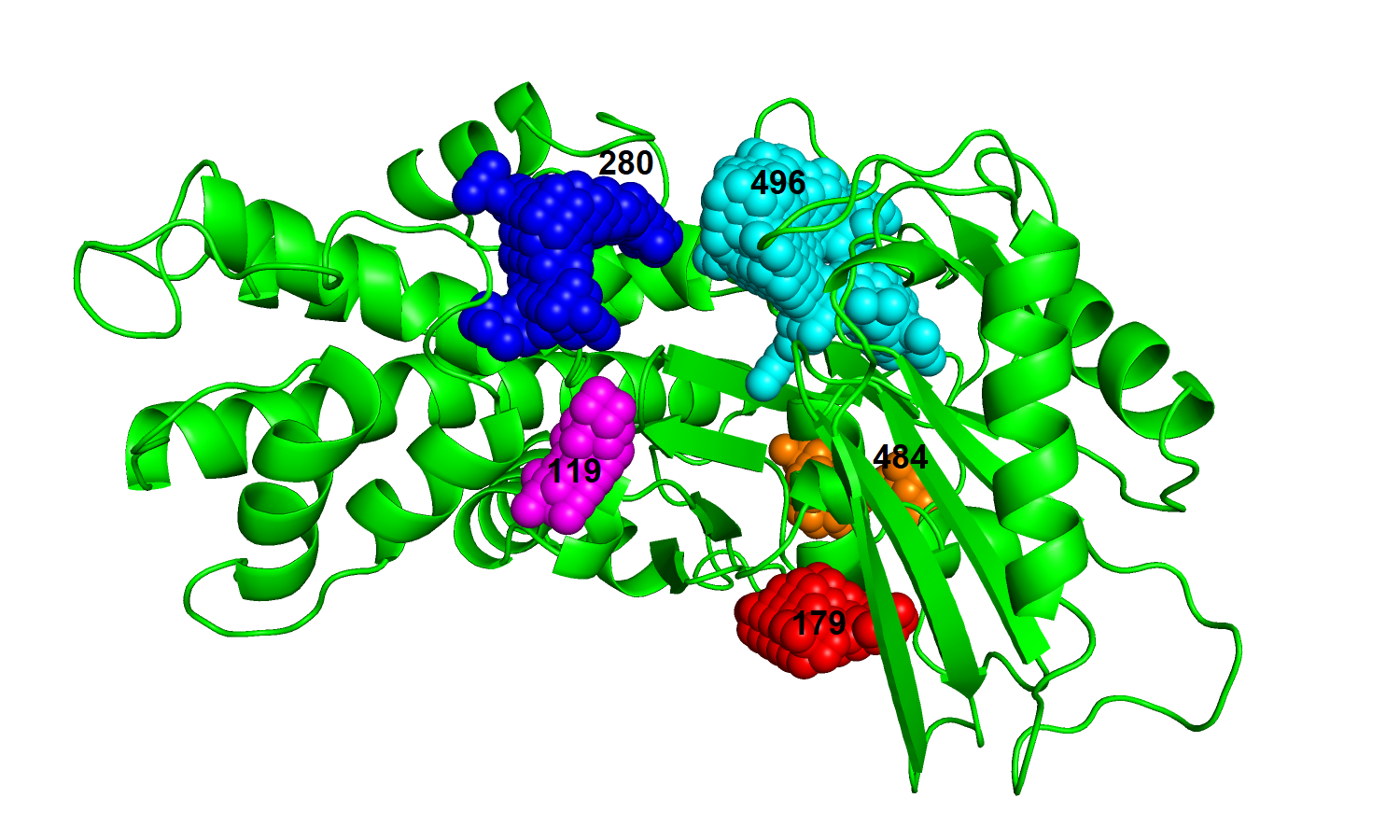 |
| Рис. 13. Связанный белок с топ-5 карманами. | Рис. 14. Свободный белок с топ-пять карманами. |
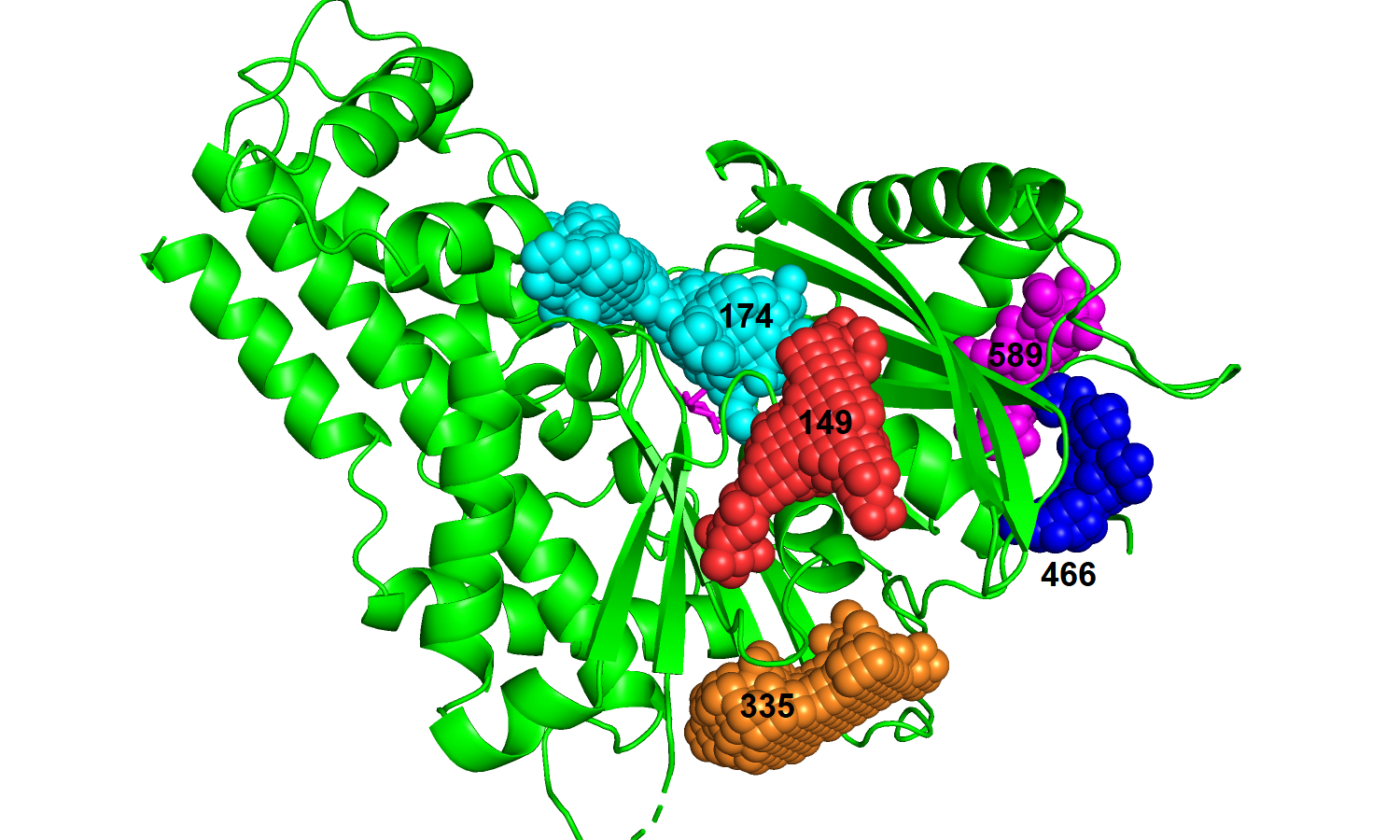 |
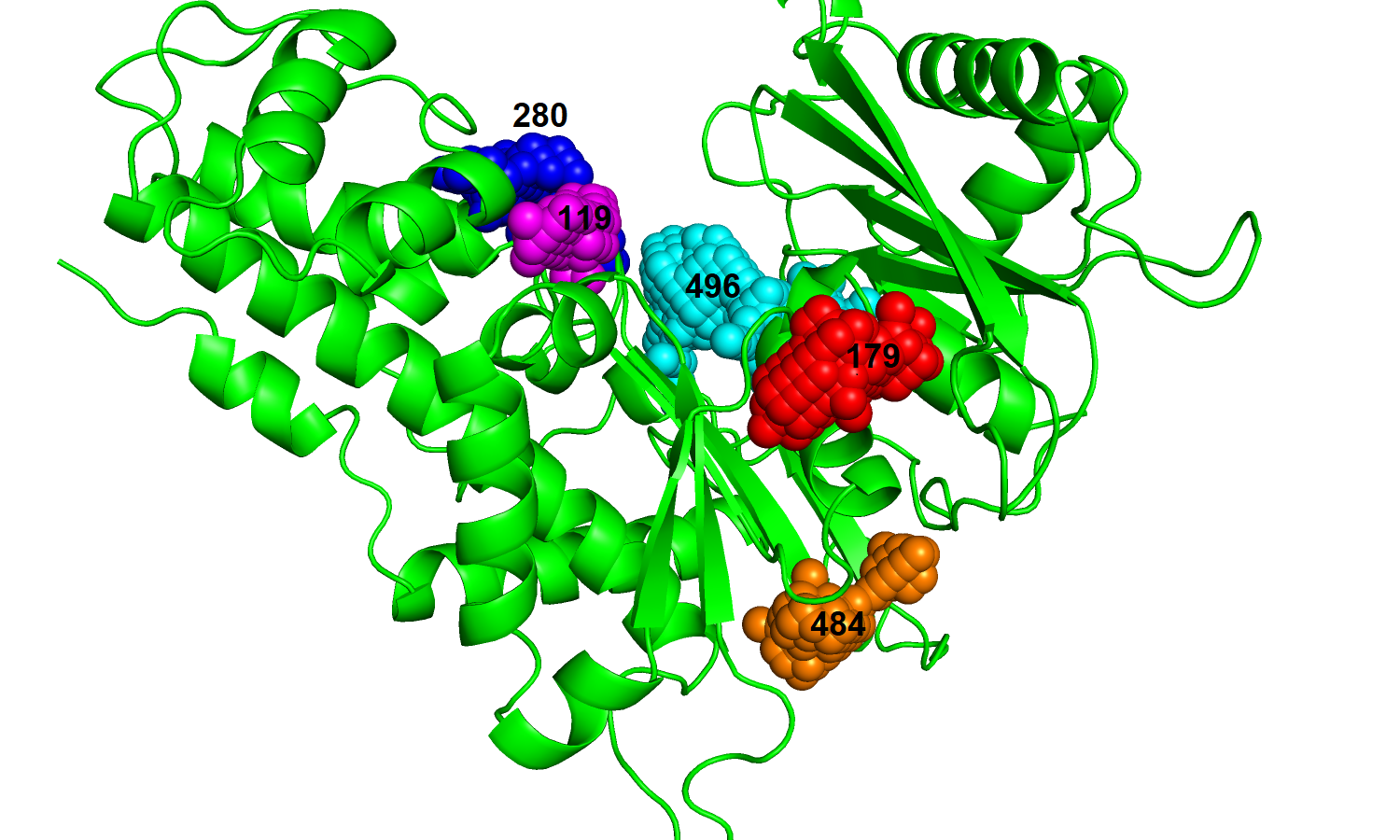 |
| Рис. 15. Связанный белок с топ-5 карманами. | Рис. 16. Свободный белок с топ-5 карманами. |
 |
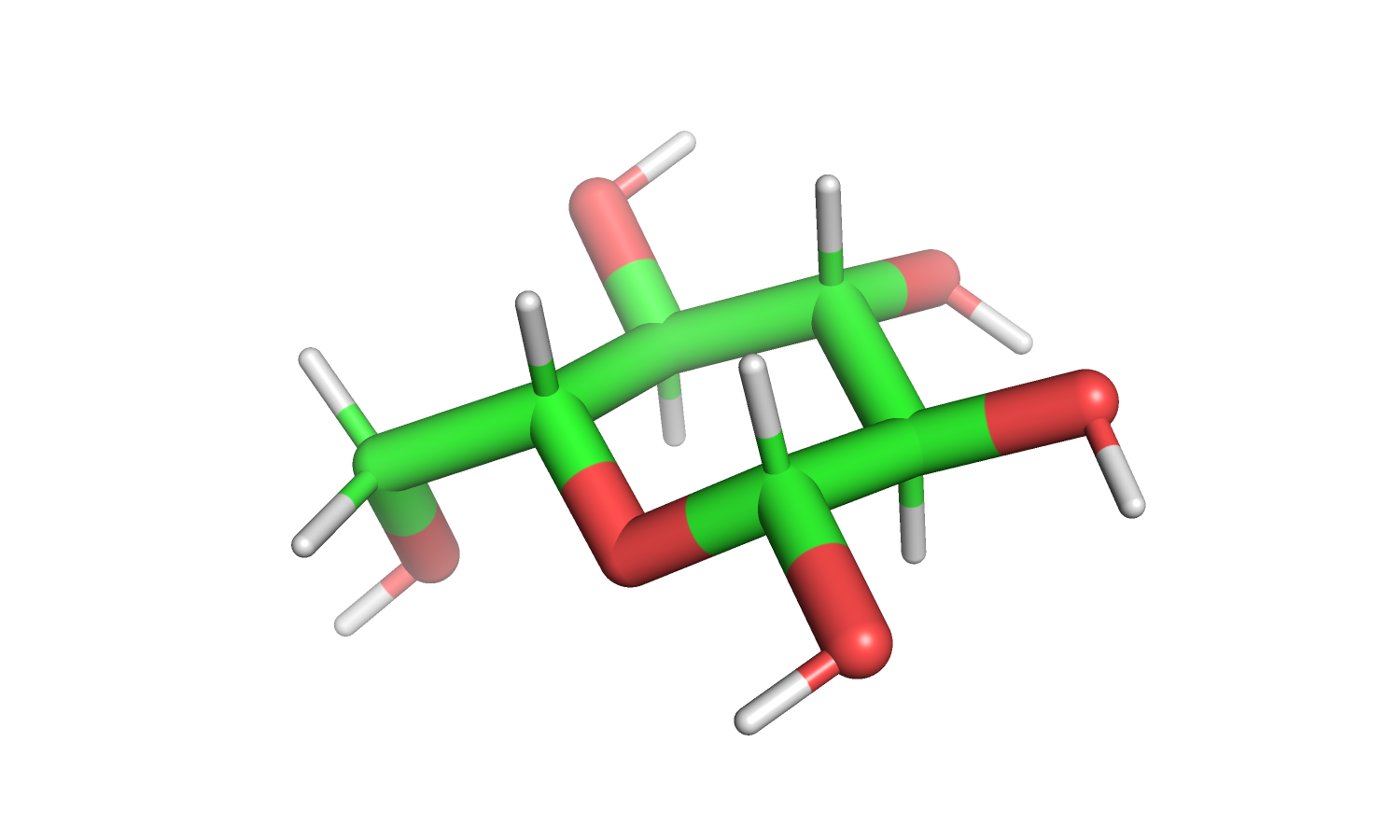 |
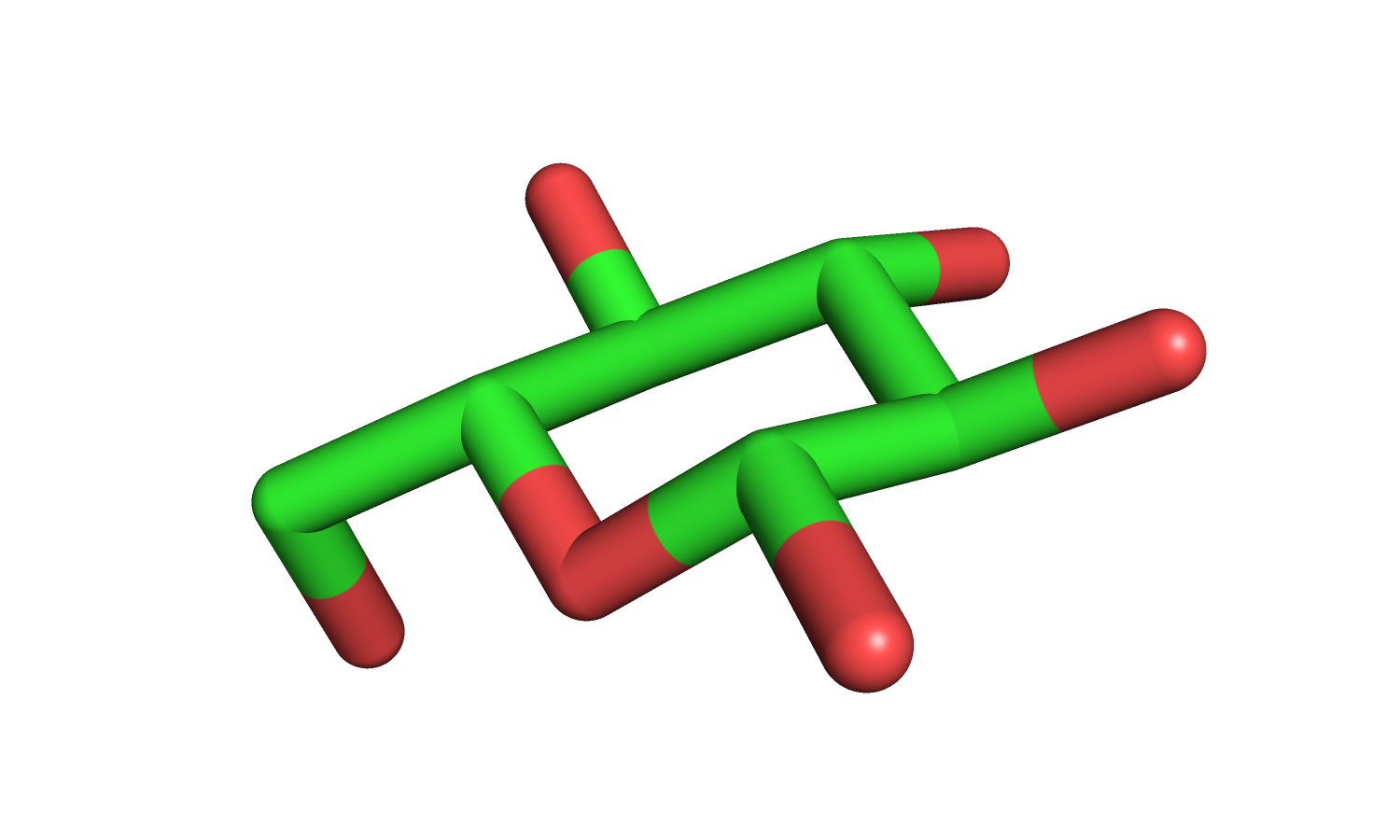
| Рис. 17. Лиганд. | Рис. 18. Протонированный лиганд. |
 |
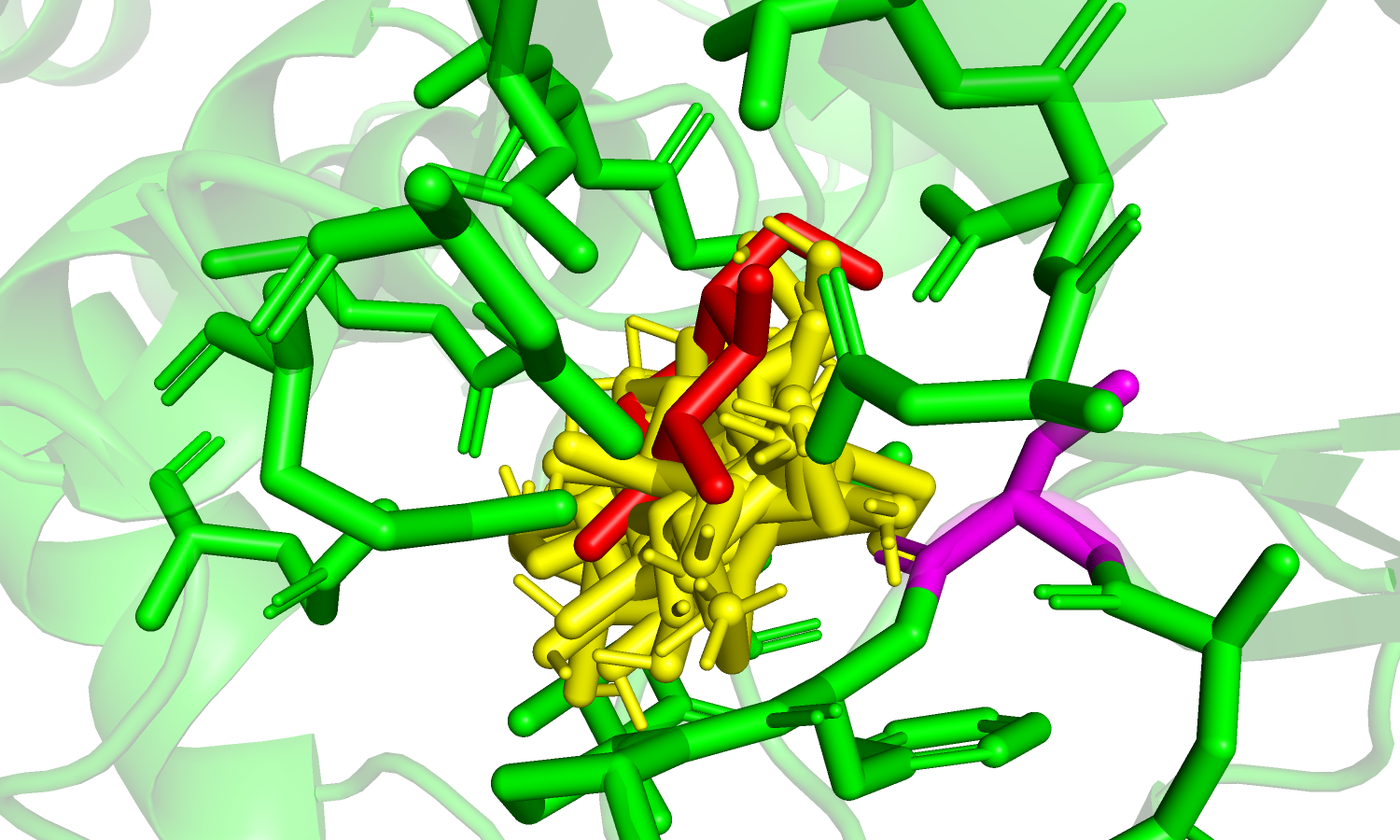 |
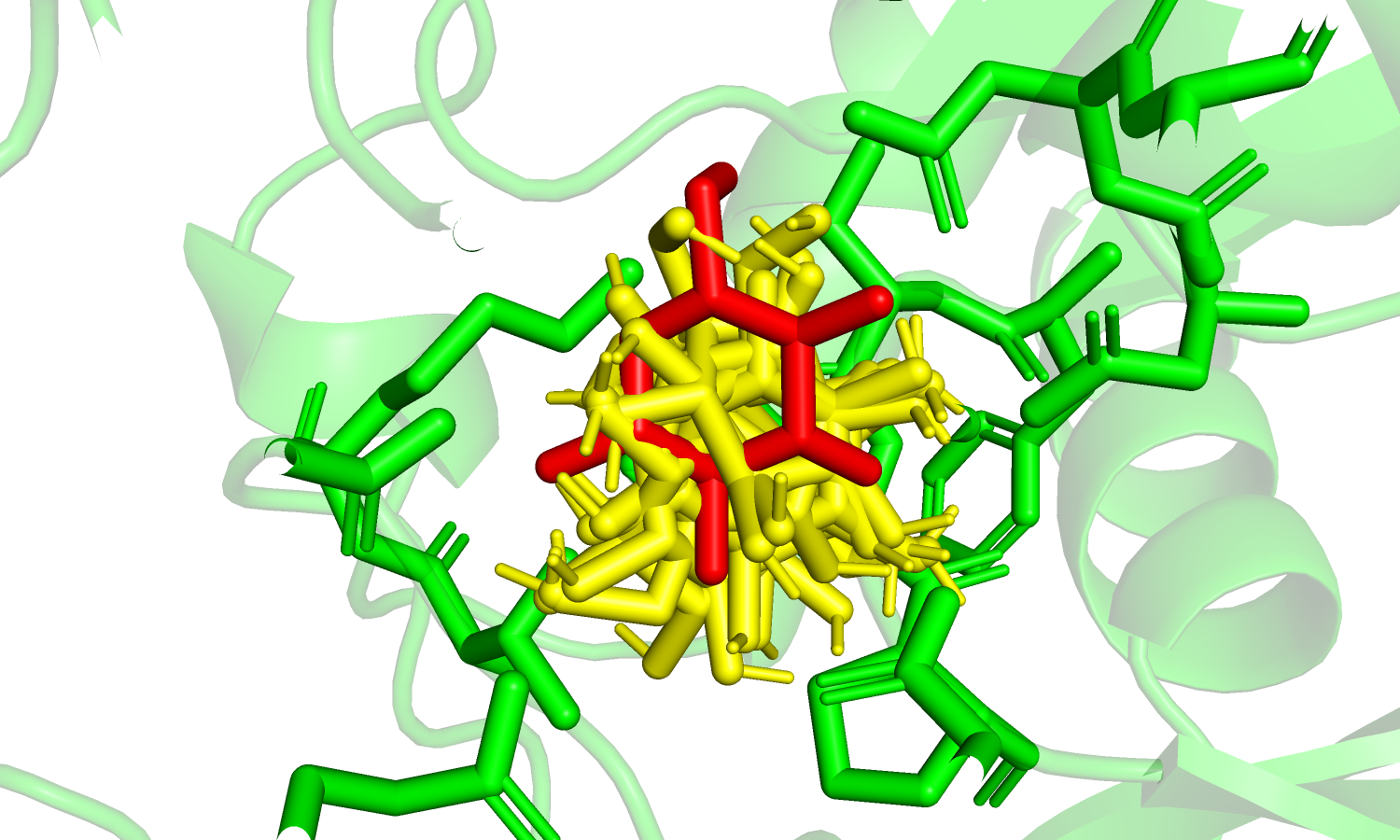
| Рис. 19. Красным цветом отмечен лиганд из файла bound.pdb; желтым - предсказанные позиции (9). | Рис. 20. Цветом margenda отмечен остаток Ser'185; красным - оригинальный лиганд; желтым - предсказания. |
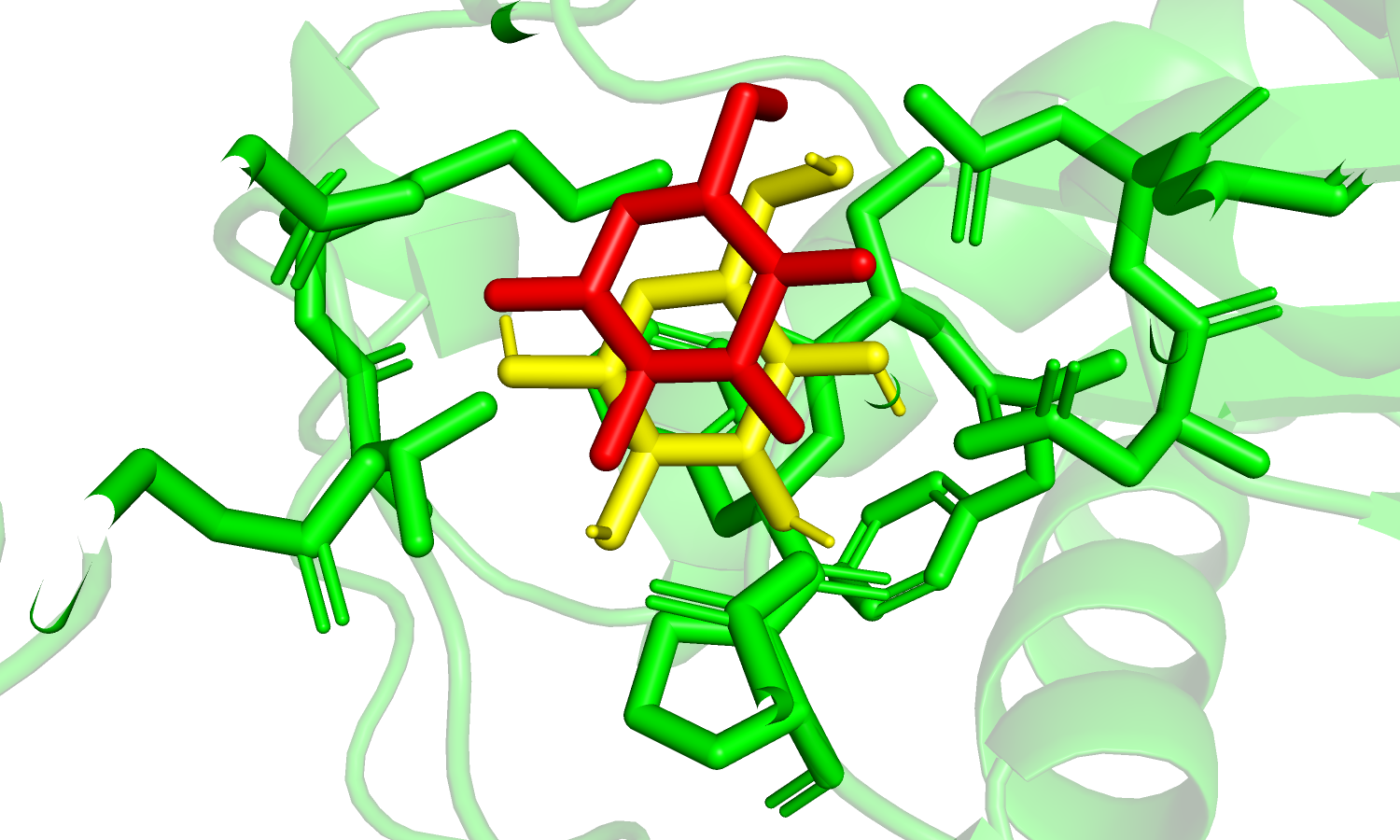 |
| Рис. 21. Наилучшая предсказанная позиция лиганда. |
 |
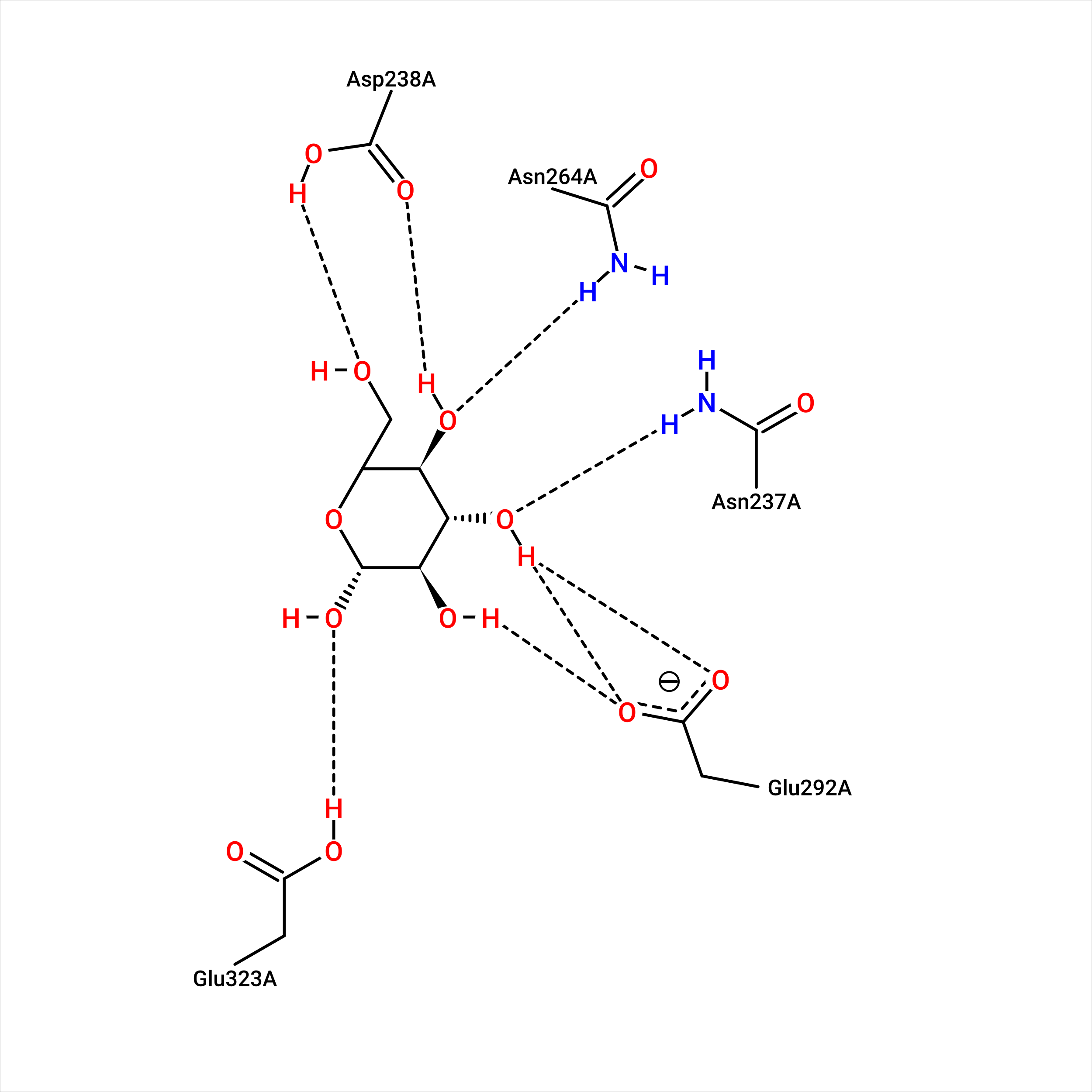 |
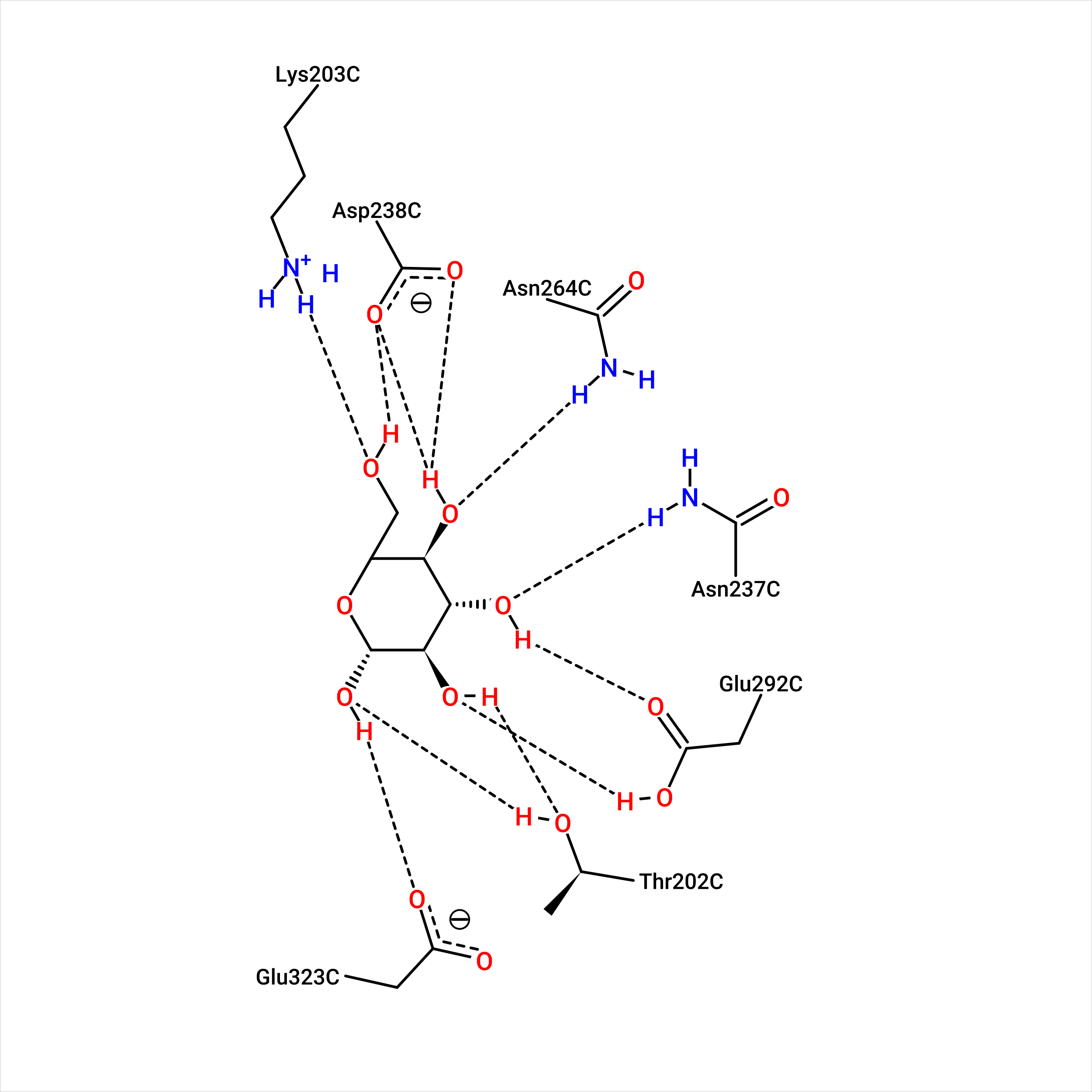
| Рис. 22. Связанная форма структуры во взаимодействии с первоначальным лигандом. | Рис. 23. Свободная форма структуры при взаимодействии с лучшей позой. |