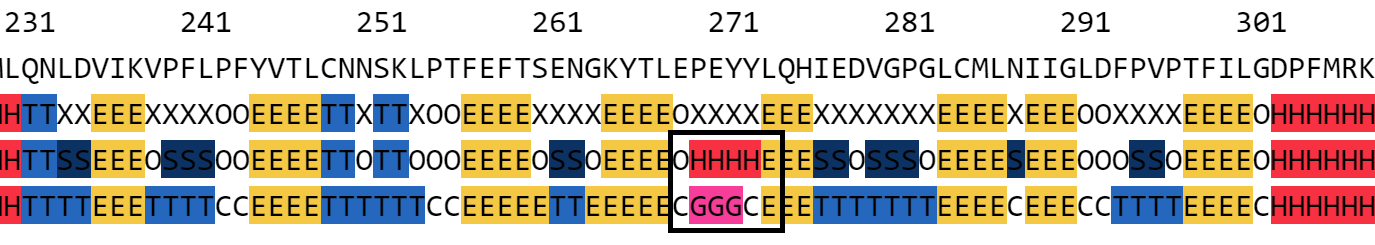
 |
| Рис. 1. Фрагмент выравнивания с остатками 270-273. |
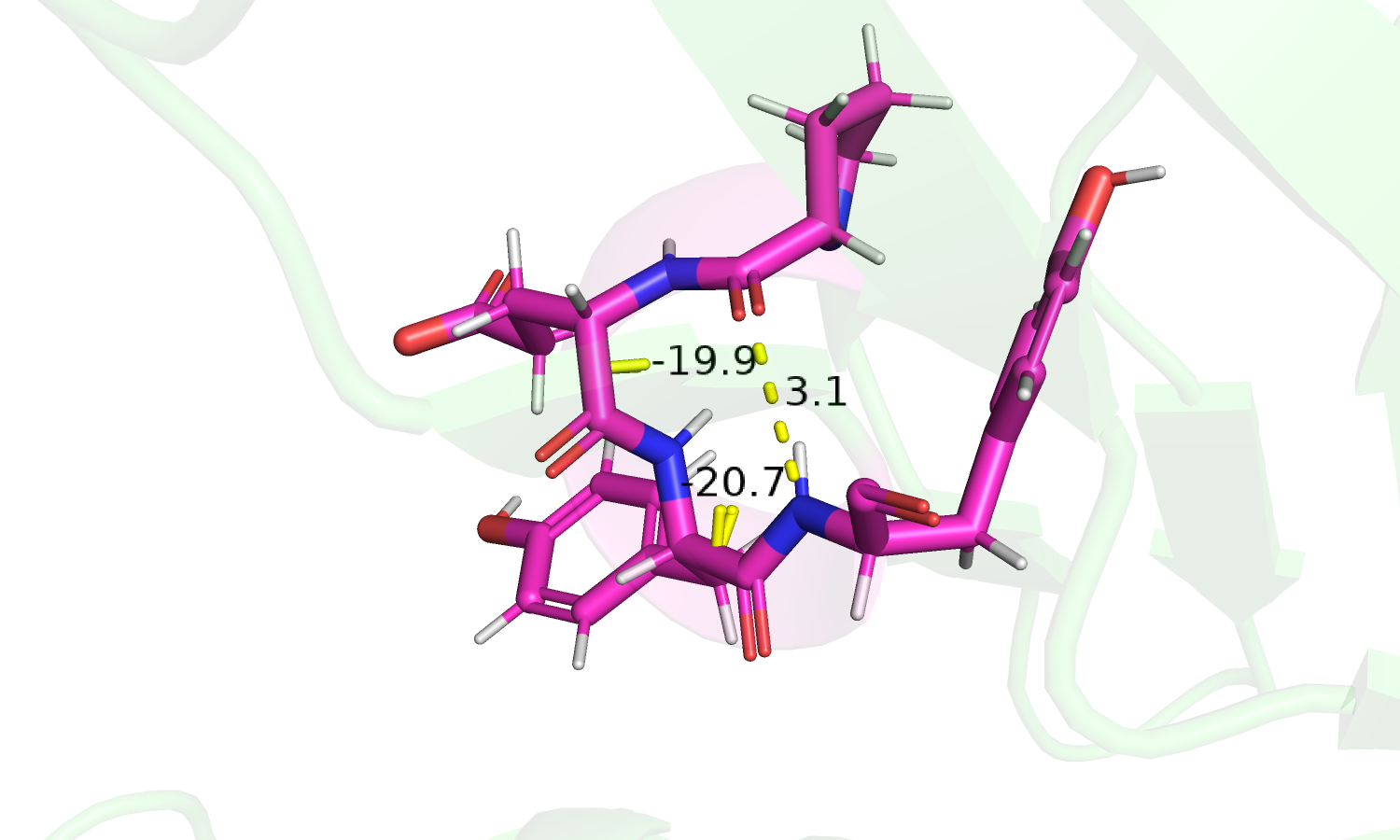 |
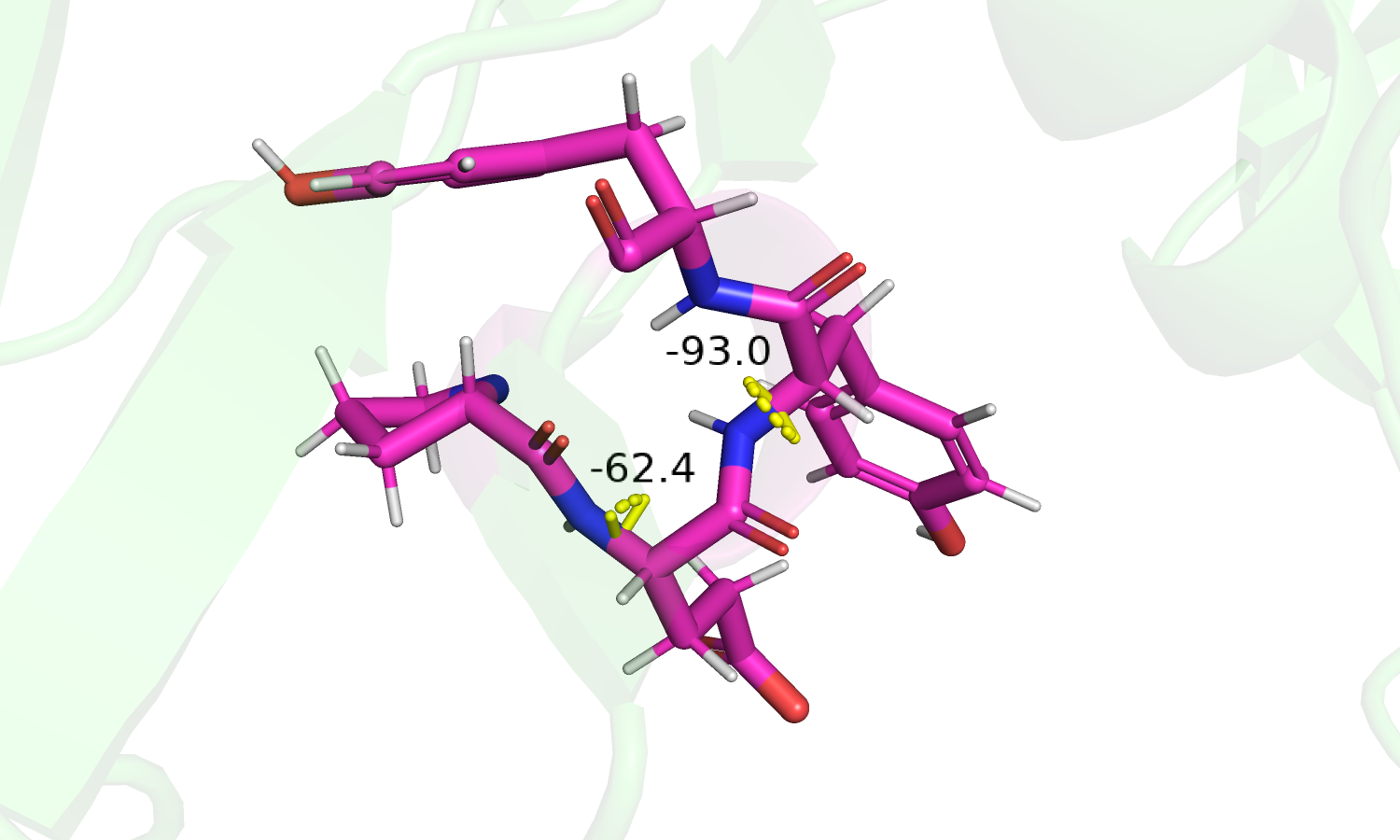 |
| Рис. 2.Водородная связь спирали и углы φ. | Рис. 3. Углы Ψ спирали. |
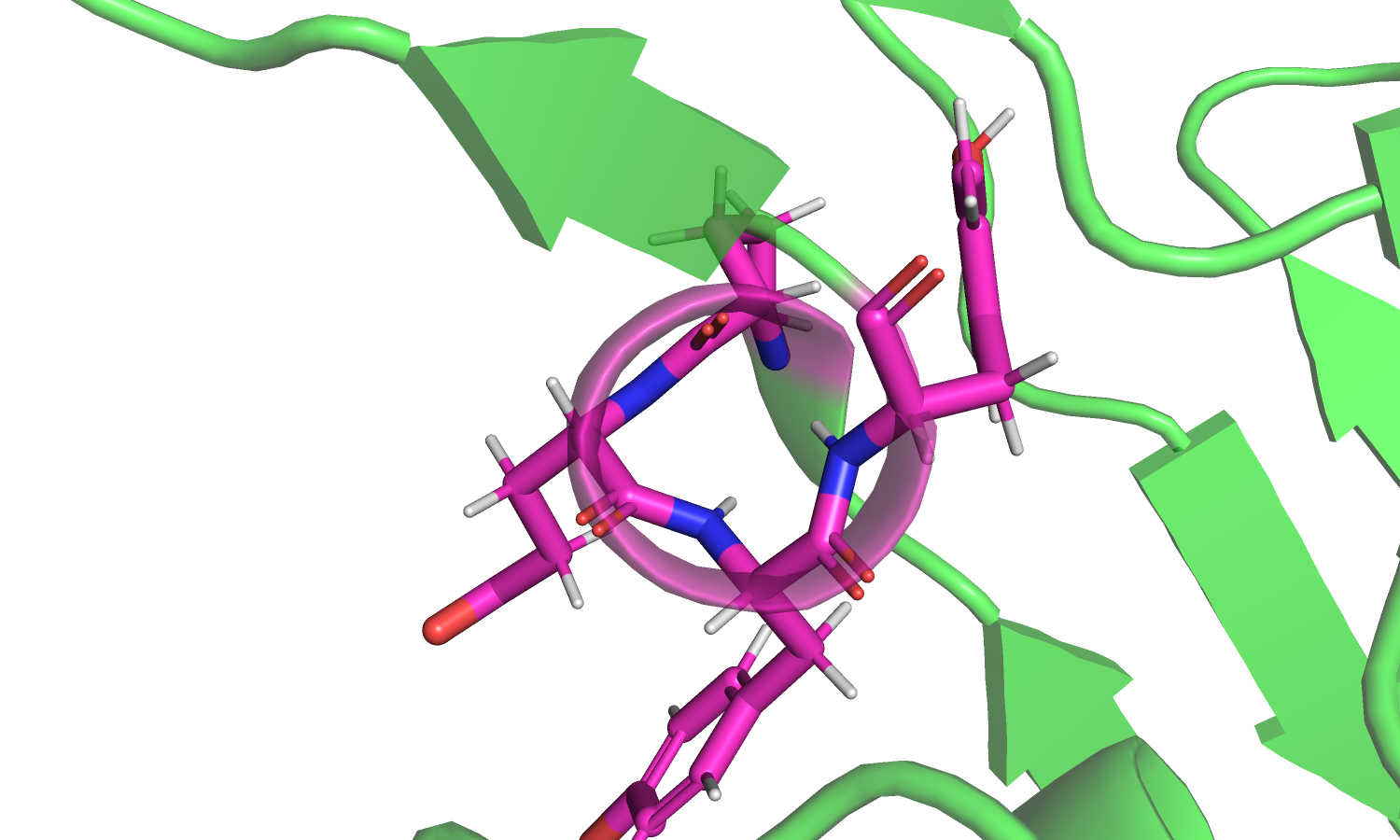 |
| Рис. 4. Изображение поворота спирали. |
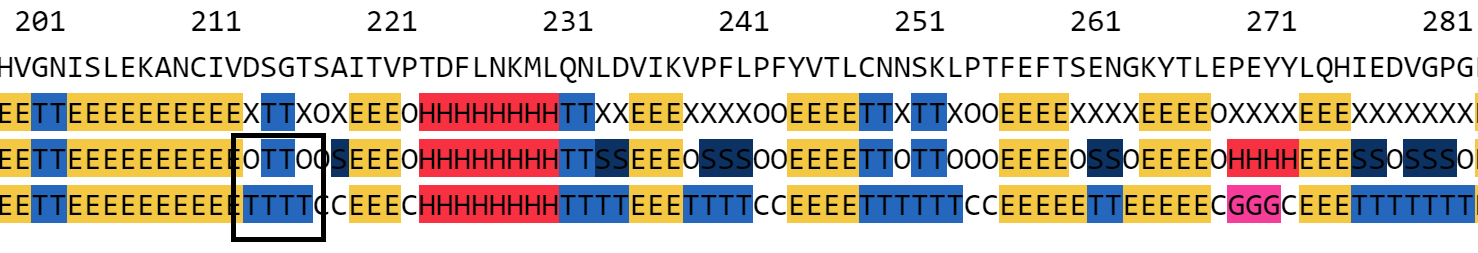 |
| Рис. 5. Фрагмент выравнивания с остатками 214-217. |
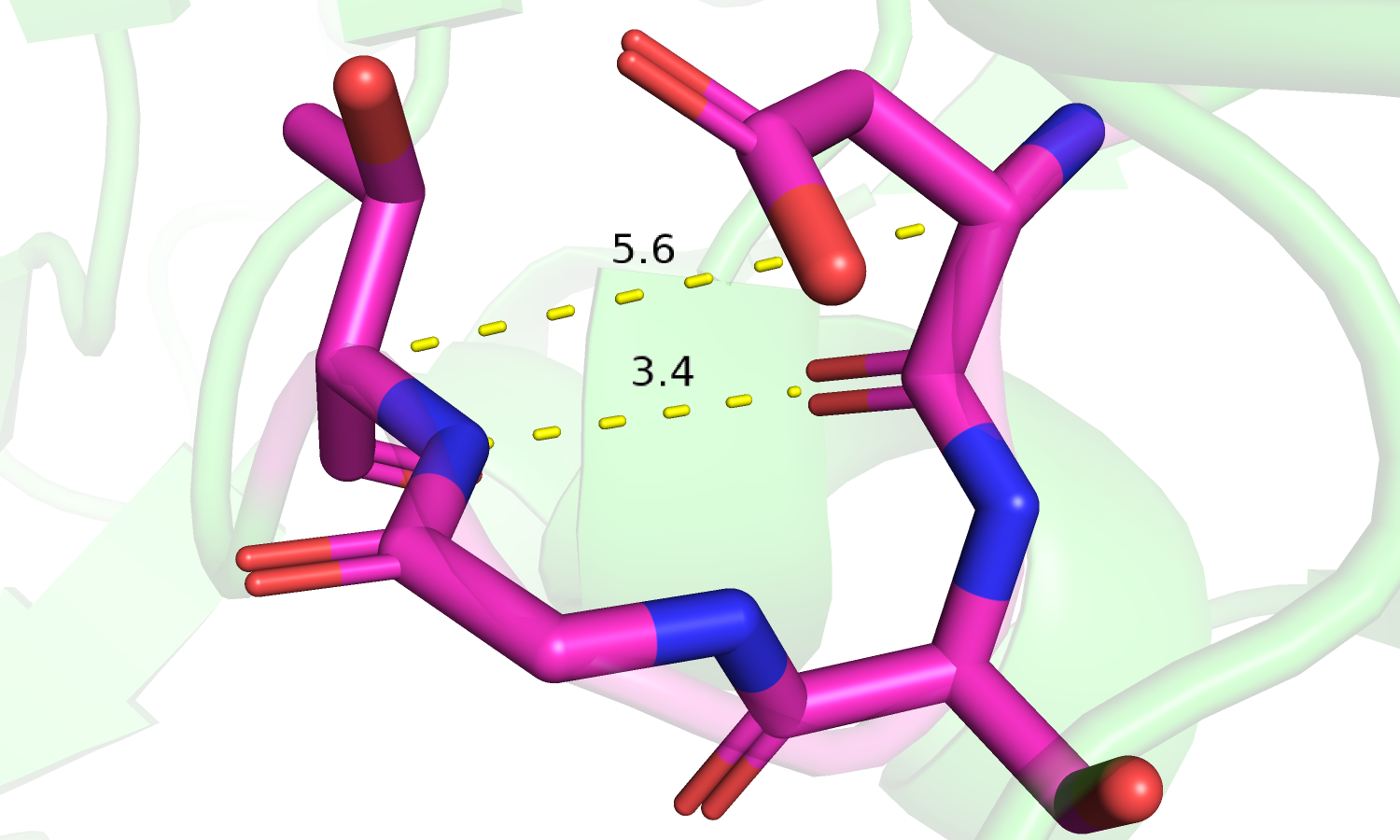 |
| Рис. 6. Фрагмент с остатками 214-217. |
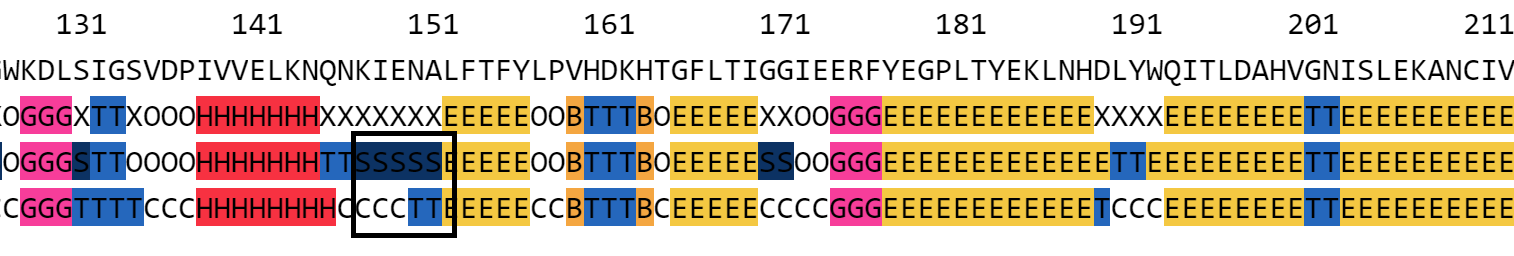 |
| Рис. 7. Фрагмент выравнивания с остатками 148-152. |
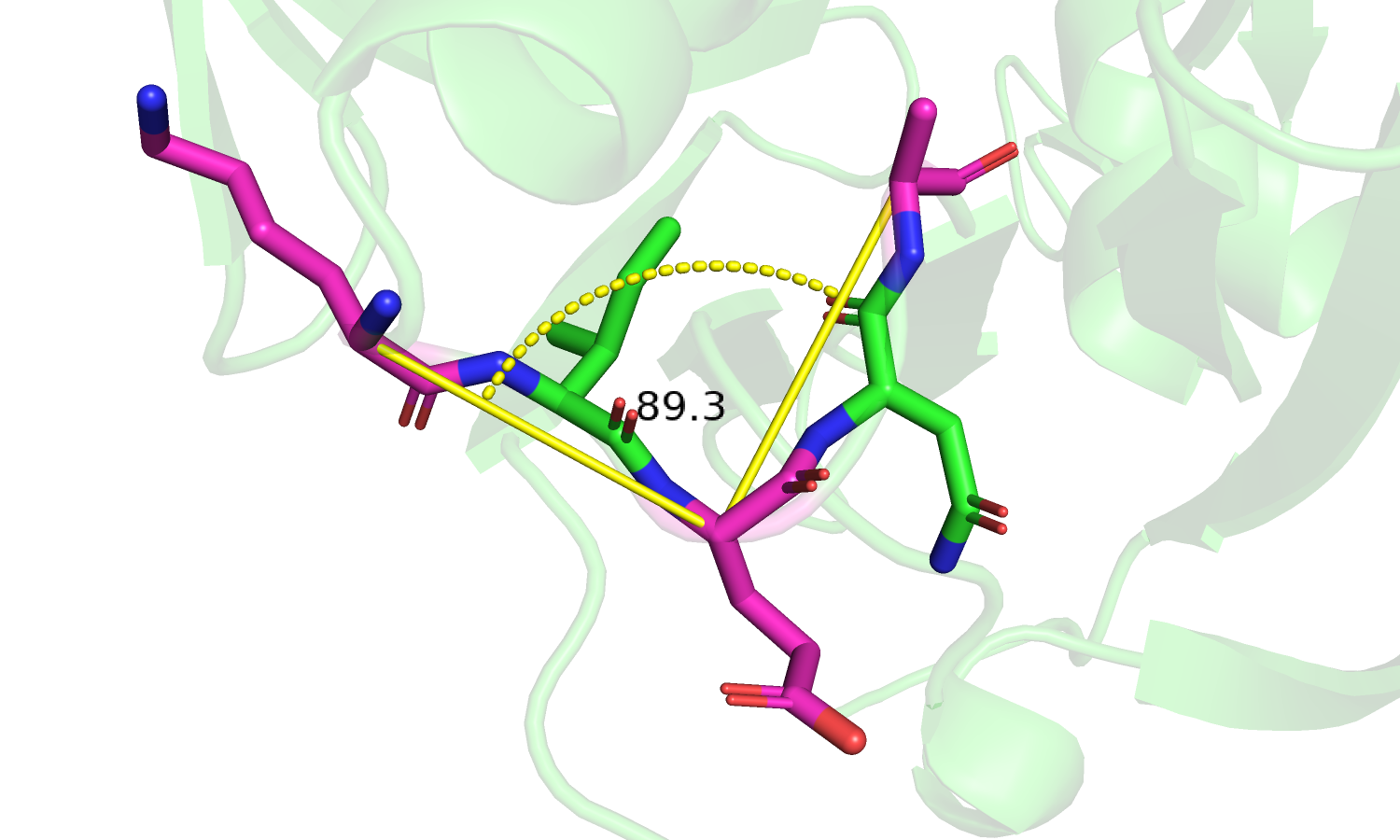 |
| Рис. 8. Фрагмент с остатками 148-152. |
| Остаток | Альфа-спираль | Бета-лист | Петля |
| G | 0.462643 | 0.699036 | 1.486157 |
| L | 1.435397 | 0.857811 | 0.732120 |
| Y | 0.977375 | 1.289711 | 0.921751 |
| E | 1.229321 | 0.707485 | 0.929957 |
| Q | 0.963363 | 0.968252 | 1.036812 |
| D | 0.702268 | 0.524605 | 1.370124 |
| N | 0.532813 | 0.794558 | 1.404318 |
| S | 0.878527 | 0.736836 | 1.173602 |
| F | 1.011401 | 1.459855 | 0.841643 |
| A | 1.482109 | 0.616223 | 0.777270 |
| K | 1.076309 | 0.727737 | 1.033800 |
| R | 1.141799 | 1.024881 | 0.889516 |
| H | 1.006869 | 1.062578 | 0.974611 |
| C | 0.890209 | 1.722349 | 0.843432 |
| V | 0.958425 | 2.019114 | 0.697306 |
| P | 0.538348 | 0.322393 | 1.554468 |
| W | 1.060495 | 1.584412 | 0.765540 |
| M | 1.261129 | 1.294691 | 0.715292 |
| T | 0.767691 | 1.439645 | 1.024168 |
| I | 1.129762 | 1.607298 | 0.708067 |