Визуализация молекул в JMol
На данной странице представлена визуализация структуры молекулы Endo-1,4-beta-xylanase, фермента, характерного для Thermoascus aurantiacus. Чтобы запустить скрипт, нажмите Start script, чтобы продолжить - Resume. Текст скрипта доступен по ссылке ниже.
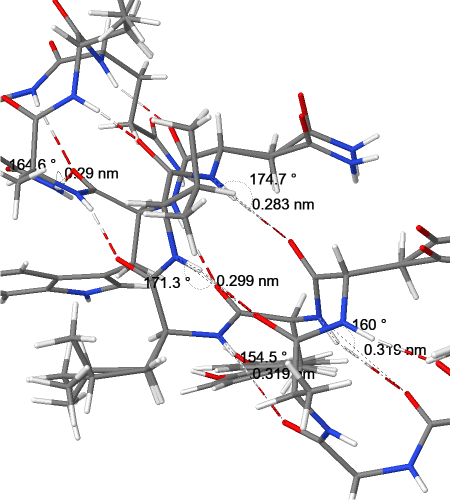
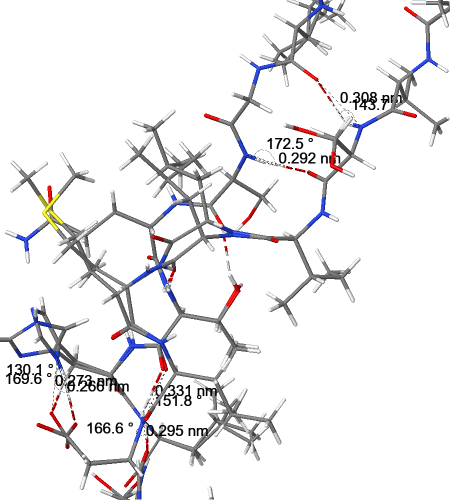
Параметры водородных связей между остовными атомами во вторичной структуре
| Имена атомов | Длина связи (Å) | Угол N-H-O (град.) |
|---|---|---|
| Альфа-спирали | ||
| O(65GLY) - N(69LEU) | 3.19 | 154.48 |
| O(66ALA) - N(70VAL) | 2.99 | 171.27 |
| O(67ASP) - N(71ASN) | 2.83 | 174.68 |
| O(64ALA) - N(68TYR) | 3.19 | 160.03 |
| O(72TRP) - N(76ASN) | 2.90 | 164.57 |
| Бета-тяжи | ||
| O(202ASP) - N(232GLU) | 2.98 | 142.77 |
| O(204ILE) - N(234SER) | 3.08 | 143.66 |
| O(234SER) - N(206SER) | 2.92 | 172.55 |
| O(239ASP) - N(209HIS) | 2.73 | 130.12 |
| O(208THR) - N(239ASP) | 3.31 | 151.31 |
Результаты:
По результатам измерений, среднее значение длины водородной связи между атомом кислорода одной аминокислоты (донором) и атомом азота другой аминокислоты (акцептором) для альфа-спирали составляет 3.02Å (максимальное в выборке - 3.19Å, минимальное - 2.83Å), а для бета-листа - 3.00Å (максимальное в выборке - 3.31Å, минимальное - 2.73Å). По данным литературы, стандартная длина водородной связи между электроотрицательными атомами составляет 2.7-3.0Å [1], и полученные данные соответствуют этому значению.Длина водородных связей в данном фрагменте сравнительно большая, что свидетельствует о их невысокой прочности (энергия Гиббса образования таких связей находится в диапазоне от -3 до -1 ккал/моль)[1]. По данным другого источника, данное значение принадлежит диапазону длин связей, характеризующихся средней силой [2].
Наиболее прочной водородной связи соответствует угол (N-H-O)=180, это значение можно считать идеальным. Водородные связи с углом 170-180 являются сильными, с углом >130 градусов - средней силы [2]. Углы в выбранным фрагментах варьируют от 154.48 до 174.68 градусов для альфа-спирали и от 142.77 до 172.55 градусов для бета-листа, что в целом соответствует водородным связям средней силы.
Источники:
1. HighPrecision Measurement of Hydrogen Bond Lengths in Proteins by Nuclear Magnetic Resonance Methods - Harris - 1999 - Proteins: Structure, Function, and Bioinformatics.2. Steiner, T. The Hydrogen Bond in the Solid State / T. Steiner // Angew. Chem. Int. Ed. - 2002. - V. 41. - P. 48-76.