Учебный сайт Фоменко Елены
| Главная | Семестры | Проекты | Заметки |
Цепь А.
Количество спиралей: 11. Количество бета-тяжей: 20. Количество реверсивных (β-) поворотов: 35.
По всей видимости, белок относится к типу α+β, т.к. элементы вторичной структуры не чередуются.
Для исследования выбраны элементы вторичной структуры: С помощью скрипта получены изображения:
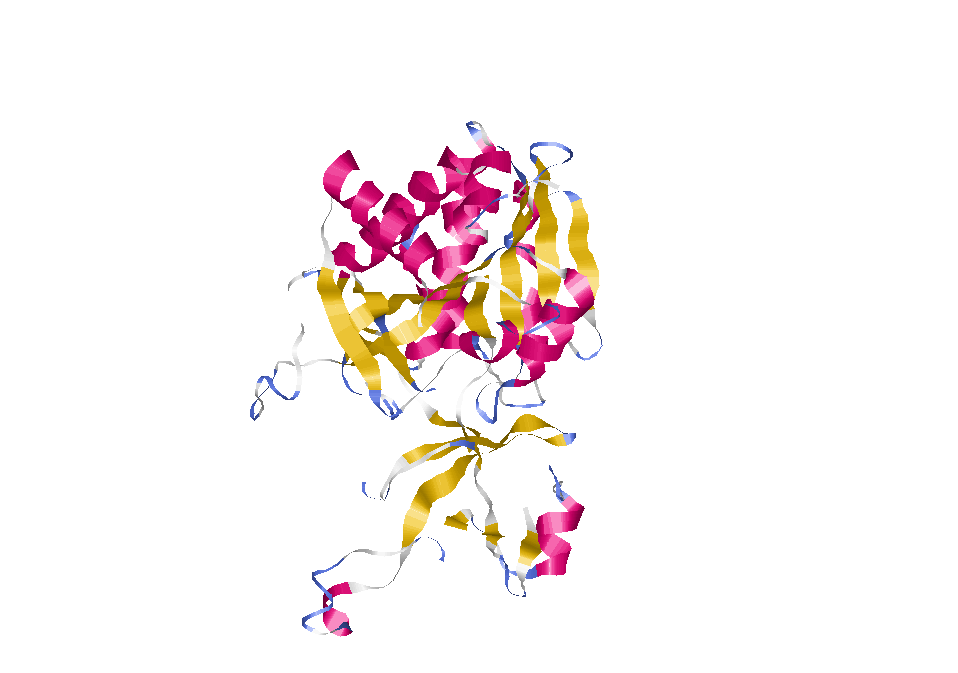
Вся цепь А в ленточной модели, выбранная спираль выделена цветом.
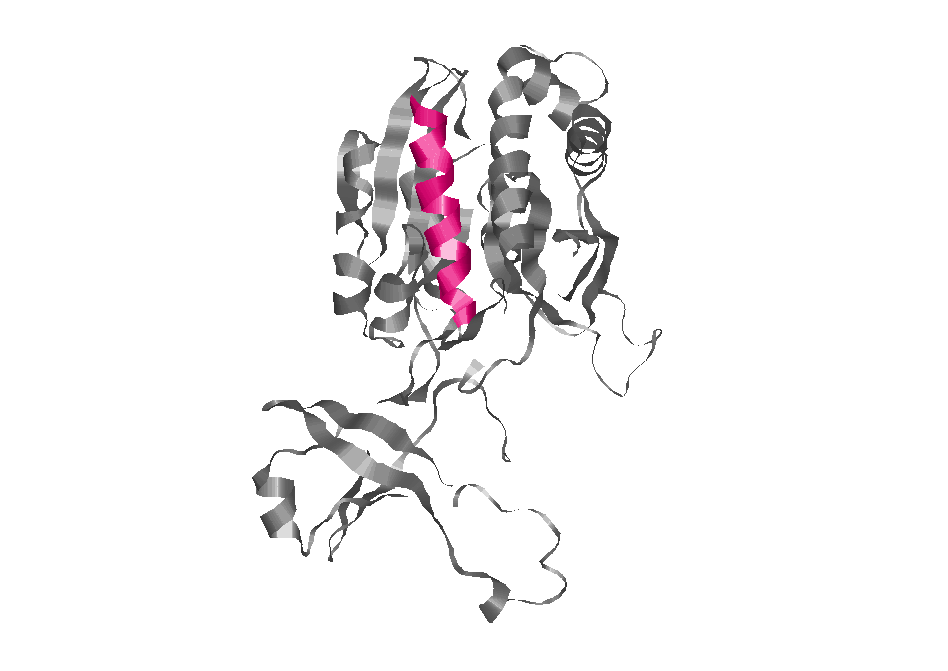
Только выбранная альфа-спираль.
Остов выбранной альфа-спирали представлен в проволочной модели с раскраской по атомам; Добавлены атомы Сβ в виде небольших красных шариков, соединенных тонкими линиями с атомами Сα.
Атомы кислорода одного остатка чаще связаны с водородами остатков, отстоящих через 3 от первого.
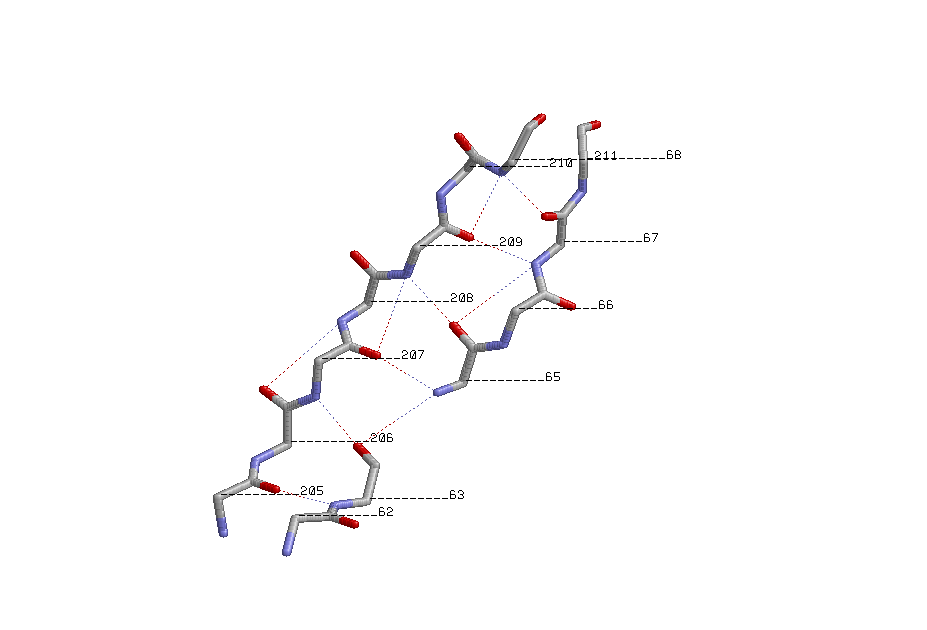
Таким образом, общий паттерн более частых Н-связей: Н(i, i+4). Выбранные β-тяжи: 205-211; параллельный ему 62-68 и антипараллельный 50-55.
Разрыв в изображении одного из листов возник из-за того, что селенметионин, согласно pdb-файлу, не входит в состав основной цепи белка.
Параллельные β-тяжи. Показаны водородные связи, номера остатков:
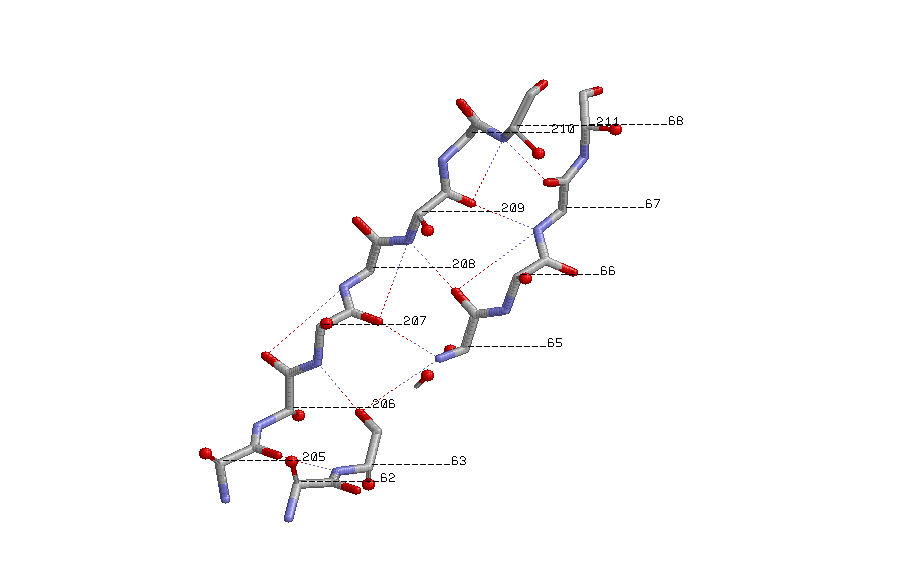
Показаны β-углеродные атомы:
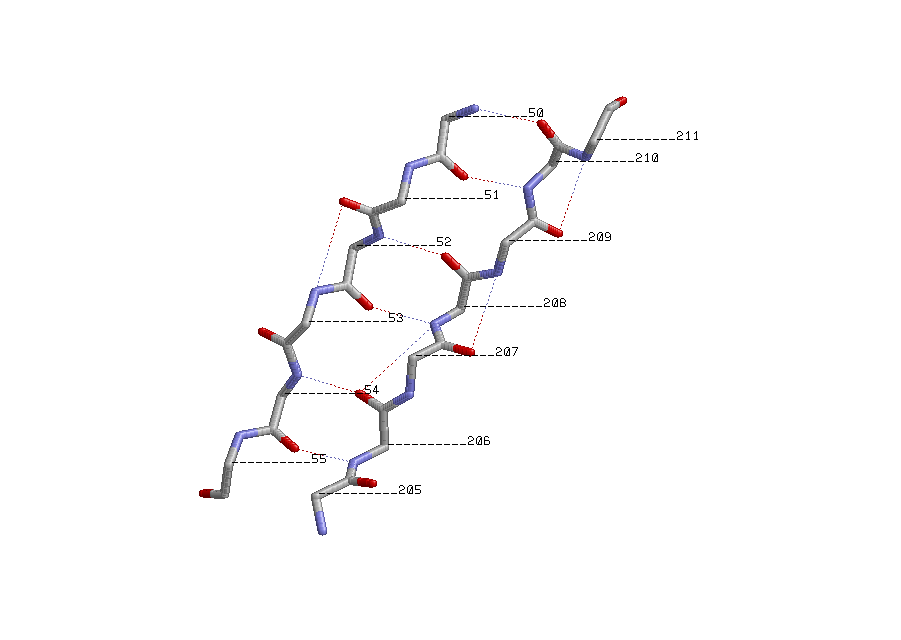
Антипараллельные β-тяжи:
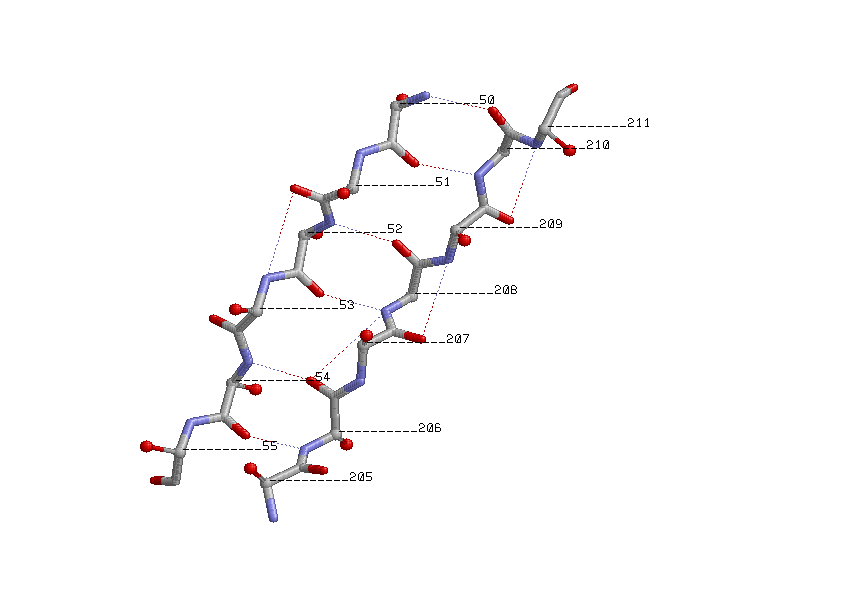
Показаны β-углеродные атомы:
β-углеродные атомы расположены поочередно над и под плоскостями листов,
выходят под одинаковыми углами к соседним связям.
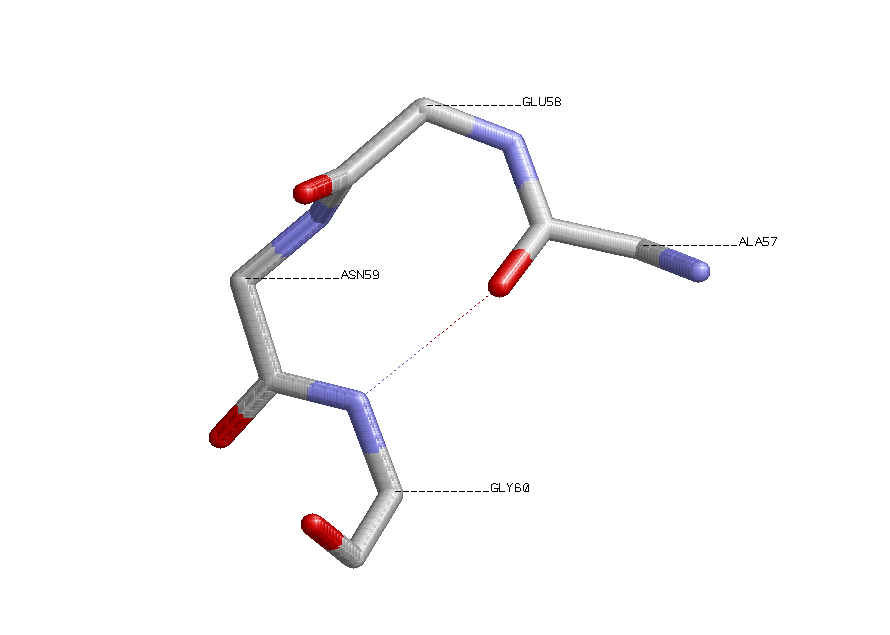
Выбран поворот Ala57-Glu58-Asn59-Gly60.
Имеется Н-связь, "скрепляющая" поворот.
α-спираль 181-198
β-тяж 205-211, параллельный ему тяж 62-68 и антипараллельный 50-55
β-поворот Ala57-Glu58-Asn59-Gly60

показаны водородные связи между атомами остова; около каждого атома Сα указан номер остатка.
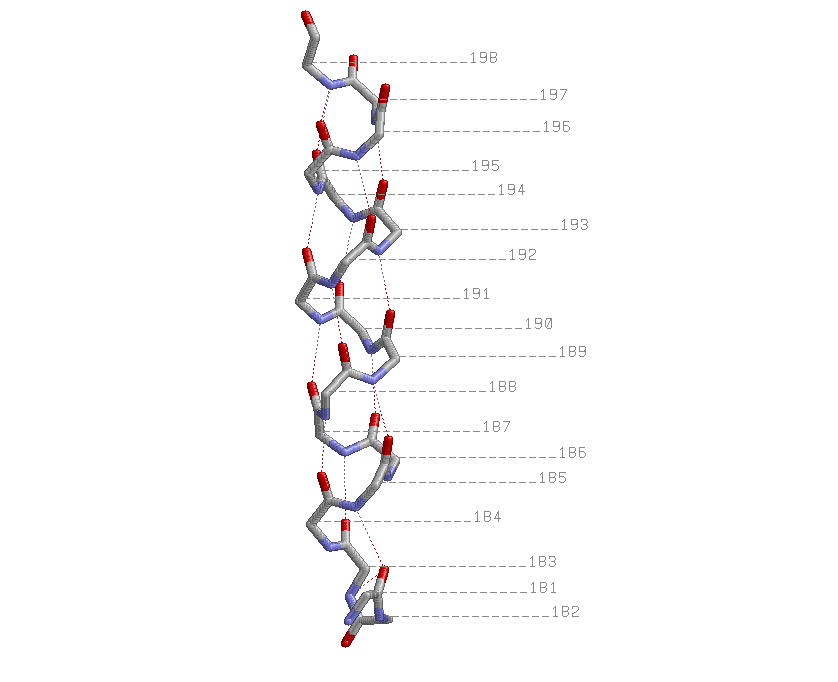
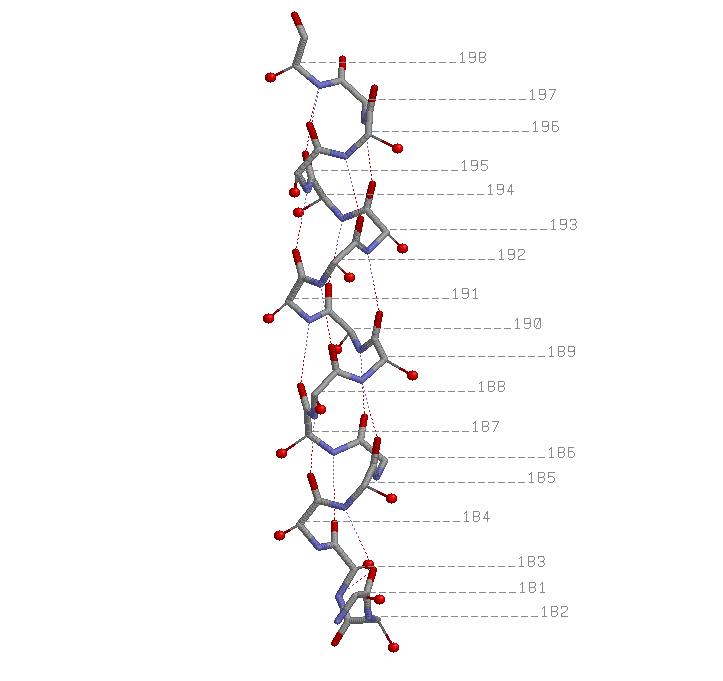
Водородные связи также обнаружены между кислородом 195-го и азотом 198-го остатов, кислородом 181-го и азотом 183-го остатков.
Атомы Сβ торчат из спирали наружу, под одинаковыми к соседним связям углами.