Исследование ДНК-белковых взаимодействий в структуре комплекса Т-белка - регулятора транскрипции и фрагмента ДНК - палиндромного связывающего сайта Т-домена
- Краткое описание структуры в файле 1XBR.pdb
В файле приведены координаты атомов двух молекул
из эмбриона Xenopus laevis (Африканская шпорцевая лягушка) :
фрагмента молекулы ДНК (5'-D(*AP*AP*TP*TP*TP*CP*AP* CP*AP*CP*CP*TP*AP*GP*GP*TP*G P*TP*GP*AP*AP*AP* TP*T)-3'), несущего информацию о гене brachyury(T), или XBRA, состоящего из двух цепей - C и D
и молекулы белка (T PROTEIN), состоящей также из двух цепей - A и B.
Для исследования ДНК-белковых взаимодействий были выбраны цепи A и B белка и цепи C и D, представляющие собой фрагмент ДНК со следующей последовательностью:
цепь C [501] 5' - AATTTCACACCTAGGTGTGAAATT - 3' [524]
||||||||||||||||||||||||
цепь D [524] 3' - TTAAAGTGTGGATCCACACTTTAA - 5' [501],
где
501 и 524 - номера первого и последнего нуклеотида.В клетке белок располагается в ядре. Экспрессируется в мезодермальных клетках вокруг бластопора и далее в нотохорде, работает на стадии гаструлы и нейрулы во вгибающейся мезодерме и в нотохорде.
Далее, в программе Excel определялись средние значения торсионных углов для
внутренних нуклеотидов. Для этого было построено
по 3 таблицы и по одной диаграмме для двух исследуемых цепей ДНК.
Первая таблица представляет собой выдержку из файла
dna_old.out.
Вторая является небольшой модификацией первой, в ней все углы пересчитаны
в неотрицательные значения, что позволяет высчитывать средние углы.
Третья таблица представляет собой
своеобразную статистическую сводку, в ней находятся величины,
характеризующие модуль отклонения величины угла от соответствующего
среднего значения.
По третьей таблице построена точечная диаграмма,
наглядно отображающая отклонения углов от среднего.
Кроме того, справа от третьей таблицы посчитаны суммы отклонений углов
каждого основания, максимальные значения выделены цветом.
В каком-то смысле, эти максимумы характеризуют самый "кривой" нуклеотид
со значениями торсионных углов, суммарно наиболее отклоняющимися от средних.
Далее было интересно изучить структуру взаимодействующих ДНК и белка в
программе RasMol и понять, как располагаются нуклеотиды, получившиеся
наиболее "кривыми".
Вообще, по диаграммам, полученным в Excel, явно заметно, что
наибольшее отклонение от среднего наблюдается по углам alpha и gamma.
И по ним наиболее "вывернутыми" у нас оказываются 7 нуклеотидов. На рисунке
ниже, полученном в RasMol, эти нуклеотиды обозначены розовым и желтым цветами
(в зависимости от цепи). Среди них я отметила 2, для которых сумма отклонений
по всем углам максимальна, т.е. самые "кривые".
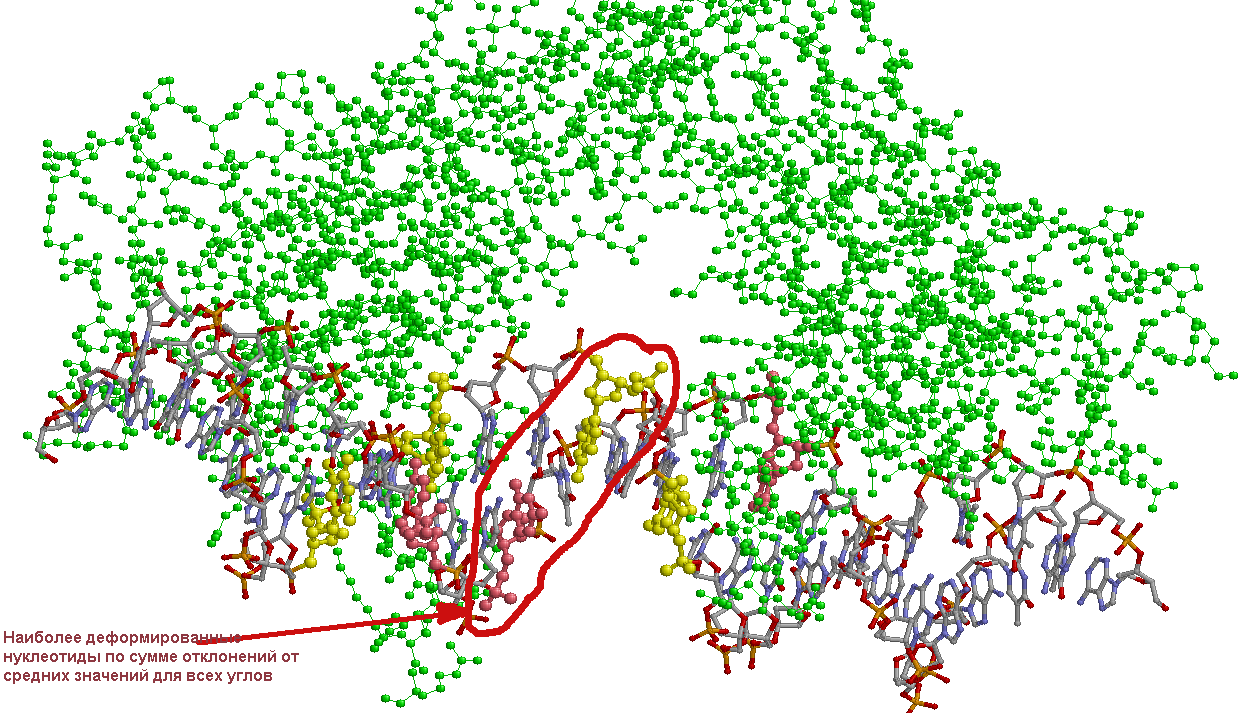
Интересно заметить, что у нас белок связывает палиндромную ДНК почти симметрично с двух концов, а между этими, условными для нас, областями связывания, имеется довольно большой промежуток между ДНК и белком. Но самые "кривые" нуклеотиды находятся именно в этом промежутке, примерно посередине ДНК. Очень интересное наблюдение, на мой взгляд. Оно говорит о том, что при связывании с белком в данном случае ДНК деформируется довольно значительно, и не только в самих областях связывания, но и по всей структуре.
Назовем полярным контактом ситуацию, в которой расстояние между полярным атомом белка и полярным атомом ДНК меньше 3.5Å. Аналогично, неполярным контактом будем считать пару неполярных атомов на расстоянии меньше 4.5Å.
С помощью программы RasMol и скрипта, в котором определяются необходимые множества атомов, можем собрать некоторую статистику и свести ее в таблицу:
Таблица. Контакты разного типа в комплексе 1XBR.pdb
| Контакты атомов белка с | Полярные | Неполярные | Всего |
| остатками 2'-дезоксирибозы | 6 | 67 | 73 |
| остатками фосфорной кислоты | 20 | 31 | 51 |
| остатками азотистых оснований со стороны большой бороздки | 2 | 11 | 5 |
| остатками азотистых оснований со стороны малой бороздки | 2 | 5 | 2 |
По сравнению с другими числами,
довольно большим кажется число
неполярных контактов дезоксирибозы и белка. Возможно, это объясняется
относительной доступностью сахара для контакта с белком, а также наличием
в каждом остатке дезоксирибозы пяти неполярных атомов углерода.
Полярных же атомов в остатке дезоксирибозы всего 3,
кроме того, расстояние для полярных контактов значительно меньше, чем для
неполярных - поэтому и полярных контактов дезоксирибоза-белок намного меньше,
чем неполярных.
В среднем, полярных атомов
в большой и малой бороздках почти поровну. И видимо поэтому они образуют
одинаковое число полярных контактов с белком, как видно из таблицы.
Неполярных же атомов
в основаниях большой бороздки значительно больше,
чем в основаниях малой - для них больше и число неполярных контактов.
>nucplot 1XBR_old.pdb
в результате чего получили следующие 3 картинки со схемой ДНК-белковых контактов:
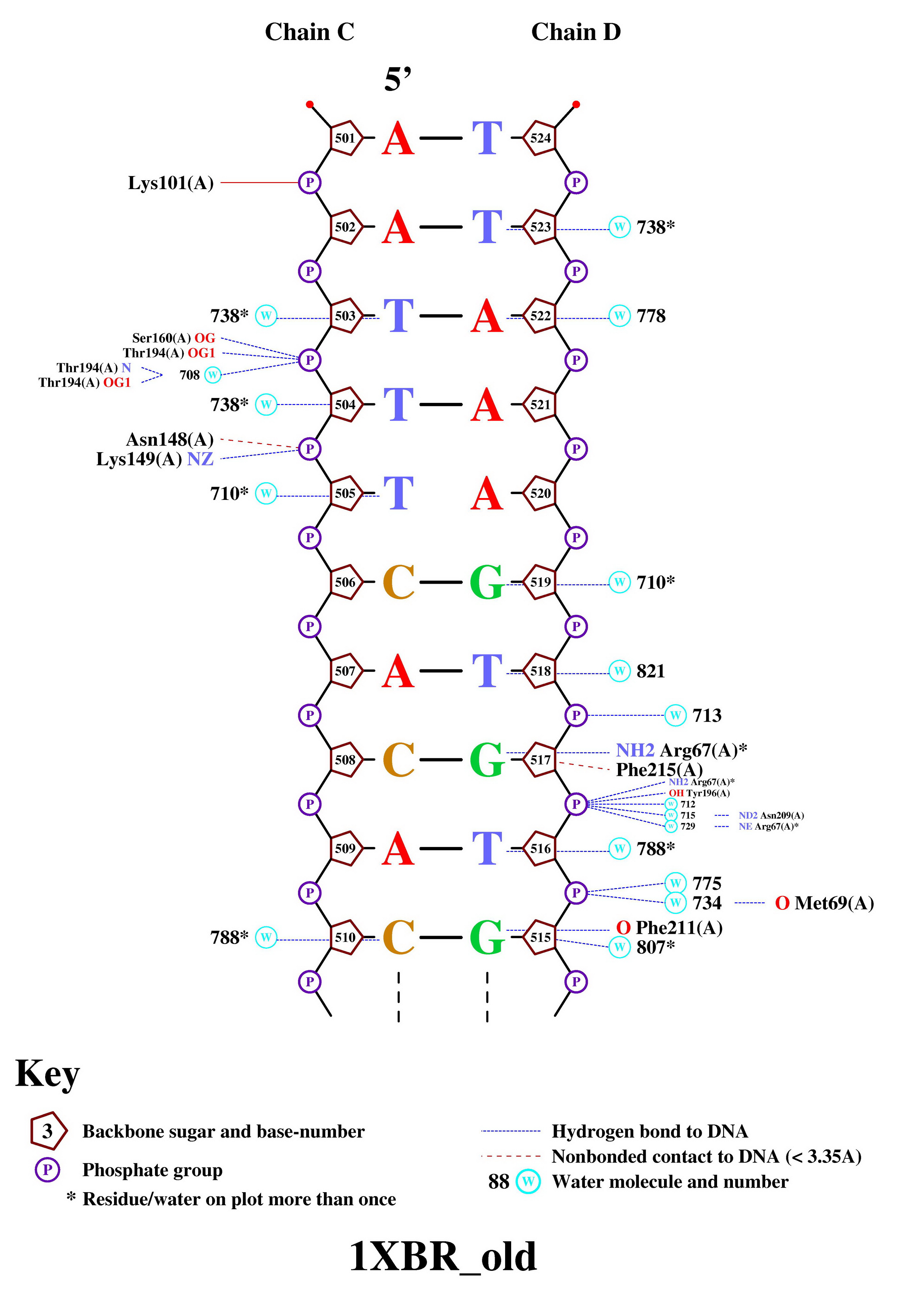
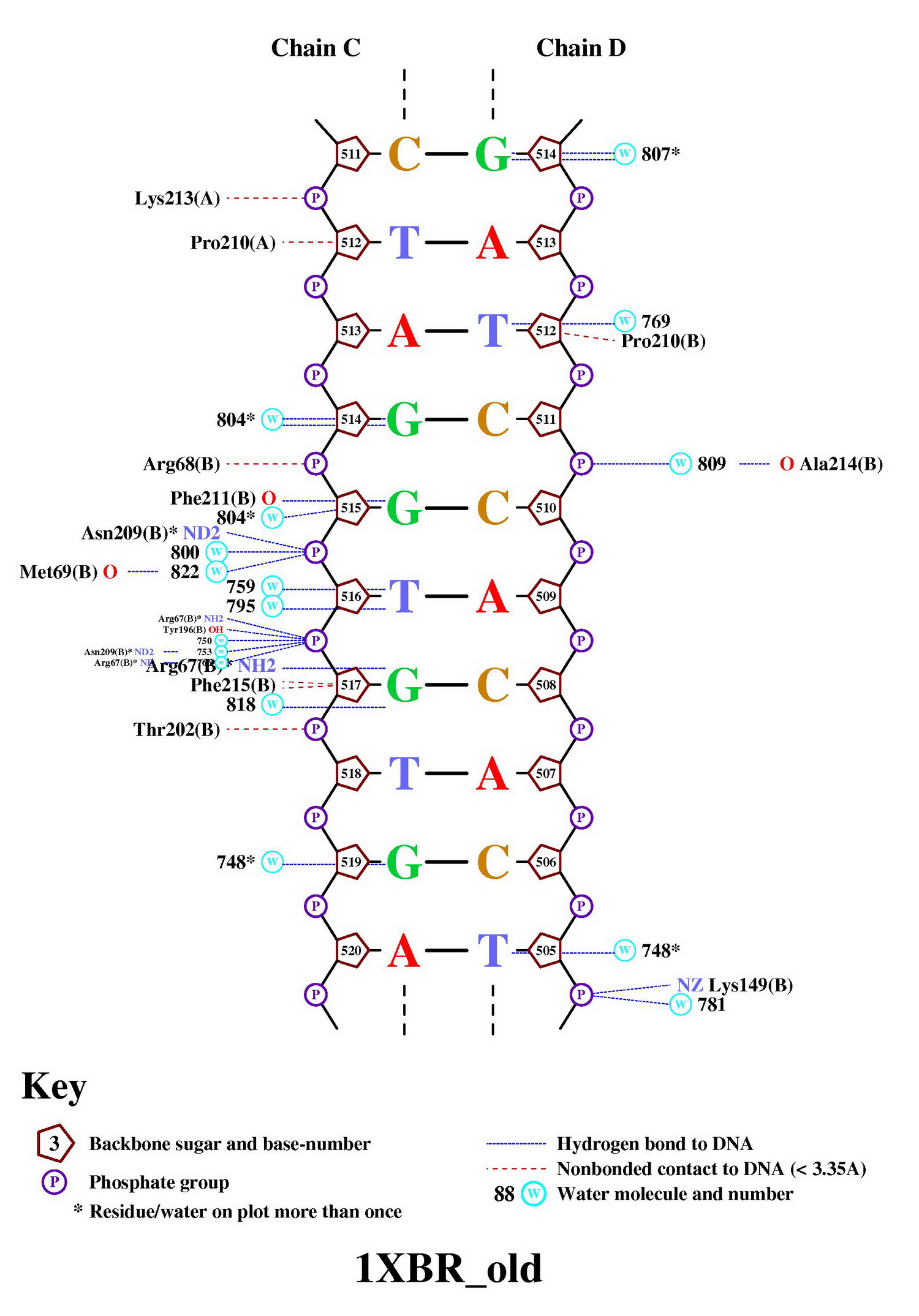
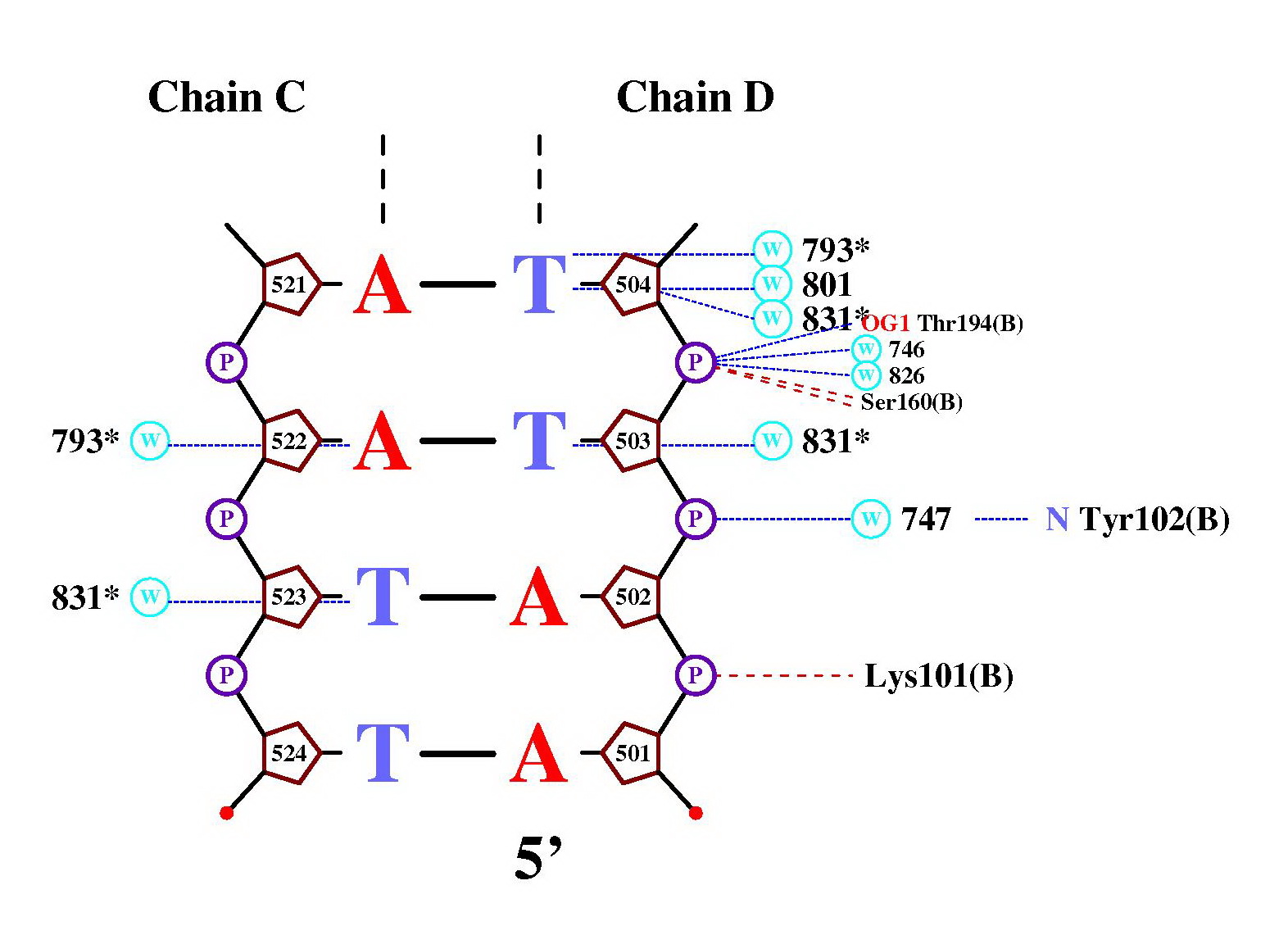 Помимо контактов ДНК с белком, на схеме представлены
многочисленные контакты с лигандами.
Помимо контактов ДНК с белком, на схеме представлены
многочисленные контакты с лигандами.
Число контактов белок-дезоксирибоза и
белок-остаток фосфорной кислоты на схеме практически не отличается.
Но при исследовании в RasMol мы получили, что контактов
первого типа на порядок больше. Это объясняется различными подходами
к распознаванию взаимодействий. Дело в том, что nucplot ищет контакты между
основанием ДНК и аминокислотами, а при помощи скрипта в RasMol мы искали
взаимодействия между самими атомами.
В третьем задании мы получили, что самые "искривленные" нуклеотиды имеют номера
511, 513, 516, 518 для цепи С и 509, 514, 517 для цепи D.
Далее, изучив структуры в RasMol, обнаружили, что область "искривления"
не зависит напрямую от зоны контактов с белком. И эти наблюдения
подтверждаются популярной схемой контактов, выданной программой Nucplot.
Во-первых, этот контакт является взаимодействием аминокислоты и азотистого основания, что является одним из главных признаков распознающего контакта. Во-вторых, эта пара вообще находится в зоне нуклеотидов с 514:C по 518:C, где наблюдается много разнообразных взаимодействий между нуклеотидами и аминокислотами или лигандами, т.е. сама эта зона может служить сайтом распознавания. В RasMol эта пара выглядит следующим образом:
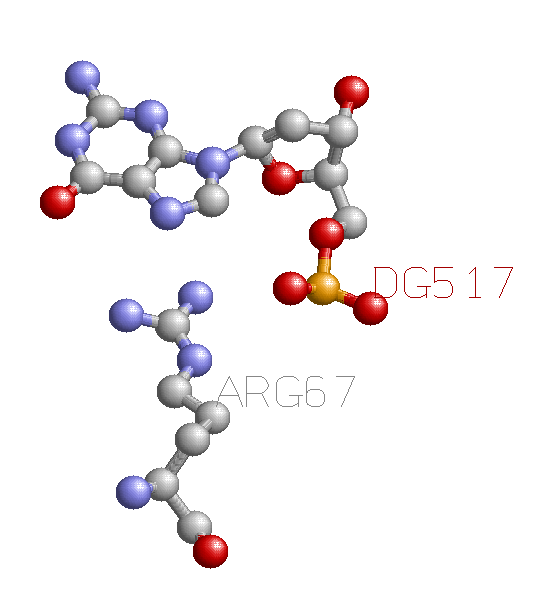
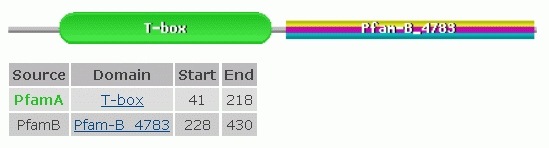
В моем белке представлен ДНК-связывающий домен T-box. Кодирующие его гены были
найдены в геномах многих животных, но ни разу - в других царствах живой природы.
Домен белка может связываться с ДНК, играя роль регулятора транскрипции.
Домены из соответствующего семейства обычно необходимы для развития особых
органов или тканей, в которых они и экспрессируются.
Мутации в генах домена T-box вызывают у человека такие состояния, как расщелина
нёба (связана с Х-хромосомой) или синдром DiGeorge.
В Pfam была найдена информация о том, что данный домен связывается с ДНК
в области последовательности TCACACCT. Такая последовательность в изучаемом
фрагменте ДНК встречается дважды: в D- и С-цепях с 505
по 512 нуклеотиды. Но, судя по схеме, выданной программой nucplot,
эти последовательности не имеют непосредственного контакта с белком.
Зато огромное число контактов с белком имеют последовательности,
комплементарные TCACACCT. Они, по-видимому, и являются областями распознавания.
И как раз в этой области лежит контакт, рассматриваемый в предыдущем задании
как возможный распознающий. То есть, видимо, это предположение было верным.