Практикумы 3-5. Анализ pdb файла белка AF2198.
pdb_id 1OI0 соответствует белку-протеазе AF2198 из археи ARCHAEOGLOBUS FULGIDUS. Он входит в состав протеосомы и отвечает за отщепление убиквитина от белков пе>
Он является гомотетрадимером, то есть состоит из четырех субъедениц с одинаковой последовательностью (см. рис. 1).
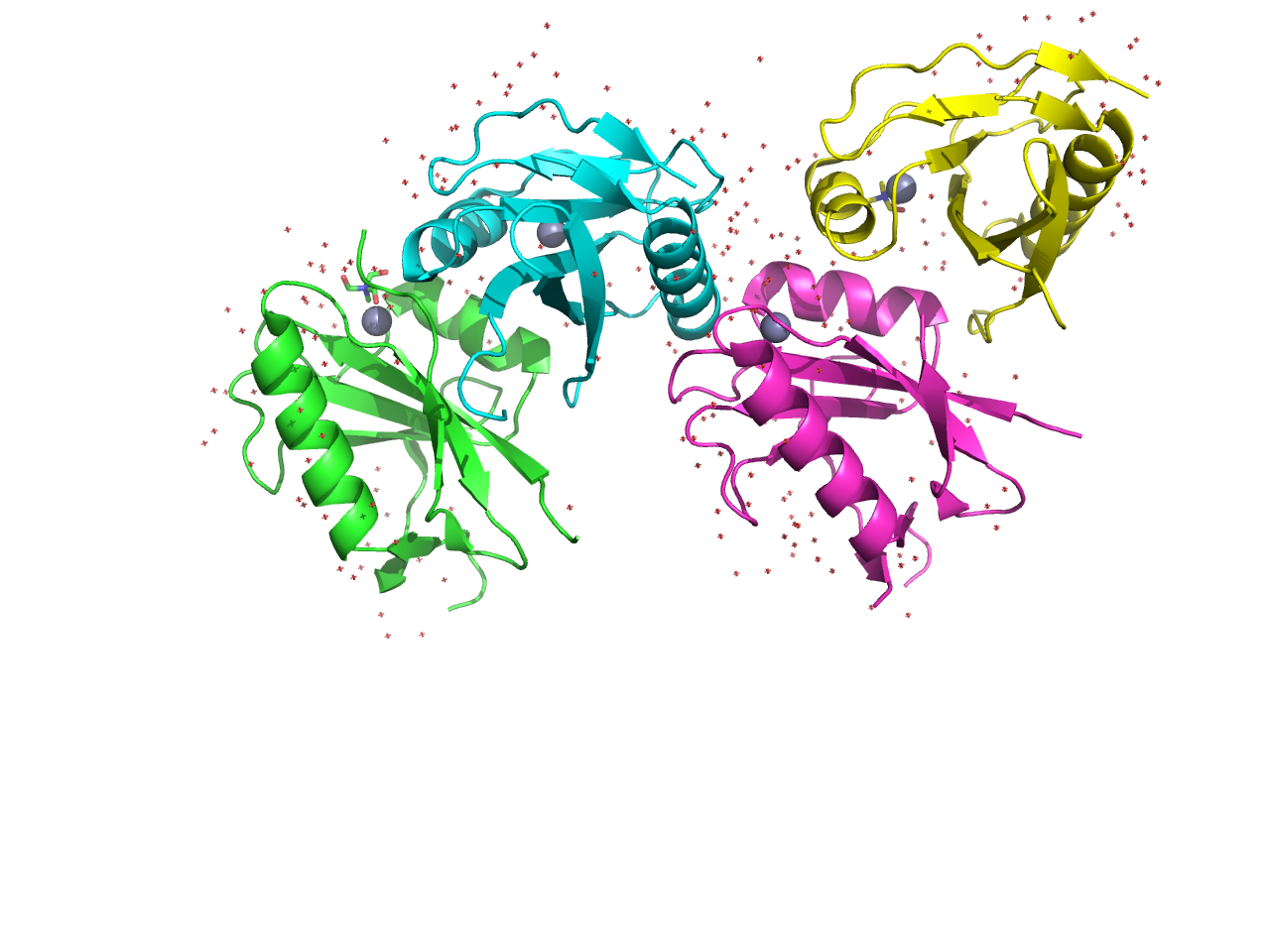
Рисунок 1. Структурная модель белка AF2198. Разными цветами показаны разные субъединицы. Ионы цинка окрашены в серый. Красными крестиками обозначены молекулы воды. Также видны молекулы TRIS.
Структура одной субъединицы показана на рисунке 2. В ней присутствует 2 альфа-спирали и 7 бета-листов. Такое строение характерно для многих гидролаз (см. рис. 2).
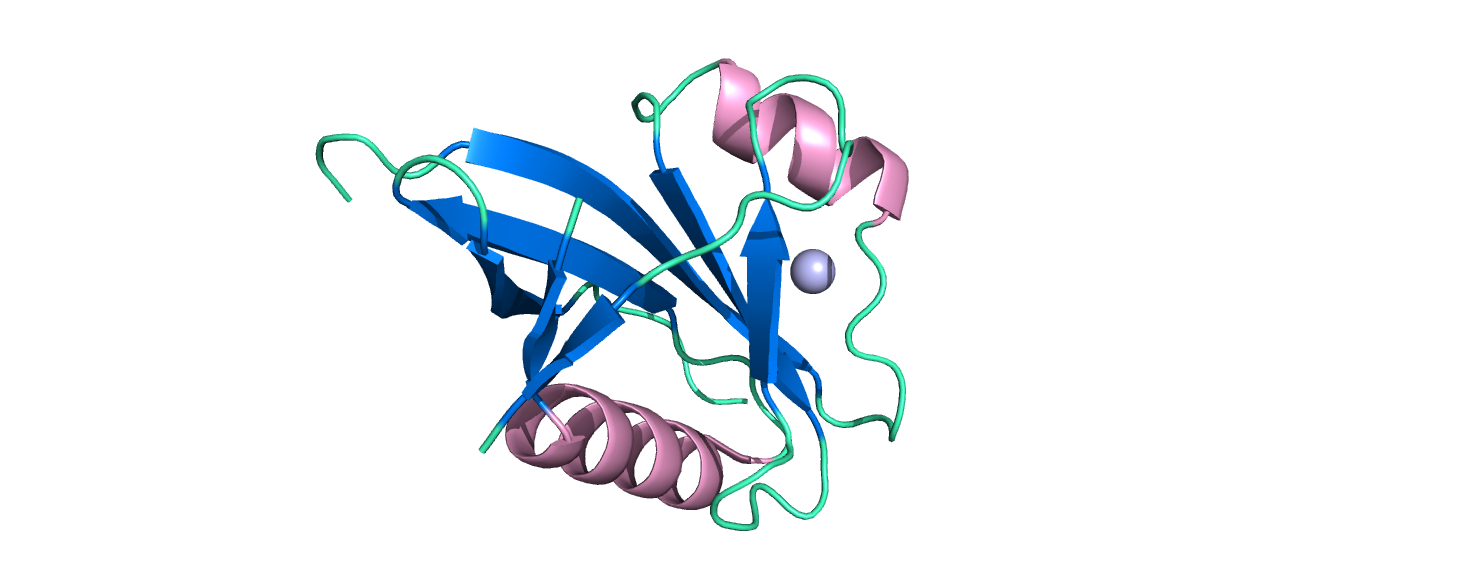
Рисунок 2. Структура одной субъединицы белка. Альфа-спирали выделены розовым, бета-листы - синим, атом цинка - серым.
В последовательности из файла pdb отсутствуют мутации относительно референса из Uniprot (в файле нет раздела SEQADV).
В составе белка нет модифицированных аминокислотныхостатков (в файле нет раздела MODRES).
В записи присутствуют 3 вида малых молекул: ZN (ZINC ION), 144 (TRIS-HYDROXYMETHYL-METHYL-AMMONIUM) и HOH (вода) (см. рис. 1). Более подробная информация находится в файле /home/students/y22/liza-p/public_html/term2/pr3_het.txt
Вода попала в состав белка из раствора. Ее молекулы всегда взаимодействуют с белками и поэтому присутствуют в их структурах. TRIS был добавлен искусственно. Это один из реагентов, которые используются в кристалографии.
Ион цинка входит в состав активного центра белка и играет важную роль в катализе реакции деубиквитинилирования. Помимо него в активный центр входят аминокислотные остатки гистидина 70, серина 80 и аспарагиновой кислоты 83 (см. рис. 3). Они составляют так называемую каталитическую триаду. Белок AF2198 является сериновой протеазой и работает по обычному для них механизму (см. рис. 4). Роль иона цинка состоит в том, что он взаимодействует с молекулой воды, стимулируя ее диссоциацию. Полученный гидроксид-ион далее нуклеофильно атакует атам углерода субстрата.
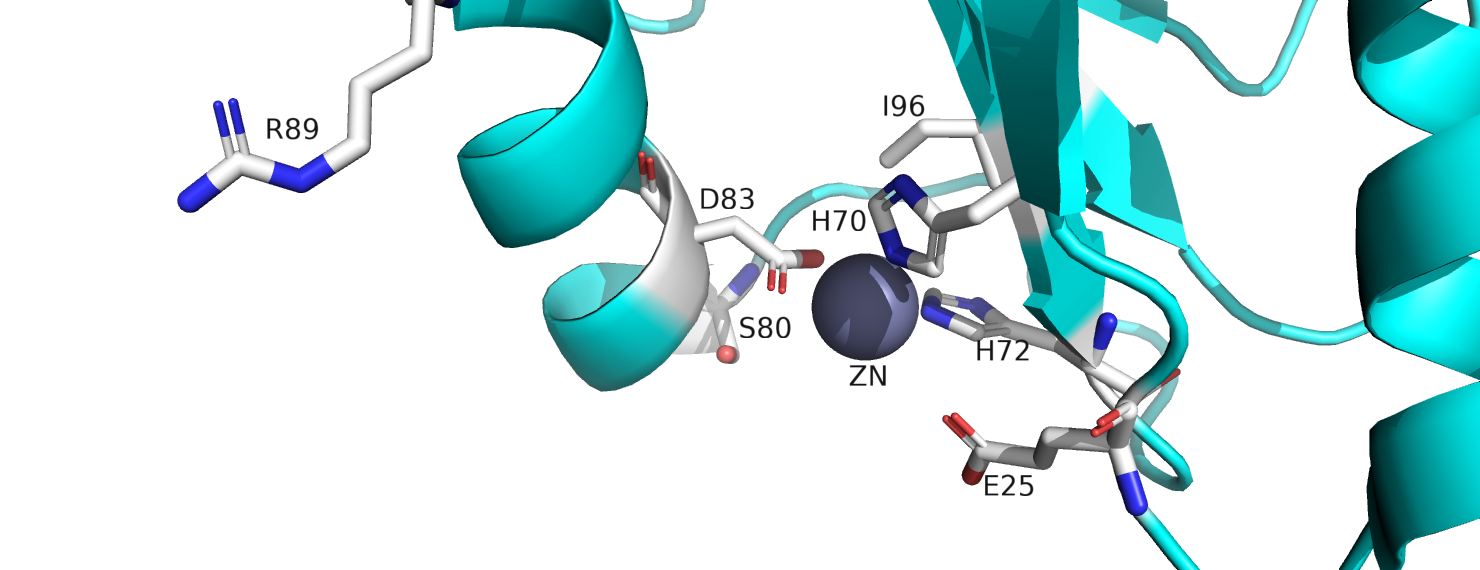
Рисунок 3. Активный центр фермента.
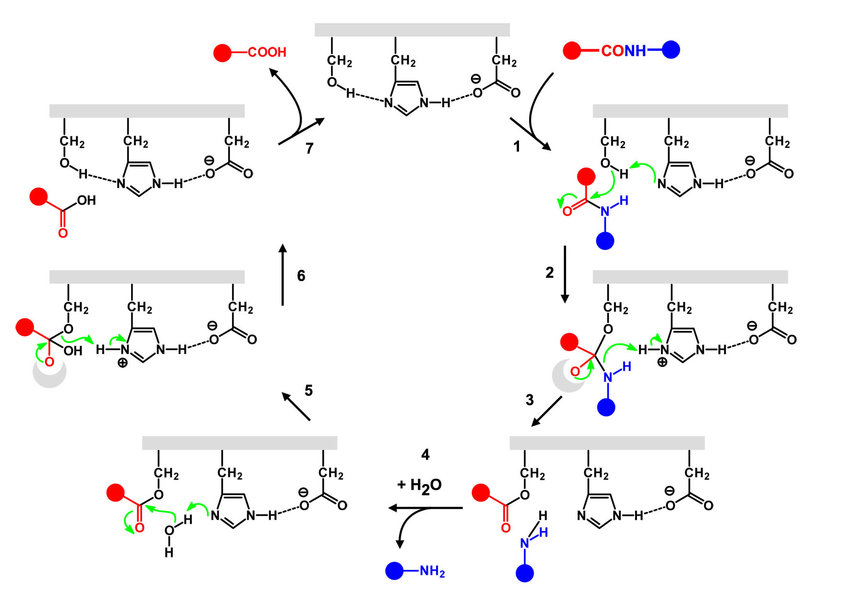
Рисунок 4. Каталитический механизм сериновой протеазы (https://www.researchgate.net/publication/329068953_Recent_Advances_in_Inhibitors_of_Flavivirus_NS2B-NS3_Protease_from_Dengue_Zika_and_West_Nile_Viruses)
Взаимодействия между аминоксилотами
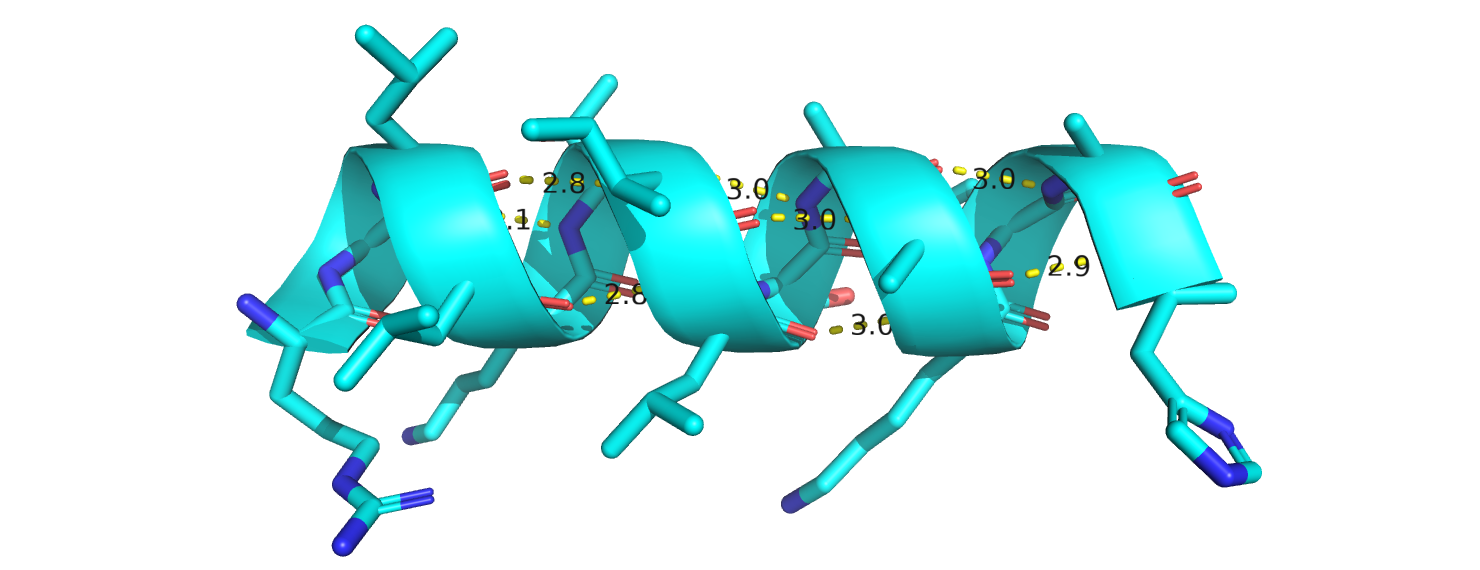 А.
А.
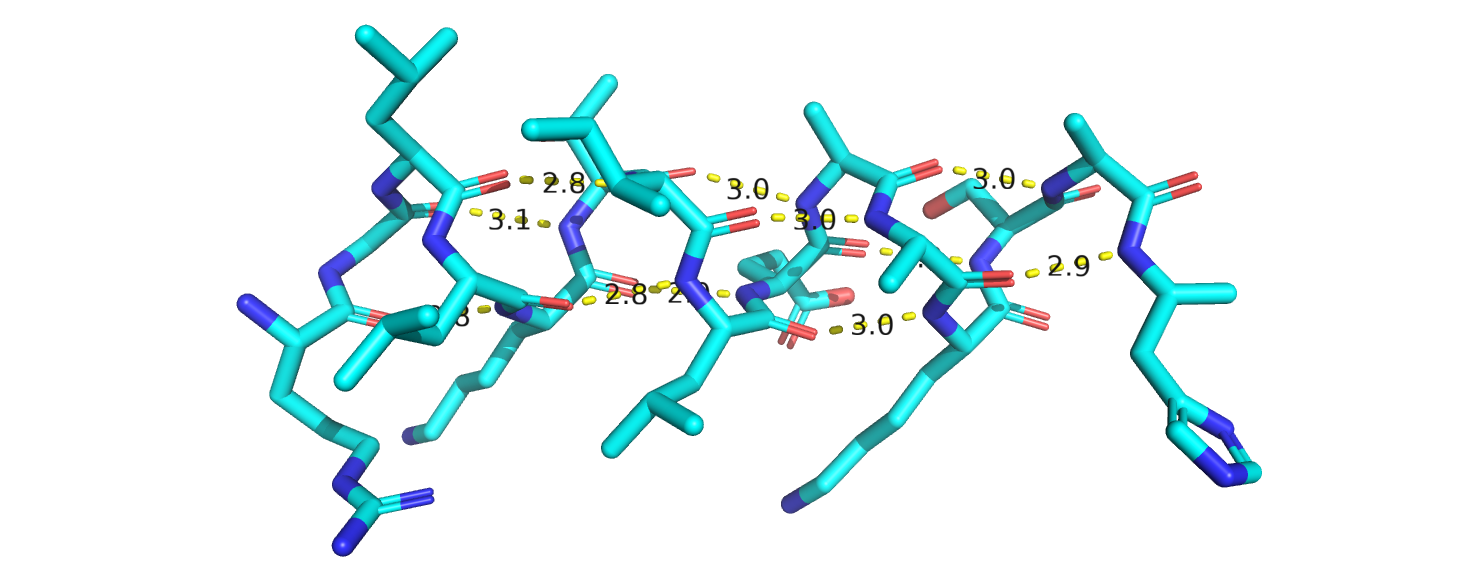 Б.
Б.
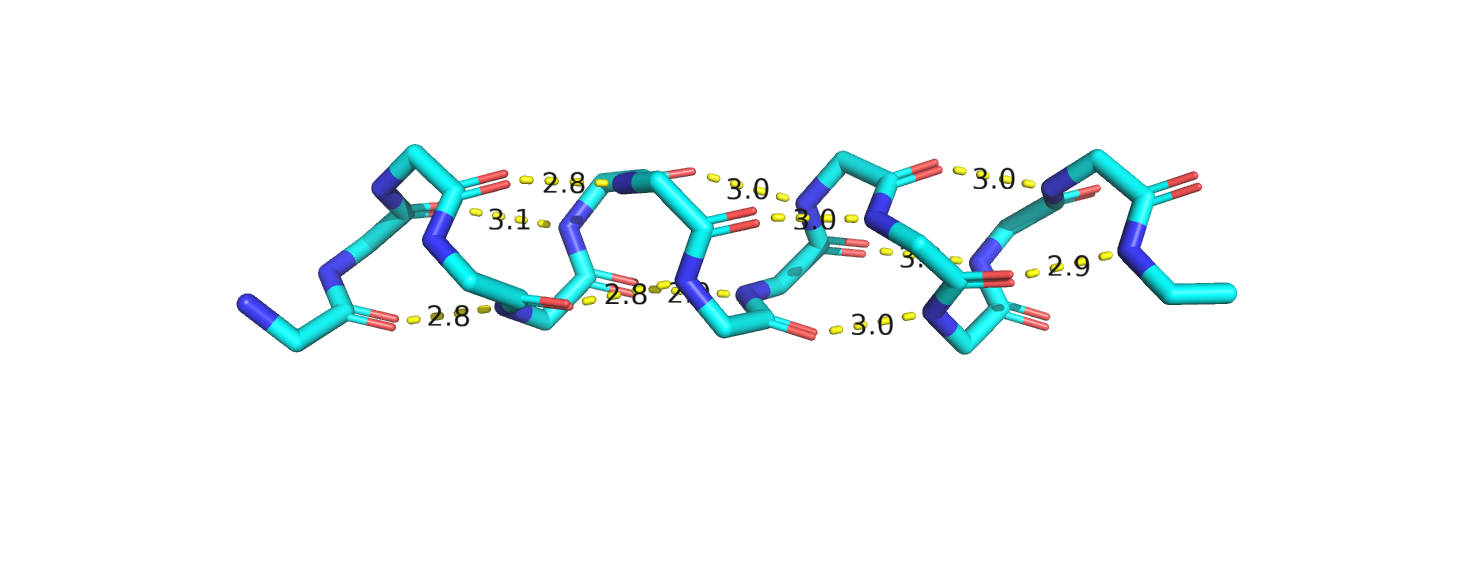 В.
Рисунок 5. Альфа-спираль с водородными связями между атомами остова. А-показана ленточная модель. Б-Показаны боковые радикалы. В-боковые радикалы не показаны.
В.
Рисунок 5. Альфа-спираль с водородными связями между атомами остова. А-показана ленточная модель. Б-Показаны боковые радикалы. В-боковые радикалы не показаны.
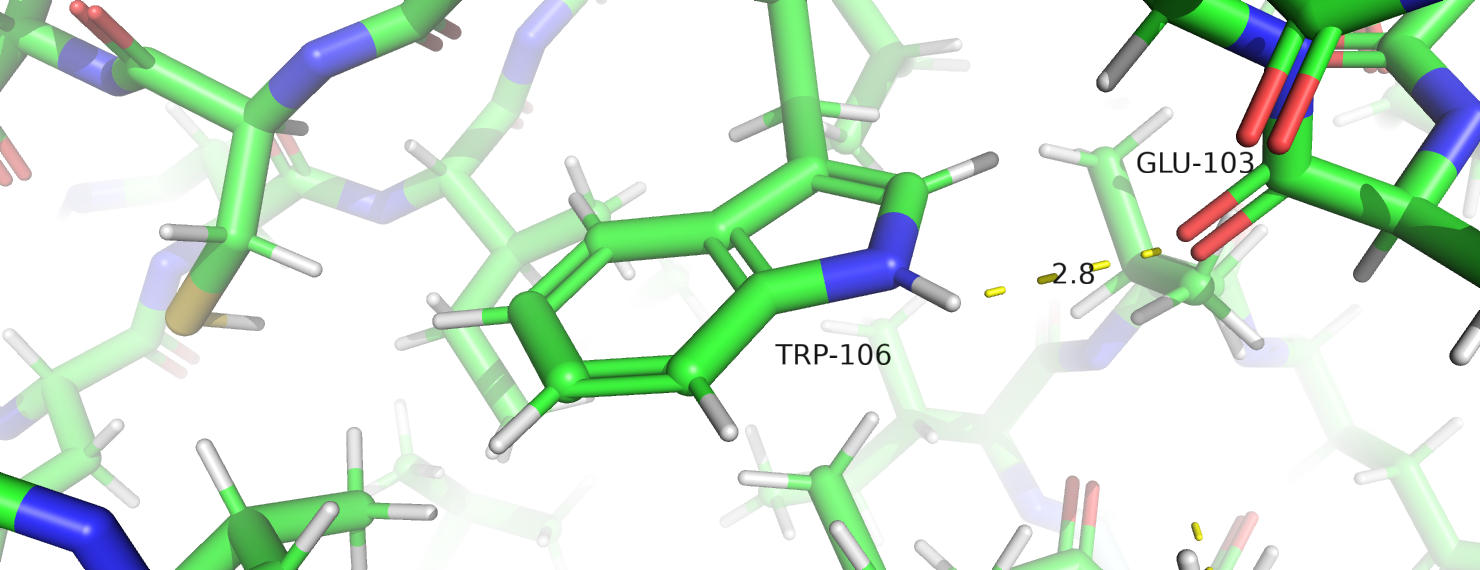 Рисунок 6. Водородная связь, в которую вовлечен атом бокового радикала.
Рисунок 6. Водородная связь, в которую вовлечен атом бокового радикала.
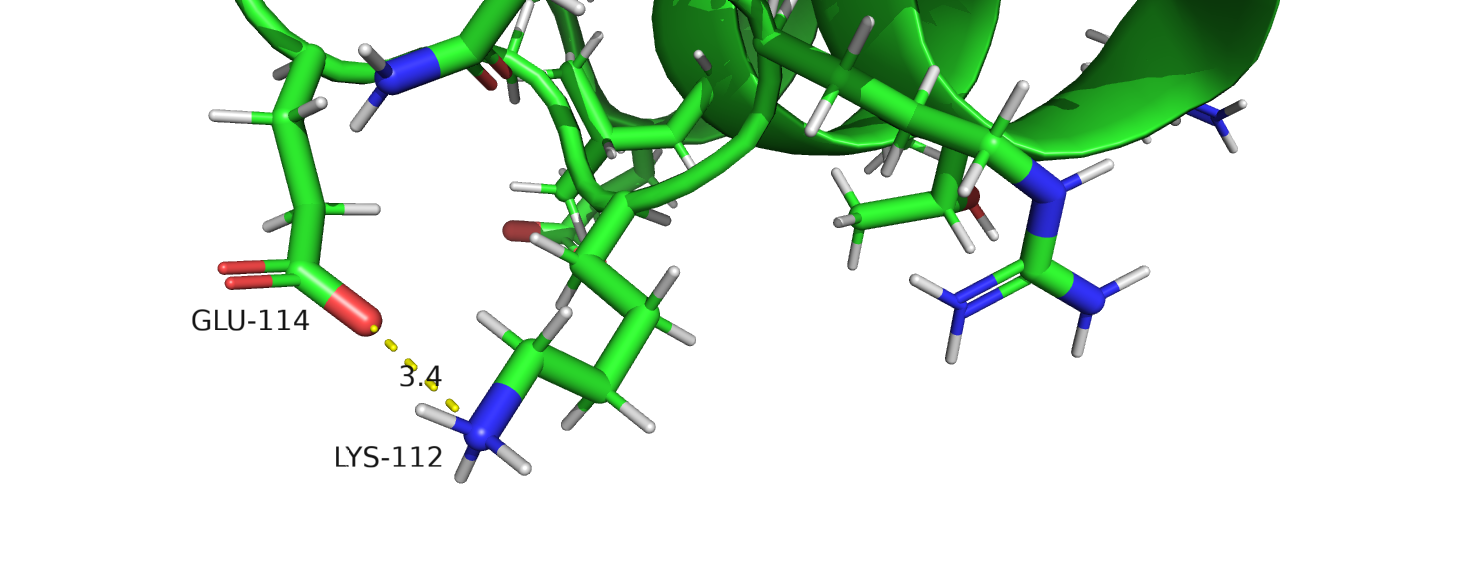 Рисунок 7. Солевой мостик.
Рисунок 7. Солевой мостик.
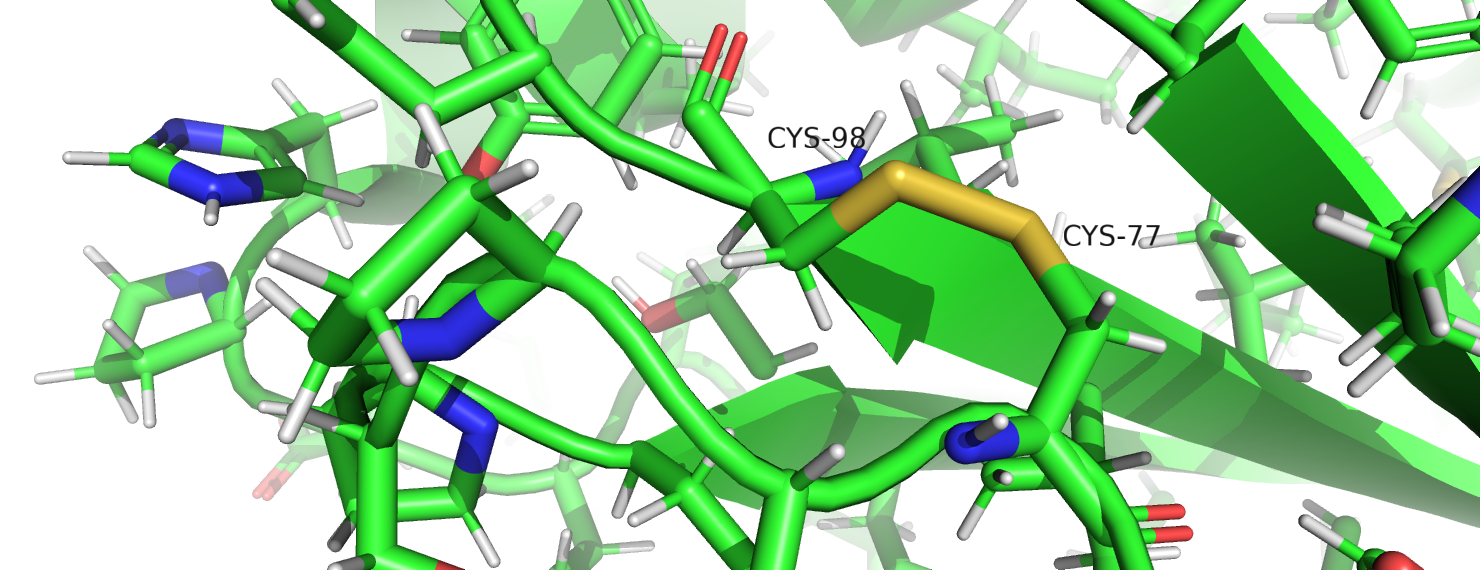 Рисунок 8. Дисульфидная связь.
Рисунок 8. Дисульфидная связь.
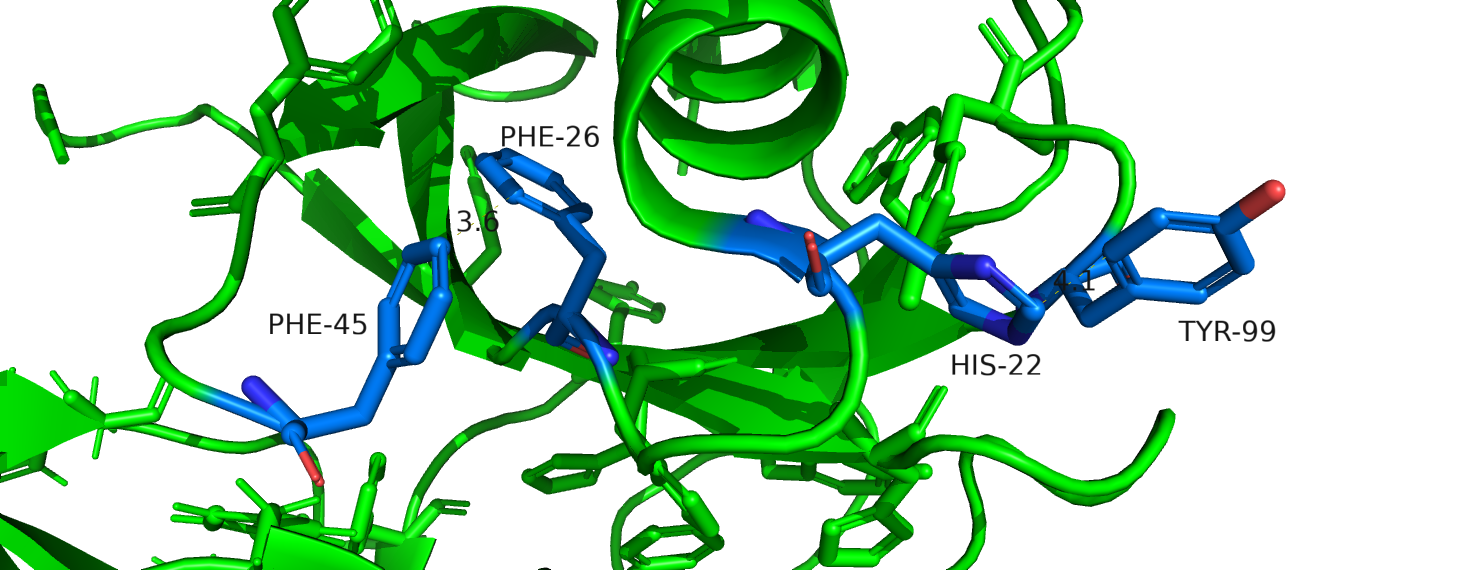 Рисунок 9. Стекинг. Слева - Т-стекинг, справа - параллельно-сдвинутый.
Рисунок 9. Стекинг. Слева - Т-стекинг, справа - параллельно-сдвинутый.
Источник:
H.J.T.T. Tran, M.D. Allen, J. Lowe, M. Bycroft. CRYSTAL STRUCTURE OF AF2198, A JAB1/MPN DOMAIN PROTEIN FROM ARCHAEOGLOBUS FULGIDUS (англ.).