Описание области контакта белка и лиганда ZnPO4- в структуре 3HQ2
Лиганды в структуре 3HQ2
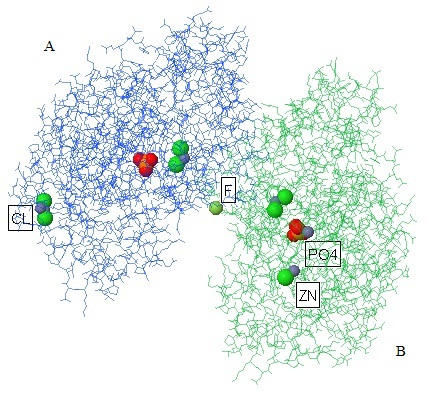 |
Рис.1. Лиганды в составе белка 3HQ2.
Цепь А - синий цвет, цепь В - зеленый цвет.
Zn - сине-голубые, F- - светло-зеленый,
Cl - зеленые, P+5 - оранжевые, O - красный. |
Белок состоит из двух цепей, каждая из которых содержит по 494 аминокислот.
Эти цепи имеют сходную вторичную и третичную структуру, возможно, белок является гомодимером.
В белке довольно много лигандов-кофакторов (в общей сложности 7 лигандов). Однако их набор ограничивается
пятью типами лигандов: это 1 частица Zn
2Cl
2, 2 молекулы ZnCl
2,
1 ион ZnCl
-, 2 иона ZnPO
4- и 1 ион F
-.
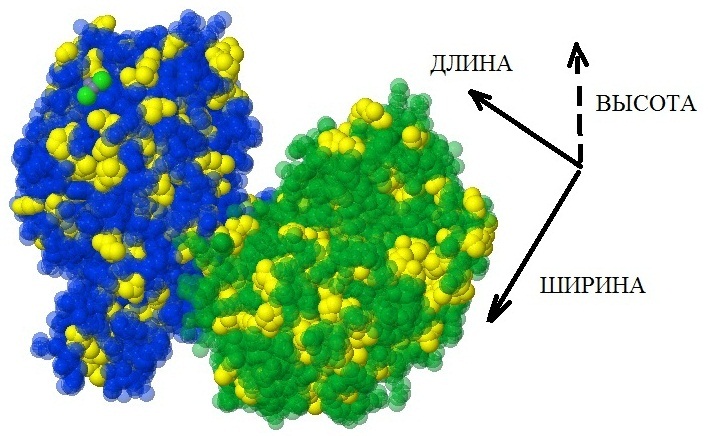
Субъединицы белка взаимодействуют друг с другом, по-видимому, из-за Ван-дер-Ваальсовых сил. В месте контакта
субъединиц не наблюдалось большее сосредоточение гидрофобных аминокислот (рис.2). Приблизительно такм же находится ион F
-.
Быть может, он играет какую-нибудь функцию при "слипании" мономеров. Место контакта субъединиц довольно узкое - около 2,67нм в длину и окло 2,3нм в ширину.
Между субъединицами пролегает глубокая щель, в которой располагается ион F
-. Возможно, она играет не последнюю роль в катализе.
Размеры белка (длина, ширина и высота - условные названия), а так же отдельных субъединиц приведены в таблице 1.
Неравенство значений одного параметра у разных цепей объясняетcя разной ориетацией цепей в плоскости измерения.
| Параметр |
Белок |
Цепь А |
Цепь В |
| Длина |
9,519нм
95,19Å
9,519*10-9м |
5,425нм
54,25Å
5,425*10-9м |
4,589нм
45,89Å
4,589*10-9м |
| Ширина |
7,875нм
78,75Å
7,875*10-9м |
7,774нм
77,74Å
7,774*10-9м |
7,875нм
78,75Å
7,875*10-9м |
| Высота |
5,762нм
56,72Å
5,762*10-9м |
5,762нм
56,72Å
5,762*10-9м |
5,351нм
53,51Å
5,351*10-9м |
|
 |
| Таблица 1. Размеры белка и субъединиц |
Рис.2. Гидрофобные амнокислоты белка 3HQ2.
Цепь А - синий цвет, цепь В - зеленый цвет.
Гидрофобные аминокислоты - желтые. |
В таблице 2 приведены размеры кофакторов белка. Кофакторы - это небольшие неорганические молекулы, и неудивительно, что
их размер относительно размера белка ничтожен. Тем не менее, функциональной активностью белок без кофакторов
в подавляяющем большинстве случаев не обладает.
| Размер лигандов |
| Zn2Cl2: |
0,427нм |
4,27Å |
4,27*10-10м |
| ZnCl- |
0,245нм |
2,45Å |
0,245*10-10м |
| ZnCl2: |
0,401нм |
4,01Å |
4,01*10-10м |
| ZnPO4-: |
0,412нм |
4,12Å |
4,12*10м-10
|
| F--: |
0,071нм |
0,71Å |
71*10-12м |
|
| Таблица 2. Размеры лигандов белка |
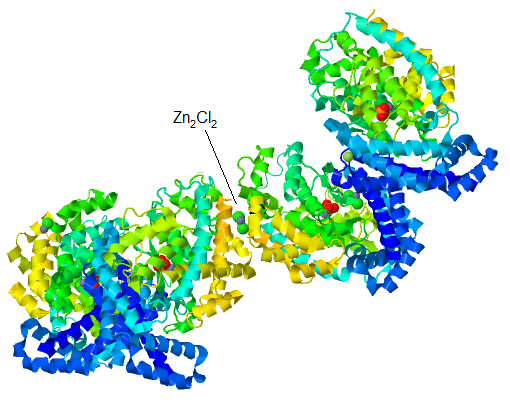 |
| Рис.3.Взаимодействие двух белков-димеров |
Это связано с их особой ролью в белке. Одни лиганды входят непосредственно в активный центр фермента и каким-либо образом
координирую субстрат во время реакции, другие играют роль алостерических реуляторов, третьи облегчают связывание субстрата
в полисубъединичном белке, изменяя конформацию одного мономера (коопреативный механизм). Это далеко не все типы взаимодействия
между лигандом и белком.
Что интересно, один из лигандов белка расположен вне него. На самом деле он находится между двумя такими белками,
то есть в клетке функционирует не димер, а тетрамер (рис.3). Возможно, такая оранизация облегчает его активность - например,
если механизм действия аналогичен механизму связывания кислорода гемоглобином. Однако есть и другое объяснение
этому факту. Карбоксипептидаза отщепляет от субстрата-белка по одной аминокислоте, причем действует она с C-конца.
Скорость деградации белка, очевидно, увеличивается, если две карбоксипептидазы, находящиеся рядом, будут работать вместе.
Анализ области контакта белка из структуры PDB 3HQ2 и лиганда ZnPO4-
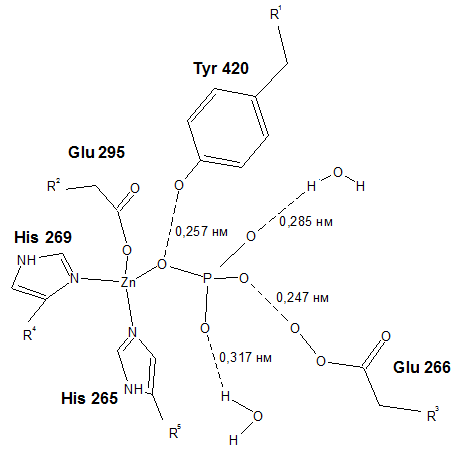
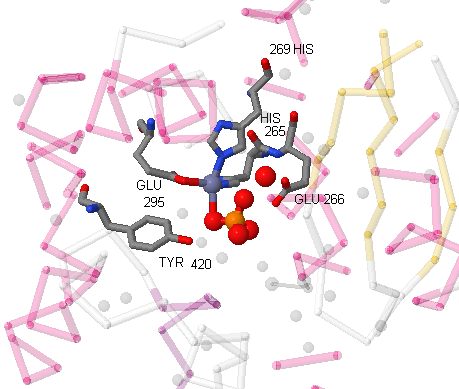
Выбранный для анализа лиганд расположен в цепи А. Его окружают как α-спирали, так и β-тяжи.
Это лиганд через Zn ковалентно связан с белком, а именно с остатками гистидина и глутамата (Glu 295, His 269 и His 265).
Кроме того, нековалентными связи лиганд образует с тирозином (Tyr 420), глутаматом (Glu 266) и двумя молекулами воды.
На рисунках 4 и 5 окружение лиганда отображено схемой и в виде картинки, полученной в JMol.
|
|
Рис.4. Область контакта ZnPO4- с белком (схема). |
Рис.5. Область контакта ZnPO4- с белком (картинка из JMol).
Желтым цветом обозначены бета-тяжи, малиновым - альфа-спирали, белым - неструктурированные элементы. Контактирующие остатки выделены wireframe и cpk. |
Все избражения были получены с помощью
этого скрипта.
Проект генно-инженерного эксперимента с белком из структуры 3HQ2
Потеря ферментом карбоксипептидазной активности может быть обусловлена потерей сродства белка к одному из лигандов.
Кофактор, рассматривающийся в предыдущем разделе,безусловно, весьма важен для фермента. Это подтвержает и эпитет фермента,
фигурирующий в названии белка - металл-завсимая карбоксипептидаза. Для того, чтобы кофермент перестал связываться
с белком, стоит лишь заменть аминокислоты, участвующие в координации лиганда.
Гистидины и глутамат, ковалентно связанные с цинком, нужно заменить на остатки аминокислот, радикалы которых
существенно отличаются о них. Для глутамата - это любой аминокислотный остаток, не имеющий свободной OH группы.
Им может быть триптофан, аланин, лизин... Если же заменить глутамат на аспартат, скорее всего, связь будет
образовываться, хотя и не такая прочная, что связано с разной длиной радикала.
Гистидины связываются с цинком через азот, находящийся в положительно заряженном кольце (хотя заряд, наверное, роли не играет).
Думается, потенциальных заменителей у гистидина нет - любая замена будет приводить к потере сродства к лиганду.
Что касается удаления водородной связи, образованной между тирозином и кислородом, его можно добиться, если заменить
тирозин на любую алифатическую аминокислоту, триптофан или фенилаланин. Для того, чтобы замена тирозина не приводила к существенной потере
сродства белка к лиганду, нужно использовать аминокислоты с полярным радикалом, способные быть донором водорода (например, цистеин). Однако проблема усложняется
довольно крупными размерами адикала у тирозина, так что, скорее всего, длина водородной связи при замене увеличится.
© Elizaveta Besedina, FBB 2012
lizaveta@kodomo.fbb.msu.ru





