| Идентификатор PDB |
3HQ2 |
| Название белка |
Металл-зависимая карбоксипептидаза
(Metal-dependent carboxypeptidase) |
| Количество цепей |
2: цепь А и цепь B |
| Лиганды (частицы) |
1 частица Zn2Cl2
2 молекулы ZnCl2
1 ион ZnCl-
2 иона ZnPO42-
1 ион F- |
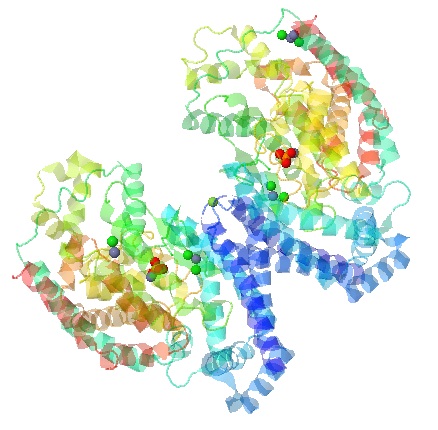
На рисунке 1 представлена структура белка с лигандами. В силу того, что их достаточно много
(в общей сложности 7 штук), лучше всего их видно при полупрозрачном цвете самого белка. Мономеры белка покрашены
от синего к красному (от N-конца к С-концу).
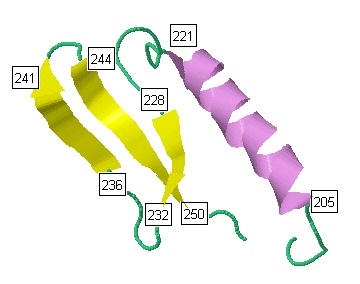
Для анализа я выбрала последовательность белка с 205 по 250 аминокислотный остаток из цепи А,
включающую как β-тяжи, так и α-спирали (рис.2).
На данном участке есть одна альфа-спираль с 205 по 221 аминокислотный остаток,
и три бета-тяжа (228-232, 236-241, 244-250 а.к. остатки).
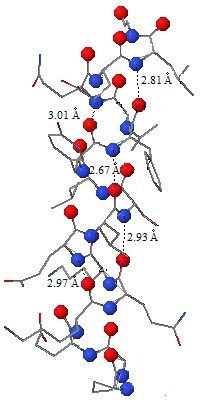
Длина водородной связи в среднем составляет 2,88Å,
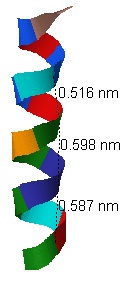
разброс в пределах от 2, 67Å до 3,01Å (рис.3). Шаг спирали - приблизительно 0,57 нм, что равно 5,7Å.
Среднее число аминокислотных остатков - 3,7 на виток (рис.4),
на 3 витка спирали приходится около 11 аминокислотных остатков (покрашены в разные цвета). Таким образом,
остаток с номером n в середине спирали образует водородные связи с n+4 и n-4 аминокислотным остатком.
β-лист представлен тремя β-тяжами, два из которых параллельны между собой и антипараллельны
третьему β-тяжу. Тяжи антипараллельны, если N-конец одного тяжа образует водородные связи с C-концом
другого, и наоборот. Соответственно, тяжи параллельны, если N-конец одного образует водородные связи
с N-концом другого тяжа, и аналогично с C-концами.
Лист образует слегка(из-за малого количества тяжей)
выгнутую поверхность, которая представлена на рисунке 5.
 |
 |
 |
Рис.3. Альфа-спираль (205-221 а.к.):
водородные связи |
Рис.4. Альфа-спираль (205-221 а.к.):
шаг спирали и количество остатков на виток |
Рис.5. Бета-лист (228-250 а.к.): структура, вид с разных ракурсов |
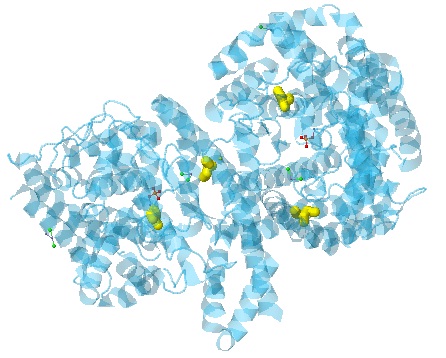
В белке есть 4 цистеина, однако они находятся на далеком друг от друга расстоянии и
дисульфидных мостиков не образуют. На рисунке 6 цистеины в составе белка покрашены желтым цветом,
расстояние между ними не менее 2,67 нм (измерения не приведены, чтобы не загромождать рисунок).
Для образования солевых мостиков необходимо взаимодействие отрицательно
заряженных радикалов с положительно заряженными. Таким условиям удовлетворяют различные попарные комбинации из Asp, Glu и
Lys, Arg и His.
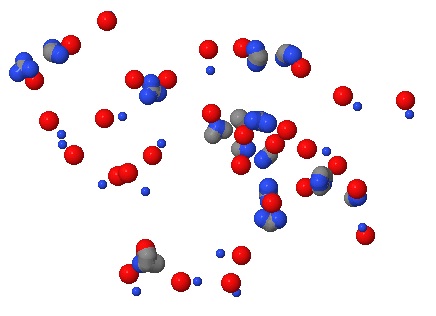
На рисунке 8 изображены атомы положительно и отрицательно заряженных аминокислот, находящиеся на расстоянии
не более 4Å таких атомов - 96 штук. Однако среди этих атомов тщательный просмотр показывает лишь 33 истинных
солевых мостика. Что интересно, большинство солевых мостиков образуются между аминокислотами, отдаленными друг от друга
лишь на 2-3 остатка. Атомы покрашены в соответствии с химической природой: углерод серый,азот синий, кислород красный.
Для просмотра команды наведите мышку.
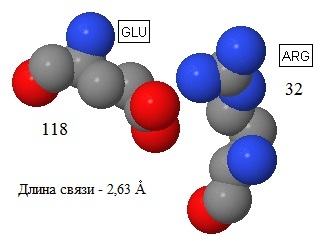
Детали образoвания солевого мостика можно увидеть на рисунке 9. Атомы покрашены в соответствии с их химической природой.
Карбоксильная группа остатка Glu118 притягивается к гуанидиновой группе остатка Arg32, длина связи 2,63Å.