Сравнение белка с ортологами
Командой еntret (синтаксис аналогичен команде infoseq), а также с помощью сайта www.uniprot.org мы получили информацию о белке YPWA (Bacillus subtilis) и трех его ортологах (Bacillus licheniformis и Bacillus amyloliquefaciens) в виде .txt файлов. Кроме того, два ортолога белка YPWA между собой - паралоги, то есть образовались при дупликации гена, но находящиеся в одном организме. Эти паралоги расположены в одном организме - Bacillus licheniformis. Паралогами являются белки Q62TN6 и Q65I85. Все исследуемые белки - продукты одного гена ypwa. Родство белков отражено на рисунке 1. Видно, что белок YPWA более родственен с белком A7Z5W3, а паралоги Q62TN6 и Q65I85 лишь недавно разошлись. Это очевидным образом вытекает из относительной длины жизни белков, а также из расположения ортологов Q62TN6 и Q65I85 внутри одного организма Bacillus licheniformis. |
| Рис.1. Родство изучаемых ортологов |
Кроме того, на рисунке 2 представлена схожесть последовательностей белков. Темно-серым цветом выделены одинаковые аминокислоты, светлосерым - сходные. Красным цветом отмечена аминокислота активного центра - глутаминовая кислота. Голубой цвет - это аминокислоты, связывающиеся с лигандами. Это хорошо согласуется с данными PDB (см. первый семестр). Кроме того, для семейства М32-пептидаз характерен консервативный участок HEXXH, координирующий субстрат.
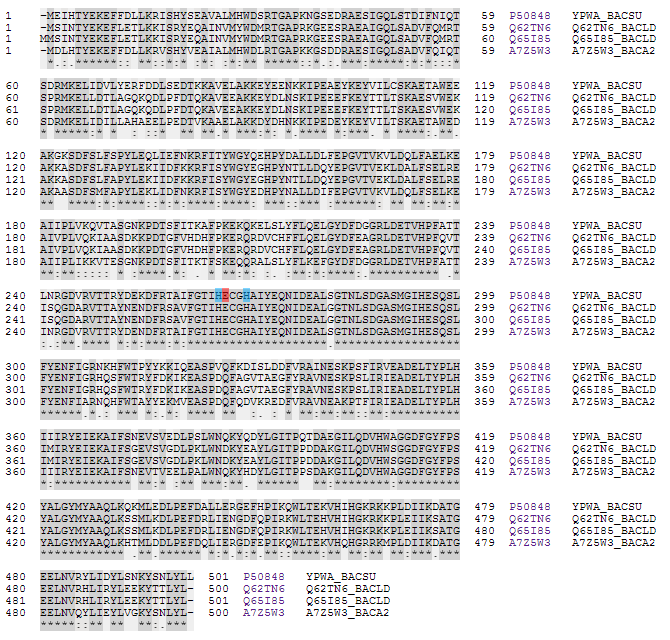 |
| Рис.2. Схожесть изучаемых ортологов |
Из-за высокой схожести ортологов логично предположить, что их вторичная и, возможно, третичная структура очень сходны. Характер связывания лигандов, очевидно, также не изменится, тем более что аминокислоты активного центра и ближайшего окружения у ортологов одинаковы. Функции белков тоже одинаковы. Отличие наблюдается в деталях последовательности пептида. Нет сигнальной последовательности.
Сводную таблицу по ортологам можно увидеть здесь.
Ответы на вопросы:
- Какие аминокислотные остатки Вы бы стали модифицировать, чтобы изменить характер связывания металла с белком?
В первую очередь стоило бы изменить лиганд-связанные аминокислоты - например, можно заменить гистидины 265 и 269 на противоположные по знаку аминокислоты (аспартат). - Какие аминокислотные остатки участвуют в образовании активного центра? (перечислите №№ позиций и полные названия)
По данным Uniprot - это 266 аминокилота, глутаминовая кислота, E266. - Какие ионы связываются с белком?
По данным БД PDB, это 1 частица Zn2Cl2, 2 молекулы ZnCl2, 1 ион ZnCl-, 2 иона ZnPO4- и 1 ион F- (см. первый семестр) - Какие участки белка (напишите номера аминокислотных остатков) участвуют в связывании лиганда? Какого?
В связывании одного из лигандов (2 иона ZnPO4-) принимают участие Tyr420, Glu295, His265, Glu266, His 269. - Предложите мутацию, которая, на Ваш взгляд, сильно повлияет на активность белка. Ответ требует краткого обоснования
Так как участок, включающий в себя активный сайт и лиганд-связанные аминокислоты, очень важен для функционирования белка и отмечается для семейства М32-пептидаз как высококонсервативный (HEXXH) (ссылка), то полное удаление этого участка или замена его на аминокислоты с непохожими свойствами (напимер, неполярные), очень сильно повлияет на активность белка. Скорее всего, она будет утрачена.
Поиск ортологов на сайте www.uniprot.org
Поиск ортологов белка YPWA_BACSU (YPWA AND Bacillus) привел к следующим результатам: 1 аннотированный белок из БД Swiss-Prot (собственно YPWA_BACSU) и 21 неаннотированных белка из БД TrEMBL. Неаннотированные белки получают с помощью автоматической трансляции последовательнотей геномов, поэтому их существование не подтверждено экспериментально. Соответственно, БД Swiss-Prot проверяется людьми, поэтому предполагаемые, предсказанные белки туда не попадают.
Оперонная организация гена YpwA
Оперон - это структурная и функциональная единица организации генома прокариот. Гены в опероне часто находятся под одним общим промотором, что позволяет быстро и эффективно отвечать на изменеия внешней среды.Ген синтеза метал-зависимой протеиназы (ypwA) находится в опероне один. Расстояние между генами соседних оперонов порядка 150bp. Направление транскрипции - "-", синтез идет по так называемой комплементарной цепи (одна из цепей условно берется основной, другая полагается комплементарной).
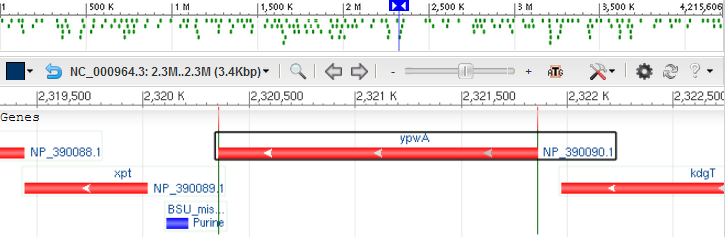 |
| Рис. 3. Оперон, содержащий ген YpwA. Стрелки показывают направление транскрипции гена. |