Особенности трансмембранных белков
Трансмембранные белки связываются с мембраной за счет альфа-спиралей (единичной или нескольких) или бета-складчатой структуры. Соответственно, белки могут образовывать баррель из бета-листов или спиральну укладку. Белки разной укладки различаются некоторыми характеристика. Проследим это на примере случайно выбранных шести белков, 3 из которых являются спиральными, а три - баррелями.Таблица 1. Описание трансмембранных белков с известной 3D структурой
| PDB код | Тип (спираль, баррель) |
Какая мембрана (внутренняя или внешняя, организм, органелла) |
Толщина гидрофобной части мембраны в ангстремах | Медиана числа остатков в одном трансмембранном участке |
| 2qi9 | Спираль | Внутренняя мембрана Грамм-отрицательный бактерий Escherichia coli |
29.4 ± 0.9 | 17 |
| 1vry | Спираль | Плазмалемма эукариот Homo sapiens |
23.2 ± 3.7 | 23 |
| 4nv2 | Спираль | Внутренняя мембрана Грамм-отрицательный бактерий Synechococcus sp |
29.6 ± 2.0 | 22,5 |
| 2wjr | Баррель | Внешняя мембрана Грамм-отрицательный бактерий Escherichia coli |
23.3 ± 1.5 | 12,3 |
| 4bum | Баррель | Внешняя мембрана митохондрий Danio rerio |
23.4 ± 0.9 | 7,5 |
| 2gsk | Баррель | Внешняя мембрана Грамм-отрицательный бактерий Escherichia coli |
23.4 ± 0.7 | 9,2 |
Средняя толщина гидрофобной части мембраны и, соответственно, число остатков в белке, находящихся в трансмембранной части белка, меньше у баррелей. Это можно объяснить тем, что альфа-спираль формируется только в том, случае, если есть достаточное количество аминокислотных остатков, чтобы стабилизировать спиральную структуру водородными связями, тогда как для бета-тяжей много остатков не нужно.
Отбор гомологов
Для составления репрезентативной выборки ортологов белка P0AGF4 (D-xylose-proton symporter xylE, conformation 1, PDB 4gc0) использовали blastp со следующими параметрами:- Количество хитов - 1000
- E-value 1e-6
Анализ структуры белка P0AGF4
Белок локализуется во внутренней мембране Грам-отрицательных бактерий, относится к семейству беклов-переносчиков сахаров.Таблица 2. Описание структуры трансмембранного белка P0AGF4 (идентификатор PDB 4gc0, цепь A) ,
| PDB ID | Организм | Тип мембраны | TC-код | Угол наклона спиралей (β-тяжей) к нормали | Количество трансмембранных спиралей (β-тяжей в бочонке) |
| 4gc0 | Escherichia coli | Внутренняя мембрана Грамм-отрицательный бактерий | 2.A.1.1 | 1 ± 0° | 12 |
TCDB ID:
2.A.1 - Основное семейство белков-посредников (MFS);
2.A.1.1: Семейство транспортеров сахаров.
Анализ множественного выравнивания трансмембранных белков
Было построено выравнивание найденных ортологов с белком; затем, ориентируюясь на данные PDBTM, была создана строка TM_REAL, в которой буквы М соответствуют трансмембранным участкам альфа-спиралей белка P0AGF4. Для ортолога YP_002309189.1 из Candidatus Azobacteroides pseudotrichonymphae genomovar. с помощью программы TMHMM была проведена аналогичная процедура, предсказанные трансмембранные участки записывались в TM_PREDICTED. Окраска: желтым цветом - гидрофобные аминокислоты; бирюзовым - гидрофильные. Интенсивность окраски зависит от консервативности (порог 15%).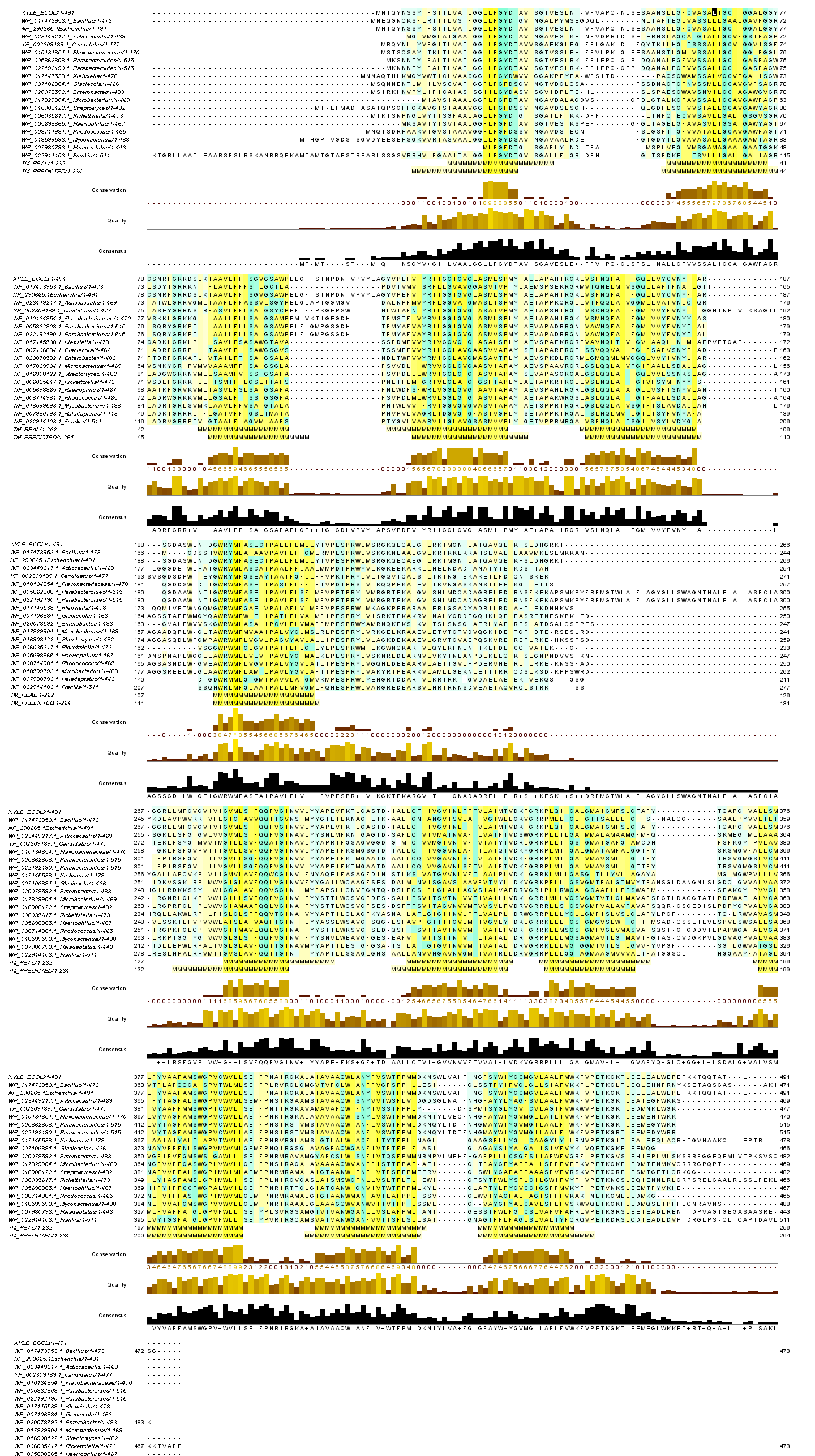 |
| Рис.1. Множественное выравнивание ортологов белка P0AGF4. Для увеличения кликните на картинку |
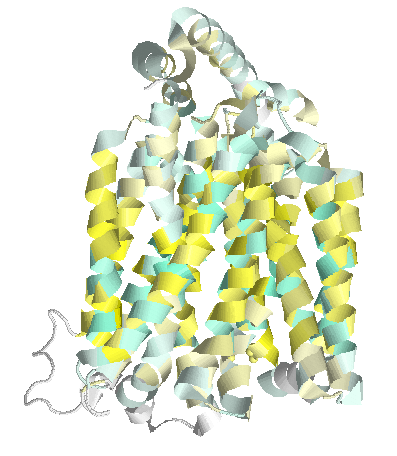 |
| Рис.2. Модель белка P0AGF4, окрашенная в соответствии в выравниванием.
Часть, ориентированная в n-сторону мембраны - сверху, а ориентированная в p-сторону - снизу. |
Анализируя полученные изоражения, нельзя не заметить, что области настоящих и предполагаемых трансмембранных участков не только совпадают между собой, но и соответствуют наиболее консервативным участкам выравнивания. Короме того, в данных участках преобладает желтый цвет, что свидетельствут о гидрофобности аминокислот этих участков, что неудивительно. Наиболее распространены такие аминокислоты, как лейцин, изолейцин, валин и метионин.
С другой стороны, в этих участках встречаются также и не гидрофобные аминокислоты. Как можно видеть на рисунке 2, большей частью они ориентированы внутрь белковой молекулы и не контактируют с липидным бислоем. Возможно, консервативность этих аминокислот объясняется тем, что изучаемый белок является протонным симпортером D-ксилозы. Соответственно, внутри него просто необходим канал, "выстланный" гидрофильными полярными и заряженными аминокислотами, внутри которого могут проходить протоны и ксилоза.
Участки между трансмембранными спиралями не столь консервативны, как сами спирали, что хорошо видно на выравнивании.
© Elizaveta Besedina, FBB 2012
lizaveta@kodomo.fbb.msu.ru