1OCA и 1W8L
Для анализа я выбрала структуры циклофилина А. Структура 1W8L, выполненная РСА, обладает хорошим разрешением - 1.8. Для структуры 1OCA, рарешенной из ЯМР эксперимента, есть 20 моделей (рис. 1). Длина белка - 165 а.о., представлен единственной цепью А.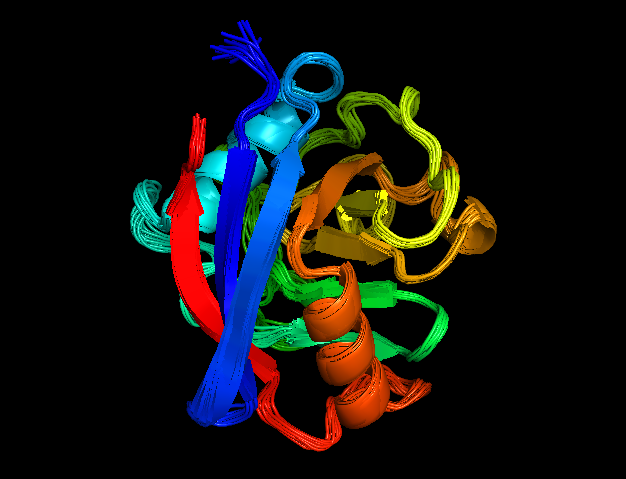 | 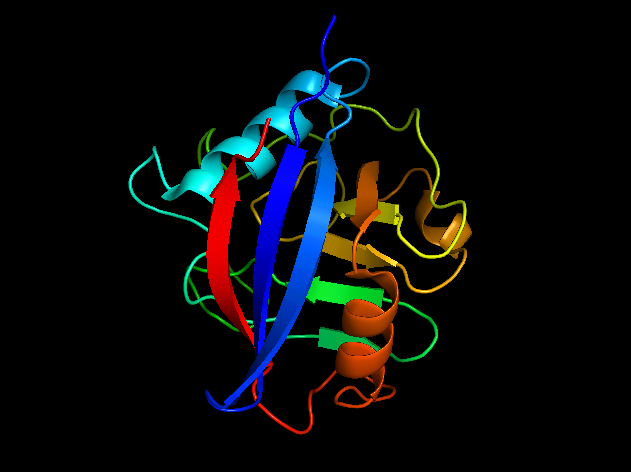 |
| Рис. 1. Структура 1OCA, полученная с помощью ЯМР | Рис. 2. Структура 1W8L, полученная с помощью РСА |
Все модели в структуре, полученная методом ЯМР, сильно схожи между собой. Лабильны только концы молекул. Структуры так же отлично накладываются друг на друга (рис. 3)
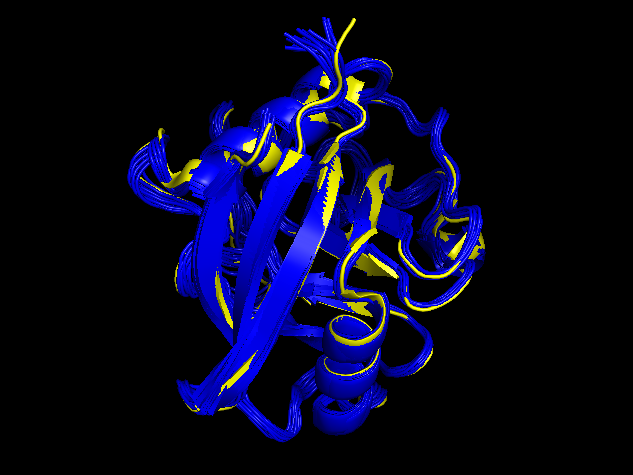 |
| Рис. 3. Наложение 1OCA (желтый цвет) и 1W8L (синий цвет) |
Анализ водородных связей
C помощью командselect R, name NH* within 3.5 of (resn GLU and name OE*)
select E, (resn GLU and name OE*) within 3.5 of name NH*
distance bond, R, E, 3.5
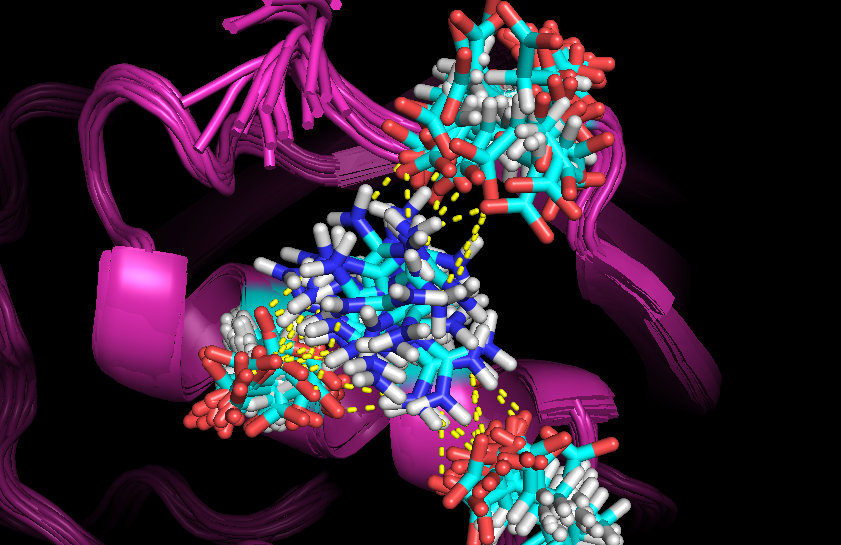 |
| Рис. 4. Водородные связи на поверхности белка в структуре 1OCA: Arg37, Glu34, Glu165 и Glu43 |
Таблица 1. Водородные связи между Arg37, Glu34, Glu165 и Glu43
| Донор-акцептор | Остаток акцептора - 165 | Остаток акцептора - 34 | Остаток акцептора - 43 |
| NH1::OE1 | 3/20 | 1/20 | 2/20 |
| NH1::OE2 | 6/20 | 6/20 | 2/20 |
| NH2::OE1 | 2/20 | 2/20 | 1/20 |
| NH2::OE2 | 3/20 | 6/20 | 3/20 |
Тем не менее, из всех возможных водородных связей между 4 остатками (таблица 1), присутствовавших в модели 1OCA, в модели 1W8L присутствовало только две: между Arg37 и Glu34, Glu43(рис. 5)
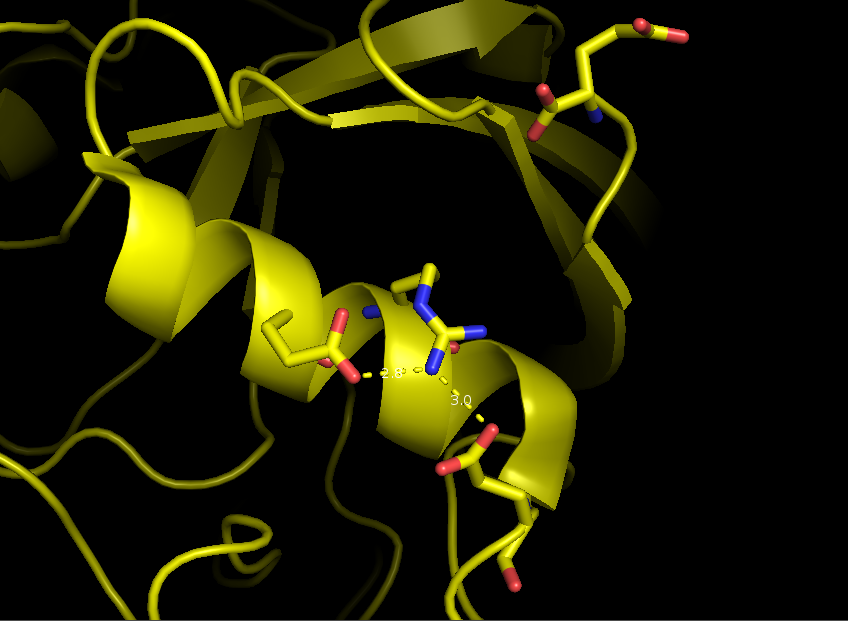 |
| Рис. 5. Водородные связи на поверхности белка в структуре 1W8L: NH2-Arg37::OE2-Glu34 и NH2-Arg37::OE2-Glu43 |
Результаты см. в таблице 2.
Так же была рассмотрена водородная связь, участвующая в образовании альфа-спирали: между NH-группой Asn35 и O-атомом Lys31 (рис. 6).
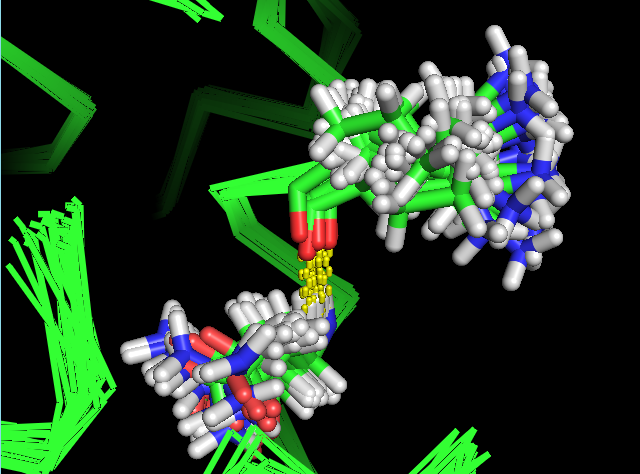 |
| Рис. 6. Остовная водородная связь в альфа-спирали: NH-Asn35::O-Lys31 |
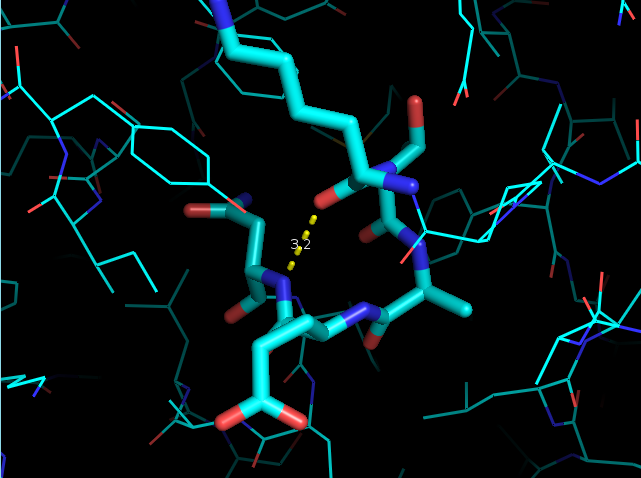 |
| Рис. 6. Остовная водородная связь в альфа-спирали: NH-Asn35::O-Lys31 |
В качестве водородной связи внутри глобулы белка была выбрана водородная связь между двуми beta-тяжами, сформированная взаимодействием NH-группы Ser99 и O-атома Phe113.
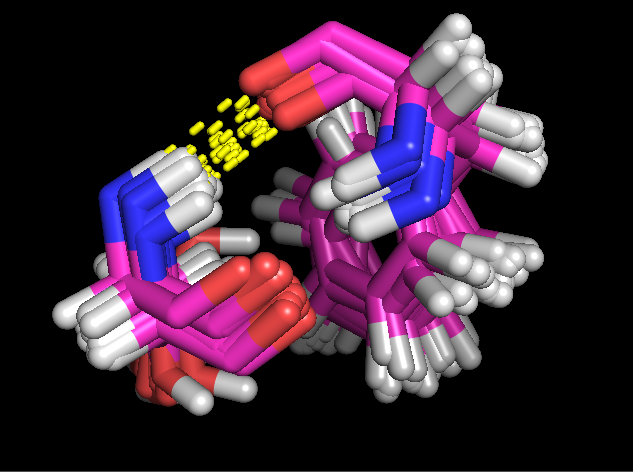 |
| Рис. 7. Водородная связь в глобуле белка: NH-Ser99::O-Phe113 |
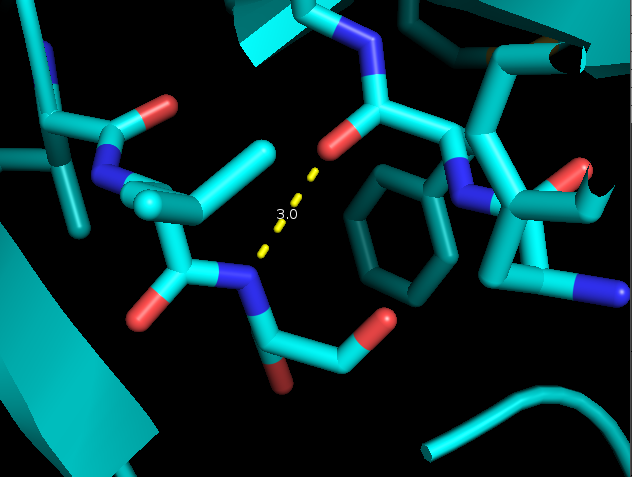 |
| Рис. 8. Водородная связь в глобуле белка: NH-Ser99::O-Phe113 |
Таблица 2. Результаты наблюдений водородных связей
| Где расположена водородная связь | Донор и акцептор электронов | Расстояние в РСА, Å | Число моделей ЯМР, в которых есть связь | Минимальное расстояние в ЯМР, Å | Максимальное расстояние в ЯМР, Å | Медианное расстояние в ЯМР, Å |
| На поверхности глобулы | NH2-Arg37 и OE2-Glu34 | 2.8 | 6/20 | 2.8 | 3.3 | 2.8 |
| Остовная водородная связь в альфа-спирали | NH-Asn35 и O-Lys31 | 3.2 | 17/20 | 2.8 | 3.2 | 3.0 |
| Водородная связь в глобуле белка между двумя бета-тяжами | NH-Ser99 и O-Phe113 | 3.0 | 20/20 | 2.9 | 3.4 | 3.0 |
Приведенные результаты свидельствуют о том, что водородные связи, приводящие к образования элементов вторичной структуры - альфа-спиралей и бета-листов - очень стабильны, и в растворе, и в кристалле. Особенно стабильны водродные связи, расположенные внутри глобулы белка - там они более защищенные. Водородные связи, расположенные на поверхности белка и в альфа-спиралях, более лабильны и могут исчезать или реорганизовываться.
Действительно, результаты, полученные Sikic et al. в статье, посвященной поиску систематических отличий между результатами расшифровки с помощью ЯМР и РСА, подтверждают, что бета-листы в целом стабильнее в растворе, чем альа-спирали (сравн.: 20 моделей из 20 имели H-связь между Ser99 и Phe113 против 17/20 для альфа-спиралей).
© Elizaveta Besedina, FBB 2012
lizaveta@kodomo.fbb.msu.ru