3. Совмещение структур 2QCX и структурных гомологов
С помощью сервиса PDBeFold были найдены 4 структурных гомолога белка 3hq2:A - 3dwc:D, 1ka4:A, 1k9x:B, 1wgz:A. Для этих белков было выполнено множественное выравнивание структур, результат которого представлен на рисунке 1.
|
| Рис. 1. Множественное выравнивание структурных гомологов 3HQ2 |
Структурное выравнивание (выровненными считаются БОЛЬШИЕ БУКВЫ)можно сравнить с выравниванием последовательностей (JalView, Muscle with default)

|
| Рис. 2. Множественное выравнивание последовательностей структурных гомологов 3HQ2 |

|
| Рис.3. Множественное выравнивание последовательностей структурных гомологов 3HQ2 |
Было выявлено несколько несоответствий между структурнм выравниванием и выравниванием последовательности (рис. 4). Большей частью эти несоответствия были найдены на границах выровненных и невыровненных структурных участках и оспаривали отношение краевых аминокислот к той или иной структуре. Это вполне соотносится с тем, что сруктурные элементы, такие как альфа-спирали и бета-листы, являются более консервативными структурами (и в последовательности, и в структуре - хотя в структуре больше), чем неструктурированные петли между ними.
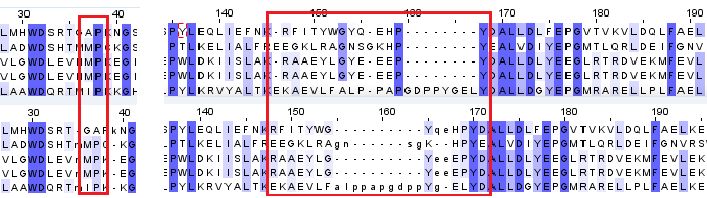
|
| Рис.4. Разные участки выравнивания: верхнее - по последовательностям, нижнее - структурное |
Мне представляется возможной следующая трактовка: гомологичны аминокислоты, определенные в выравнивании последовательностей. Однако исходно гомологичные аминокислоты стали иметь разные места роли в структуре белка, что и показывает структурное выравнивание.
Поиск структурных гомологов для домена 1dek A:33-154
При помощи сервиса PDBeFold был произведен поиск, результаты были отсортированы по RMSD. Было найдено 32 находки, среди которых исходного домена не наблюдалось. Были использованы параметры по умолчанию.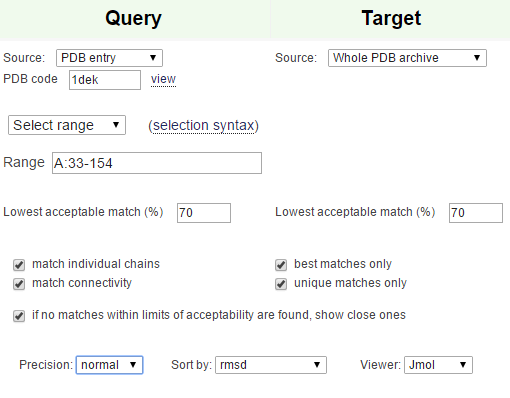
|
| Рис.5. Параметры PDBeFold при поиске гомологов |
Как видно, параметры по умолчанию требуют, чтобы процент совпадения структур был не меньше 70. То есть для мультидоменного белка, искомый домен занимает меньше 70% общей длины белка, сам белок находиться не будет. При снижении порога, например, до 40%, белок 1dek находится в первых строках.
Совмещение по заданному выравниванию
Для структуры 2f54 были сохранены участки из цепочек α (d:115-205) и β (e:113-241).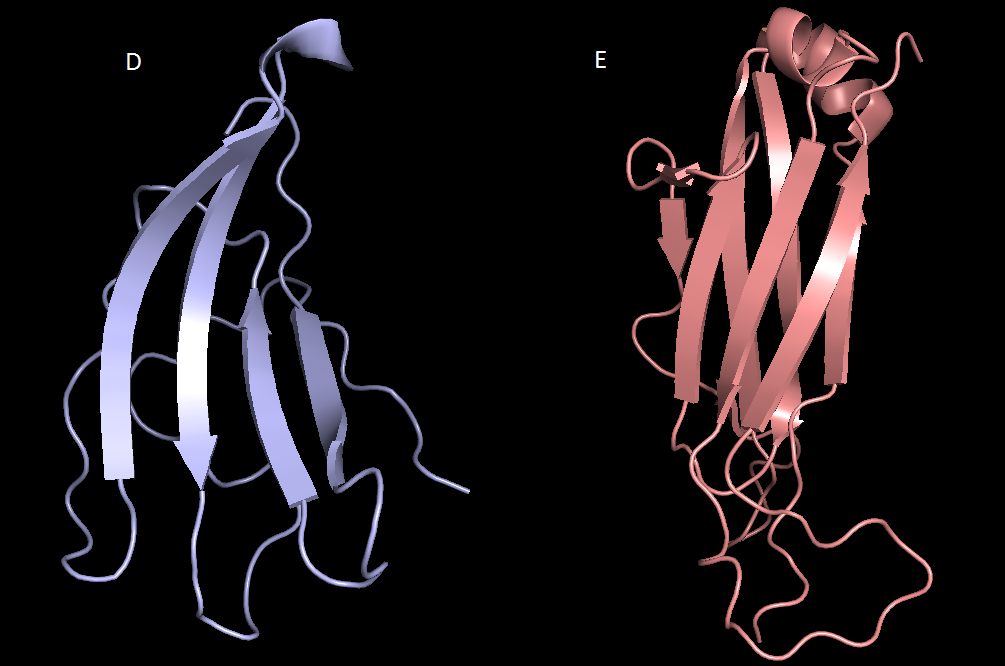
|
| Рис.6. Домены человеческого Т-клеточного рецептора из цепи α и из цепи β |
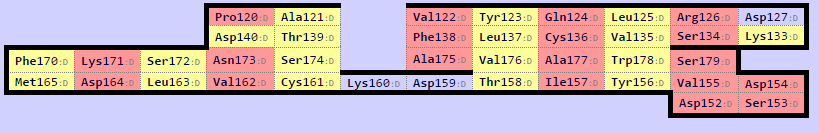
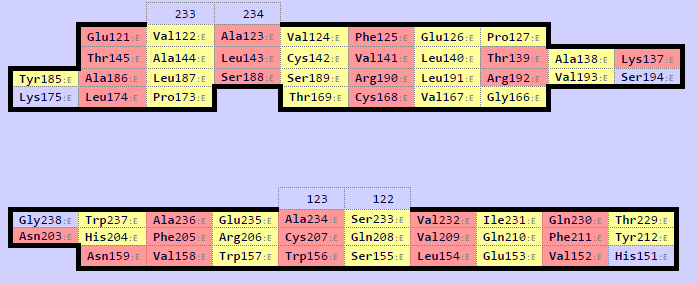
Программой SheeP были получены карты β-листов указанных доменов (рис. 7, 8)
|
| Рис.7. Домены человеческого Т-клеточного рецептора из цепи α и из цепи β |
|
| Рис.8. Домены человеческого Т-клеточного рецептора из цепи α и из цепи β |
Наблюдается соответствие между топологией тяжей β-листа цепи α и первым β-листом цепи β. Карта предствлена в одной ориентации.
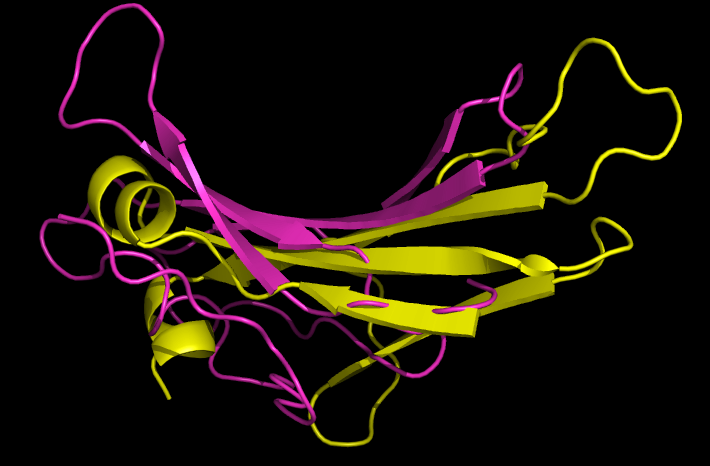
Консервативные остатки цистеина (Cys161 и Cys168) образуют дисульфидную связь. Выровняем два листа, ориентируясь на них. Их выравнивание задает выравнивание всего центрального тяжа. Для этого воспользуемся следующими командами:
select a, t_alpha and name CA and resi 160-162+172-174
select b, t_beta and name CA and resi 167-169+188-190
pair_fit a,b
|
| Рис.9. Совмещение листов цепи α и цепи β |
|
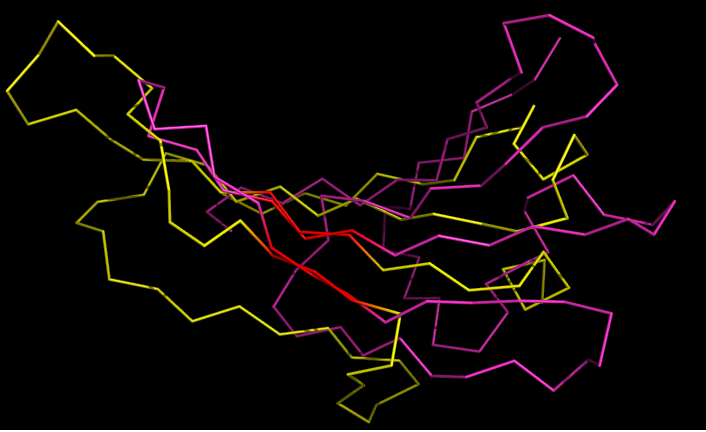
| Рис.10. Совмещение листов цепи α и цепи β: ribbon. Красным выделены остатки, по которым поизводилось выравнивание |
Исходя из приведенных данных, можно сделать заключение о том, что топология двух β-листов хорошо соблюдена: расположение и направление даже нерегулярных петель весьма сходно между листами.
© Elizaveta Besedina, FBB 2012
lizaveta@kodomo.fbb.msu.ru