Выбор белка
Был использован белок из первого семестра - YPWA_BACSU. Он удовлетворяет следующим требованиям:- Есть в базе данных PDB (ID: 3hq2)
- Этот PDB-код известен серверу EDS, то есть для него выложены экспериментальные данные.
- У белка есть структурные гомологи (находятся на сайте PDBeFold), подходящие под требования:
- 0.8 < RMSD < 3 и
- 50 % < Nalign < 90%, с учетом длины белка 501 251 < Nalign < 451

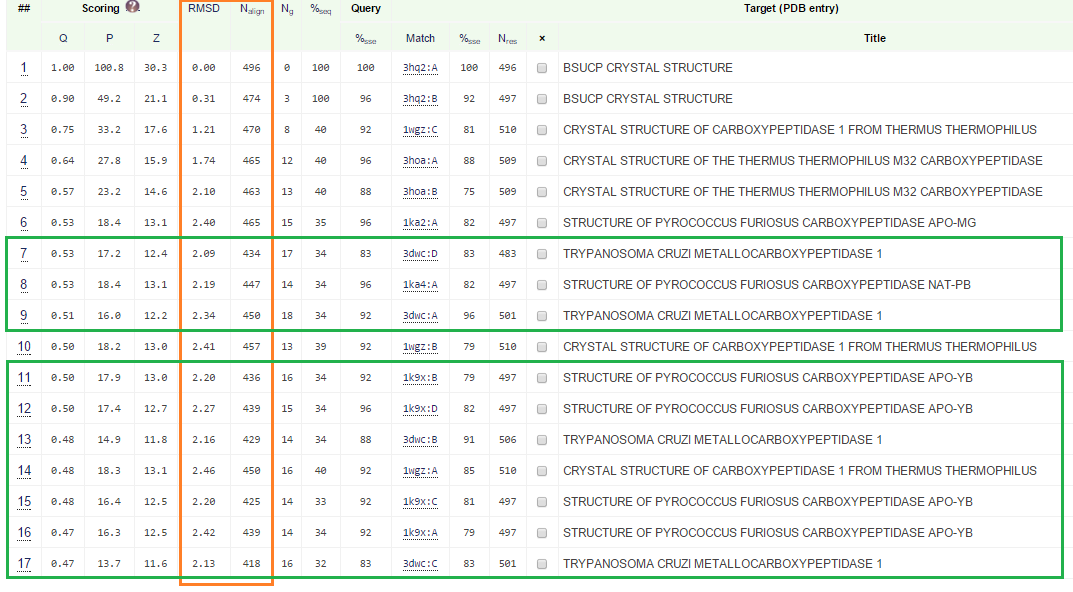
Интересующие нас колонки обведены оранжевым, подходящие гомологи (10 белков) - зеленым.
Изображение ЭП вокруг полипептидной цепи
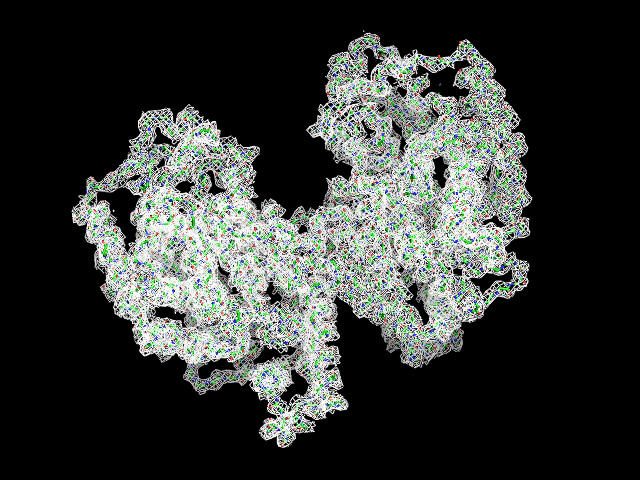
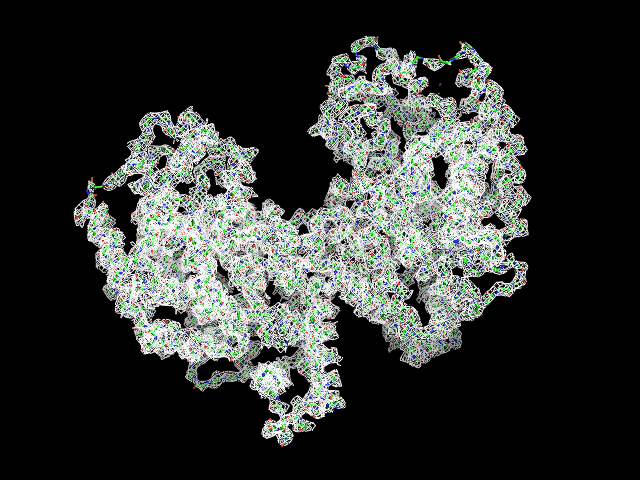
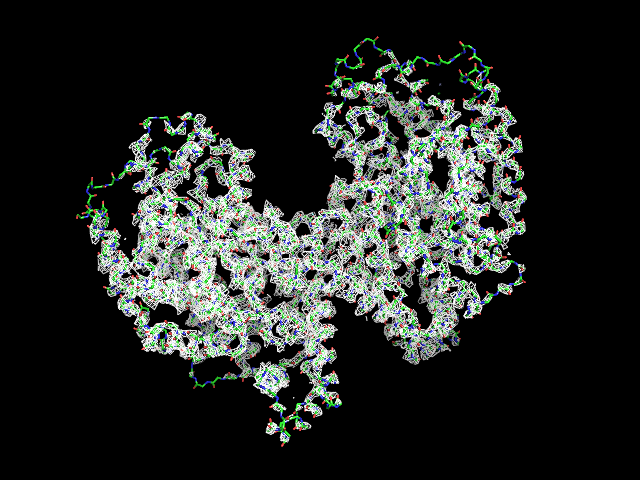
Были построены изображения ЭП вокруг остова белка при разных уровнях срезки (рис. 1) для изолиний соотвествующих 0.5, 1, 1.5, 2, 2.5 и 3 σ. |
 |
 |
| Обрезка 0.5 σ |
Обрезка 1 σ |
Обрезка 1.5 σ |
 |
 |
|
| Обрезка 2 σ |
Обрезка 2.5 σ |
Обрезка 3 σ |
load 3hq2.pdb, 3hq2
load 3hq2.omap, 3hq2_map
hide lines, all
select backbone, name c+n+o+na, backbone
show sticks, backbone
isomesh new_map, 3hq2_map, 1.5, backbone, 2.5, carve=2
remove resn hoh
ray
png 3hq2_dens_1.5
Данные факты вкупе с разрешением 2.8 Å свидетельствут о среднем качестве представленной модели белка.
Изображение ЭП вокруг аминокислотных остатков
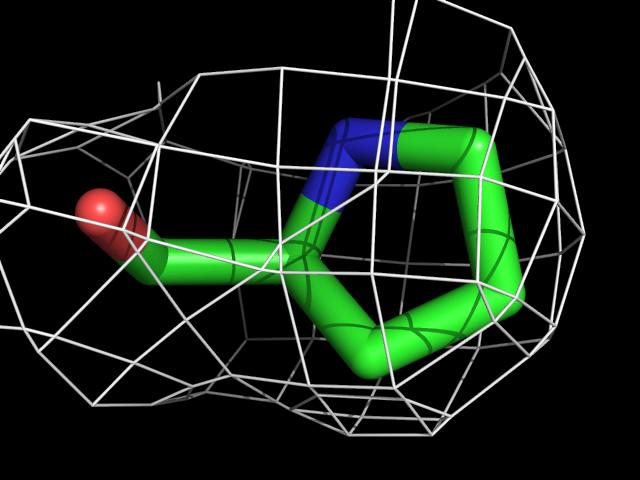
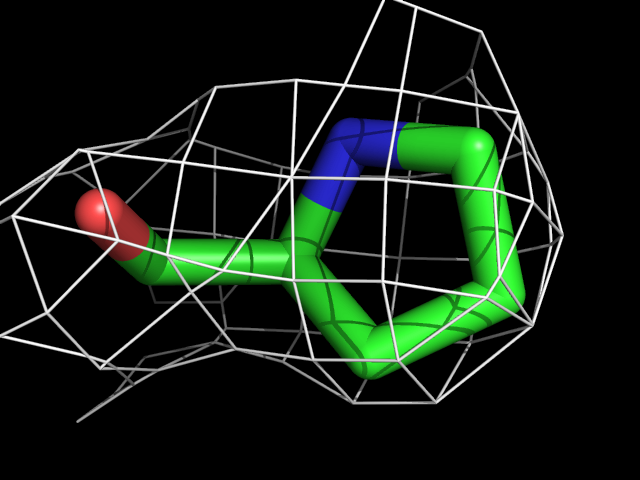
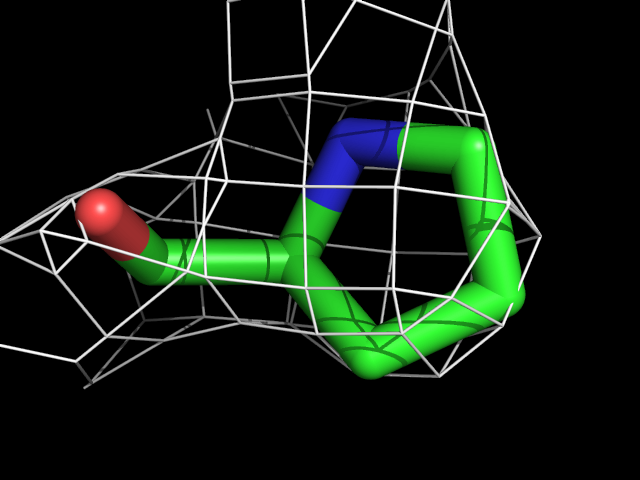
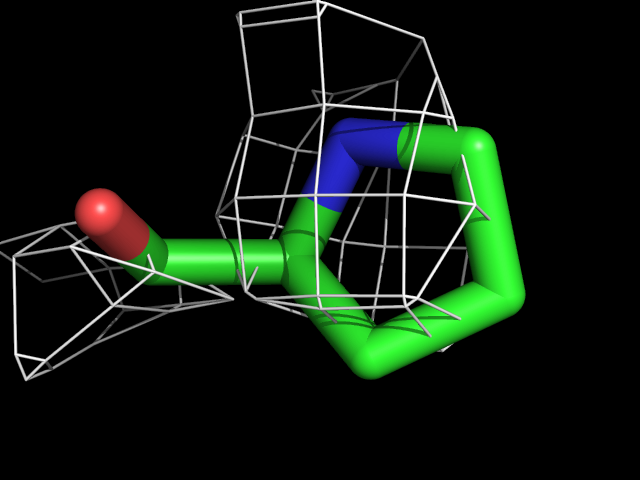
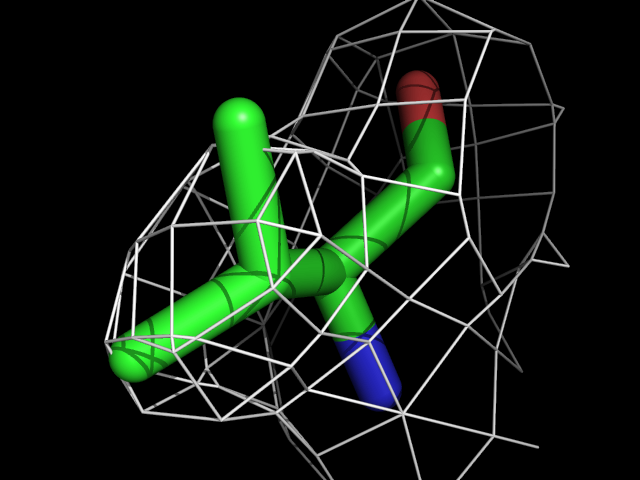
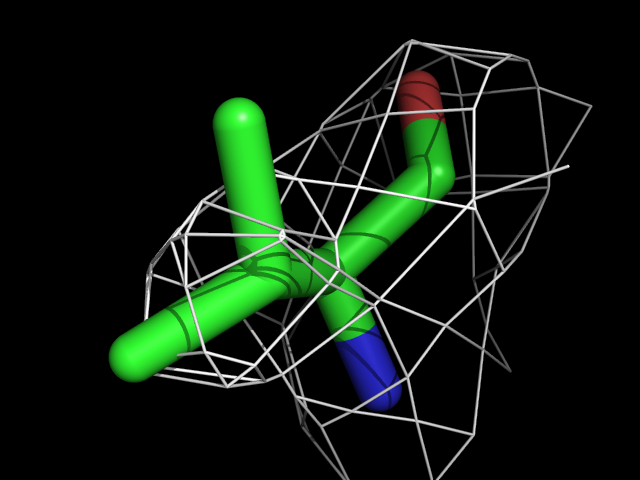
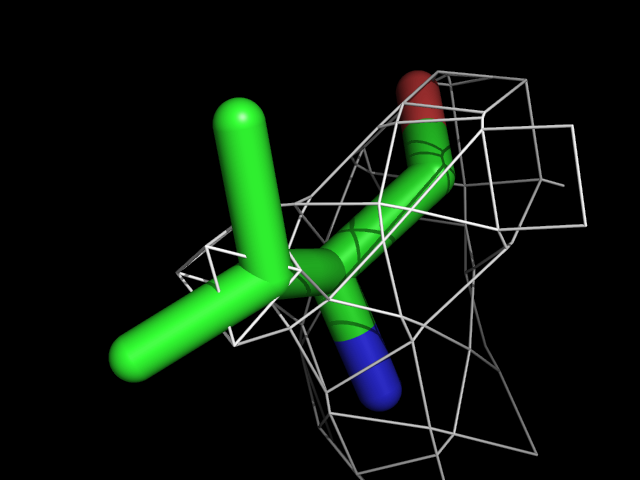
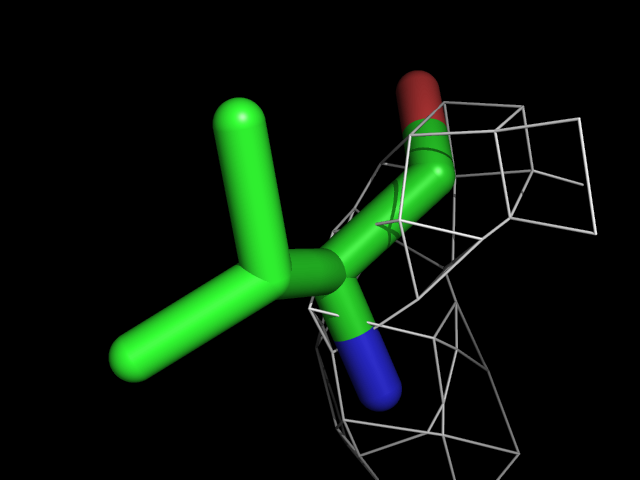
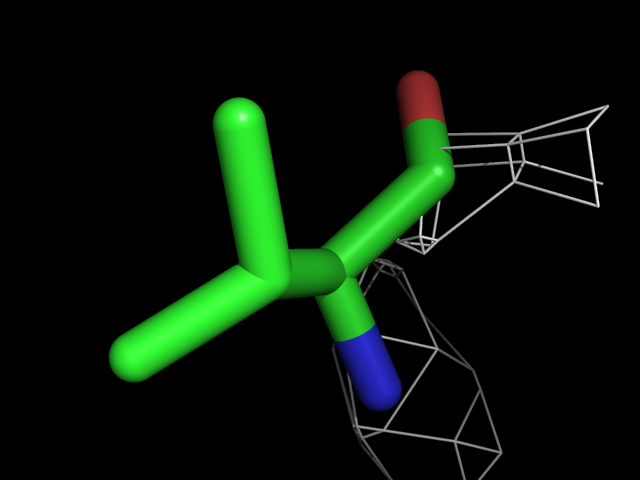
Были построены изображения электронной плотности вокруг аминокислотных остатков разного типа: валина, фенилаланина, аргинина, пролина, треонина.| Обрезка 0.5 σ |
Обрезка 1 σ |
Обрезка 1.5 σ |
Обрезка 2 σ |
Обрезка 2.5 σ |
Обрезка 3 σ |
| Pro | |||||
 |
 |
 |
 |
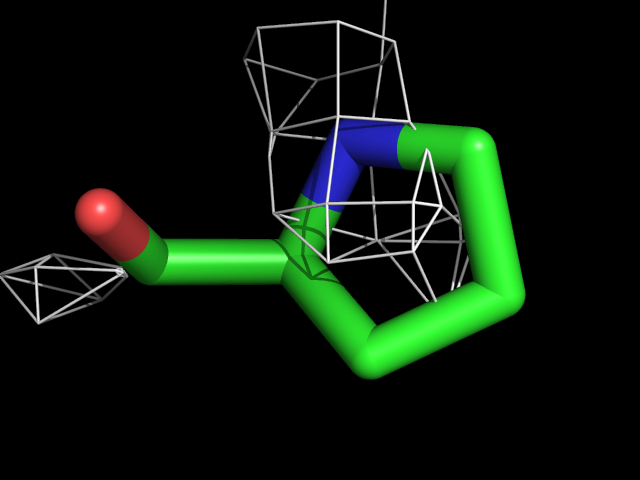 |
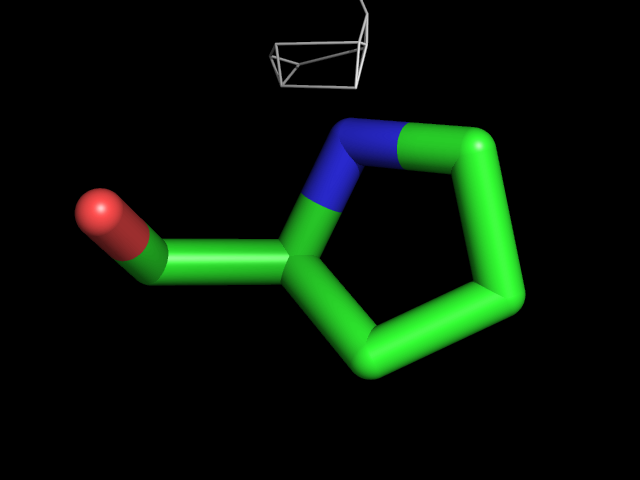 |
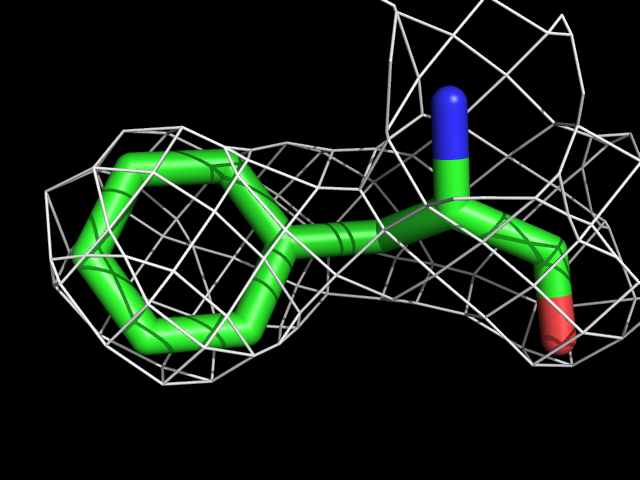
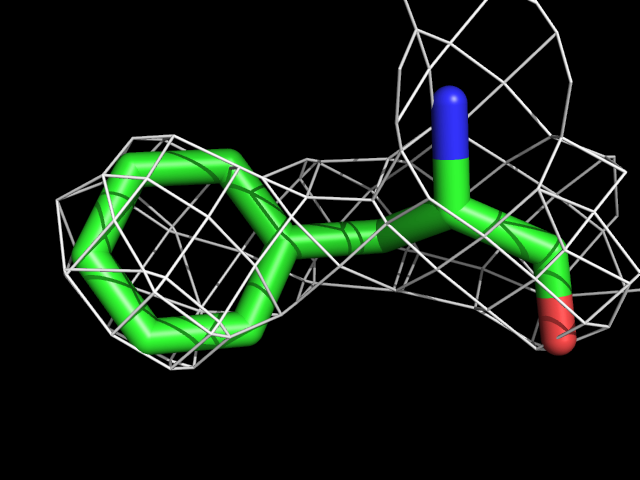
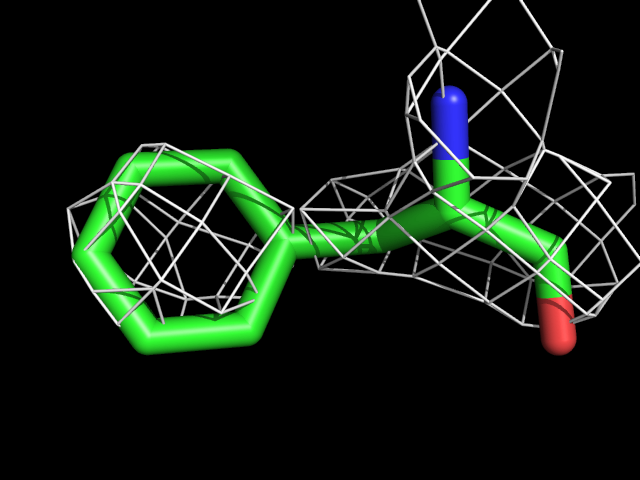
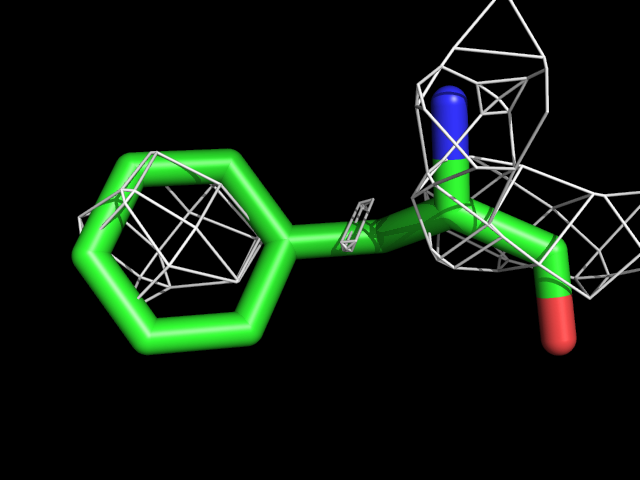
| Phe | |||||
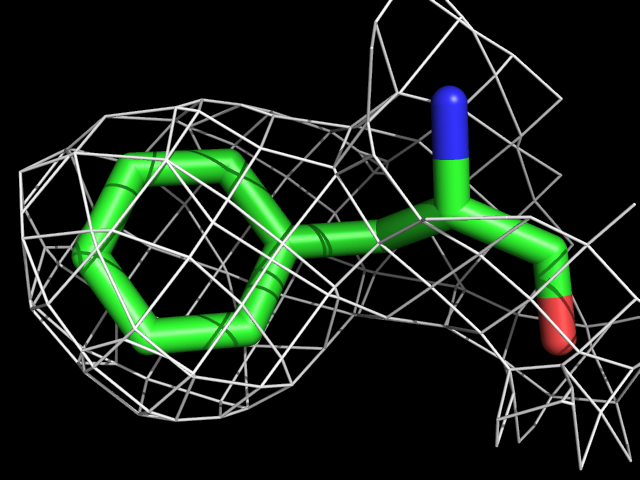 |
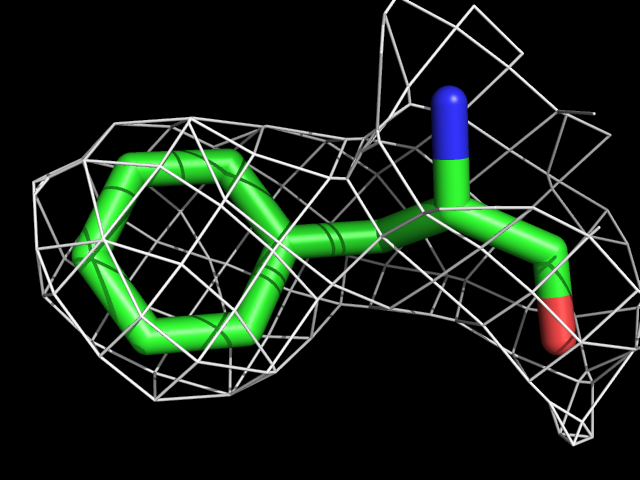 |
 |
 |
 |
 |
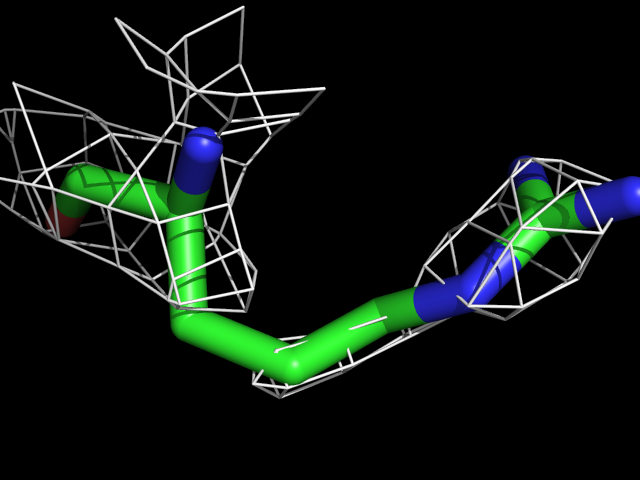
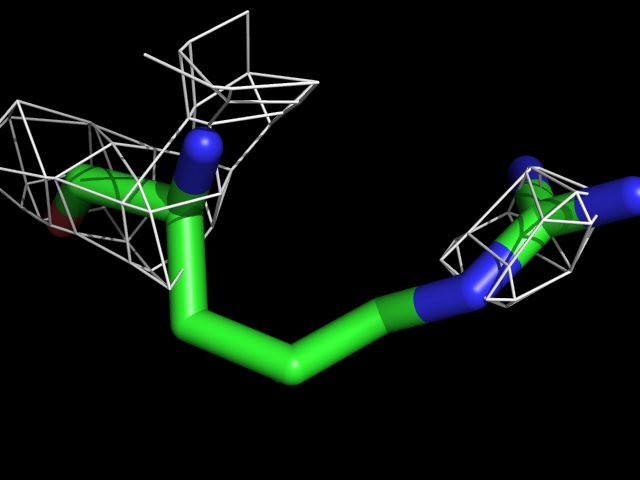
| Arg | |||||
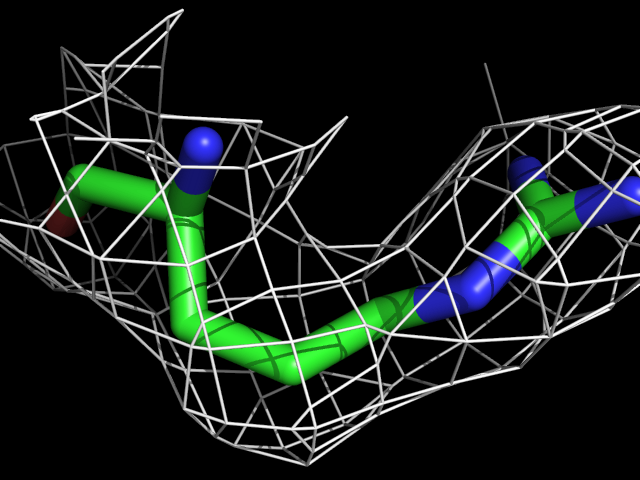 |
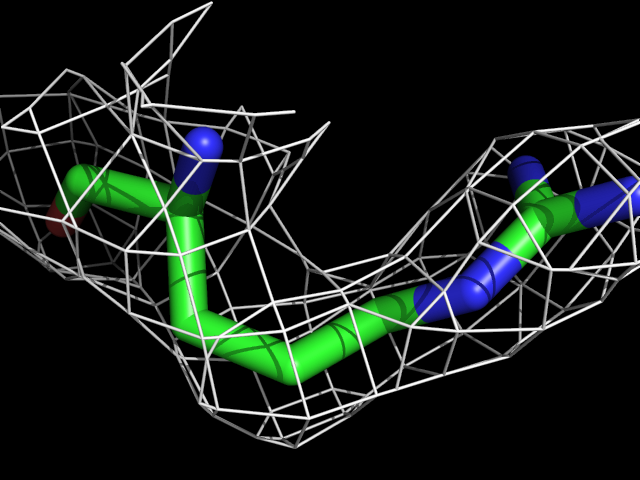 |
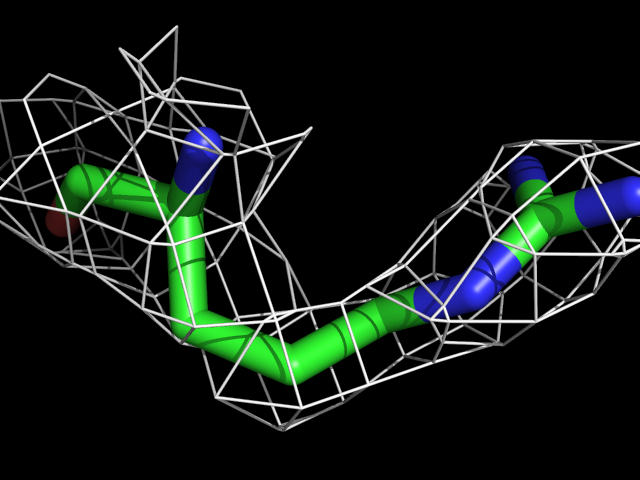 |
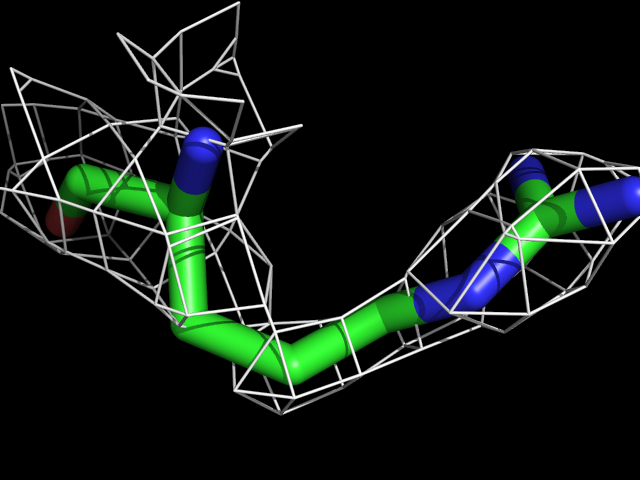 |
 |
 |
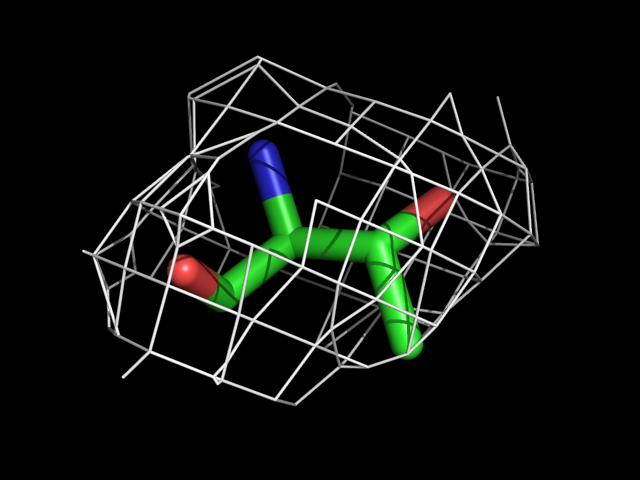
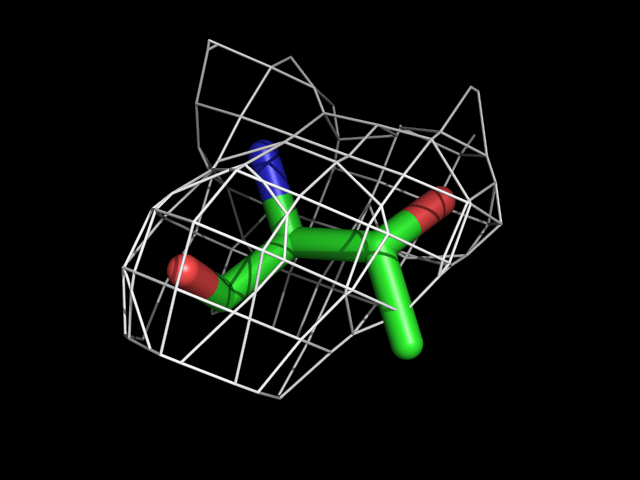
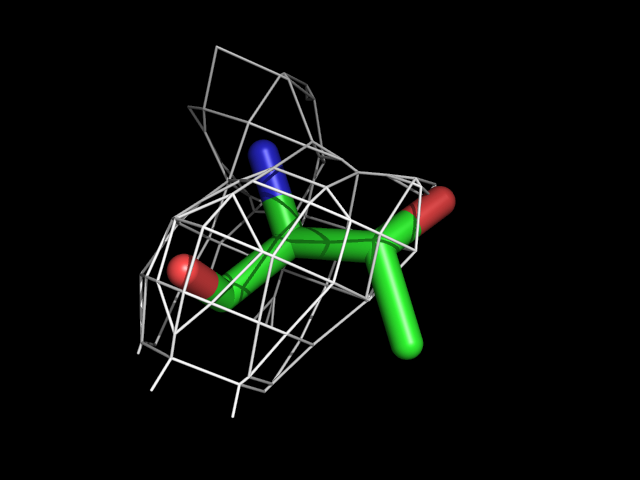
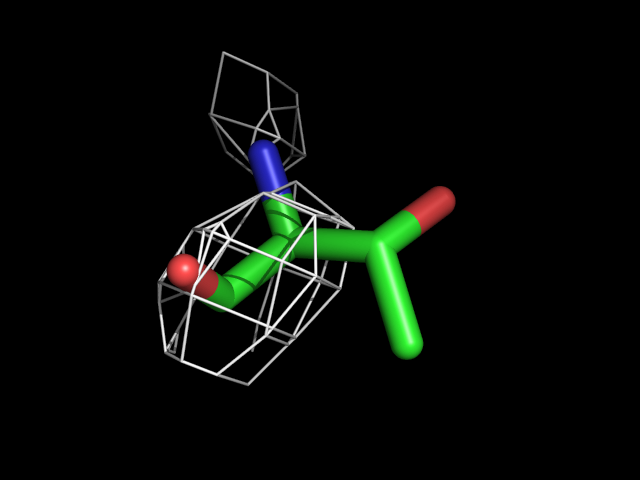
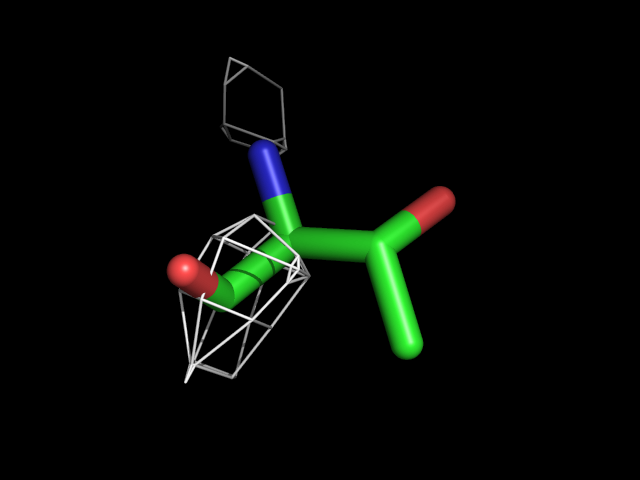
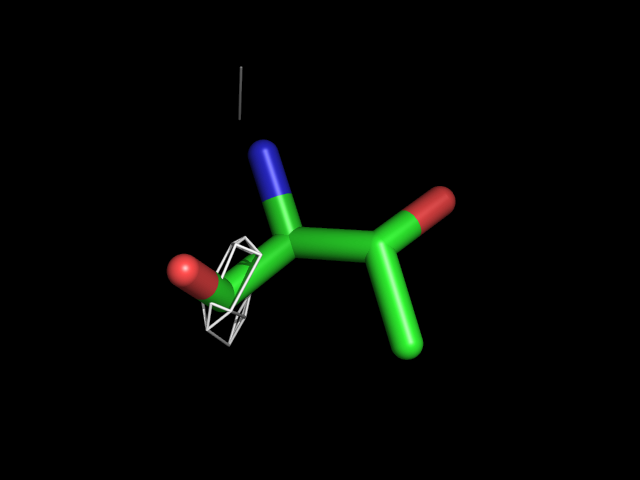
| Thr | |||||
 |
 |
 |
 |
 |
 |
| Val | |||||
 |
 |
 |
 |
 |
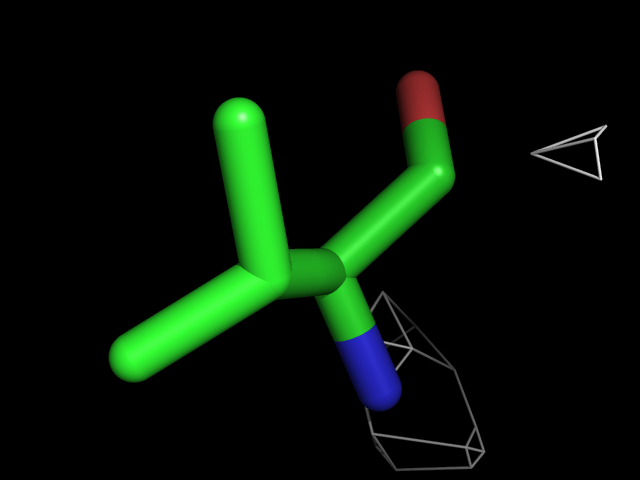 |
Видно, что при увеличении уровня подрезки остаются видны области соответствующие наобольшей плотности электронов - такие как сопряженные и кратные связи (хорошо видно на примере аргинина). Тем не менее, четкое соответствие ядрам атомов наблюдается не везде, что говорит о недостаточно хорошем качестве разрешения структуры.
© Elizaveta Besedina, FBB 2012
lizaveta@kodomo.fbb.msu.ru