3HQ2
Кристаллографические характеристики моего белка (из PDB файла):CRYST1 88.957 149.002 217.840 90.00 90.00 90.00 I 2 2 2 16
Здесь 88.957, 149.002 и 217.840 - длины направляющих векторов кристаллической ячейки, а 90.00, 90.00 и 90.00 - углы между направляющими векторами ячейки. Как видно, кристаллическая ячейка для этого белка ортогональная. Число молекул в ячеке - 16 (последнее число в строке). I 2 2 2 - это кристаллографическая группа.
Белок является гомодимером, в одной ячейке находятся 2 полипептидные цепи. На рисунке 1 предсавлена структура части кристалла.
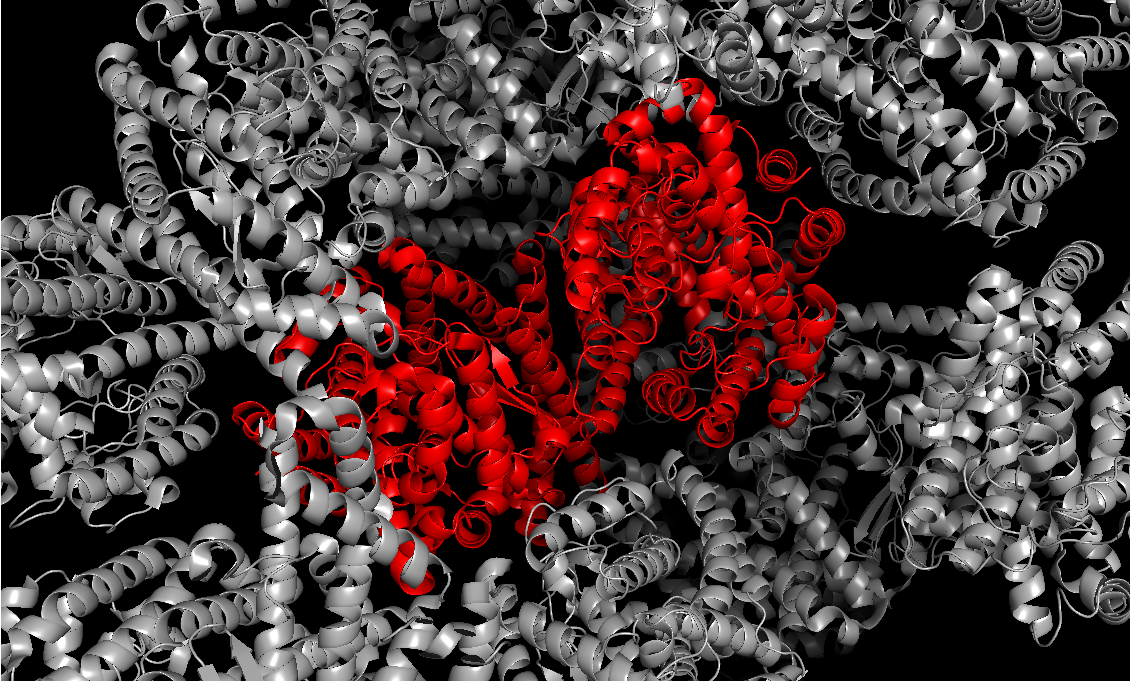 |
| Рис. 1. Часть кристалла. Красным выделена одна ячейка с белком-гомодимером |
Контакты соседних ячеек
Для визуализации контактов между соседними ячеками использовались следующие команды:symexp sym, 3hq2, 3hq2, 20
select set1, byres (3hq2 within 3.5 of sym*)
select set2, byres (sym* within 3.5 of 3hq2)
color white, byres (set2 and (set1 around 3.5))
color white, byres (set1 and (set2 around 3.5))
show sticks, byres (set1 and (set2 around 3.5))
show sticks, byres (set2 and (set1 around 3.5))
distance hbonds, set1, set2, 3.5, 2
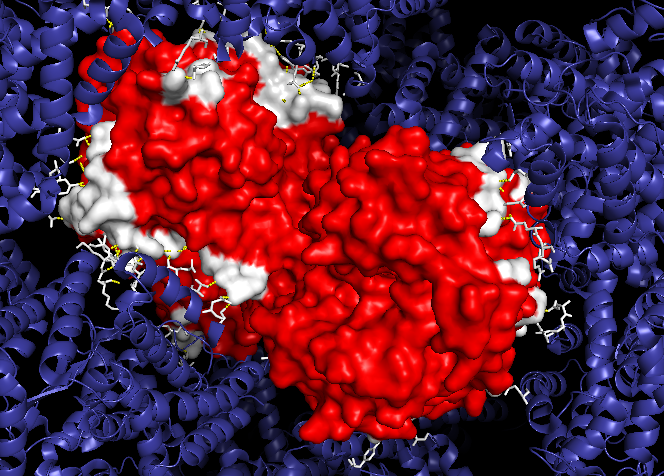 |
| Рис. 2. Контакты между соседними ячейками. Красным выделена центральная ячейка с белком-гомодимером, синим цветом покрашены белки соседних ячеек. Белый цвет имеют области белка центральной ячейки, контактирующие с соседними, желтым пунктиром показаны водородные связи между соседними ячейками |
Ниже ближе показан один из контактов между белками из соседних ячеек. Контакт является абсолютно симметричным (в нем участвуют одни и те же аминокислоты) и немаловажную роль в скреплении также играет ион цинка. По всей видимости, цинк ковалентно связан с гистидинами и координирует водородными связями также лизины и остатки глутаминовой кислоты.
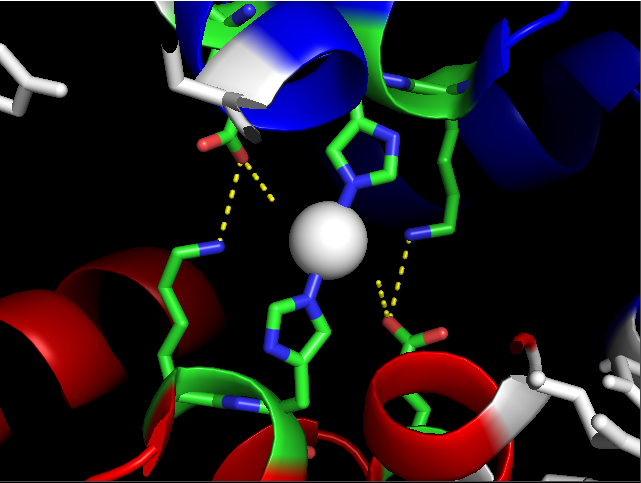 |
| Рис. 3. Контакт между соседними ячейками. В контакте участвуют Glu446, Lys309, His310 и атом цинка (покрашен белым цветом). Желтым показаны водородные связи |
Общее число областей контакта между белками из разных ячеек - 13 (рис. 4).
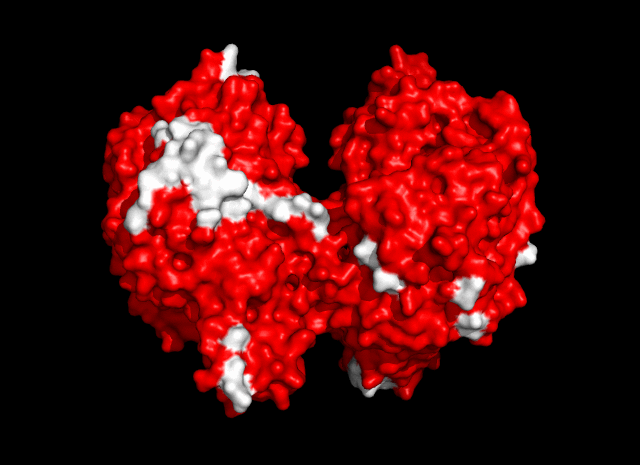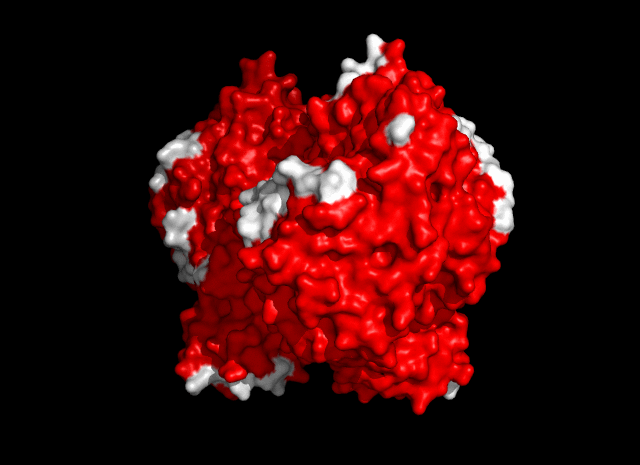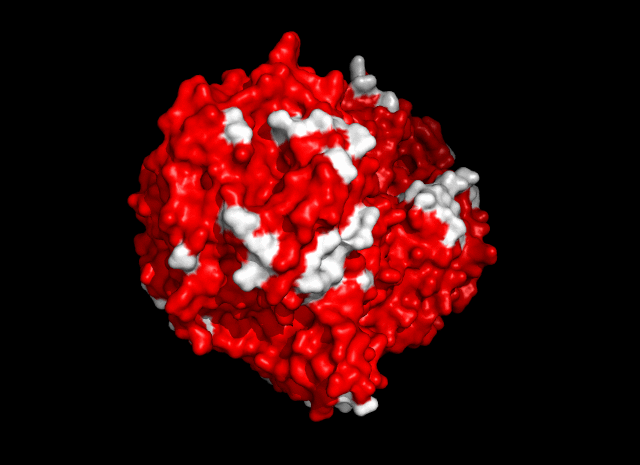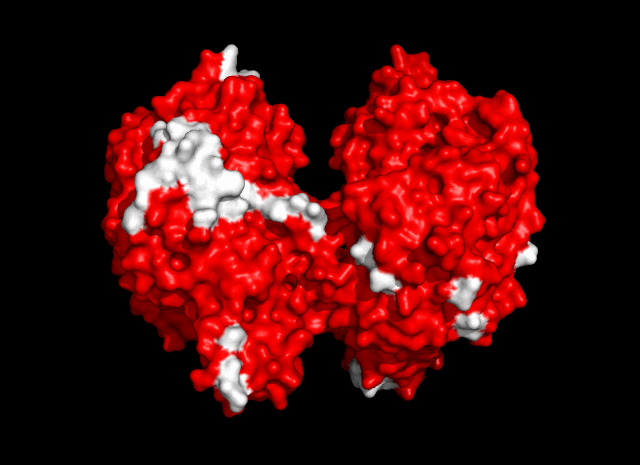 |
| Рис. 4. Общее число контактов между соседними ячейками - 13. |
Для выявления гидрофобных взаимодействий использовались следующие команды:
symexp symp, 3hq2, 3hq2, 20
select hyph, resn leu+ile+val+phe+trp+met+ala
distance hyphint, byres(hyph and 3hq2), byres(hyph and symp*), 4
select hyph_res1, byres((hyph and 3hq2) within 4 of (hyph and symp*))
select hyph_res2, byres((hyph and symp*) within 4 of (hyph and 3hq2))
show sticks, hyph_res*
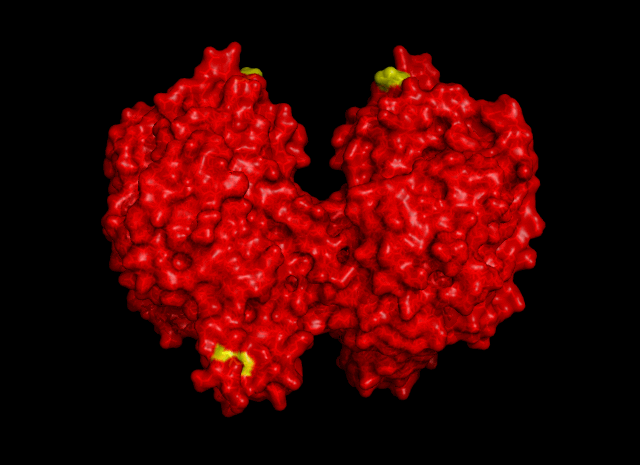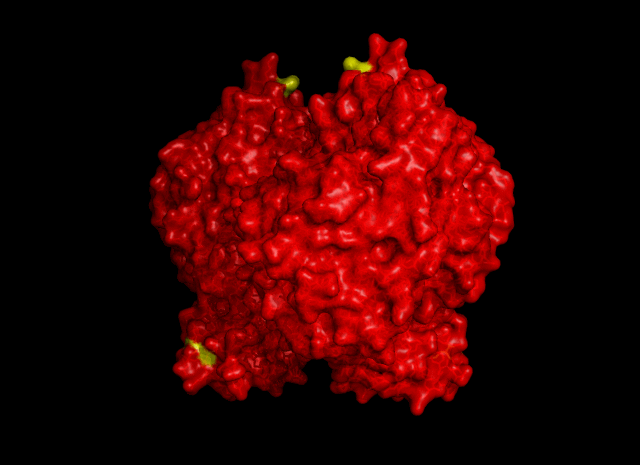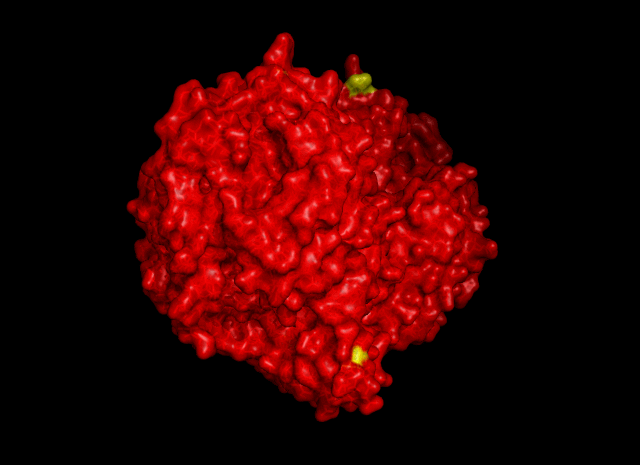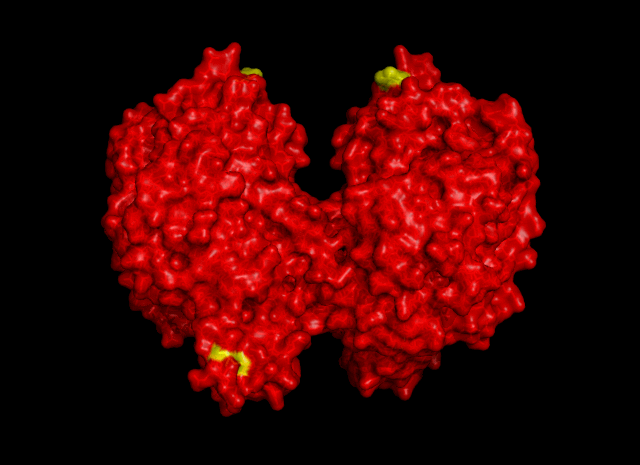 |
| Рис. 5. Гидрофобные контакты между соседними ячейками. Участвуют остатки Val325 и Leu77 |
Структура 3HDD
Данная модель описывает структуру комплекса гомеодомена D. melanogaster с ДНК. На первый взгляд кажется странным "крайнее" положение цепи B белка относительно ДНК (рис. 6). Однако после восстановления соседних ячеек становится ясно, что, возможно, кристаллическая ячейка данной модели выбрана не совсем удачно: контакт цепи B продолжается дальше по цепочке ДНК в соседних ячейках (рис. 7 - показано только для одной стороны).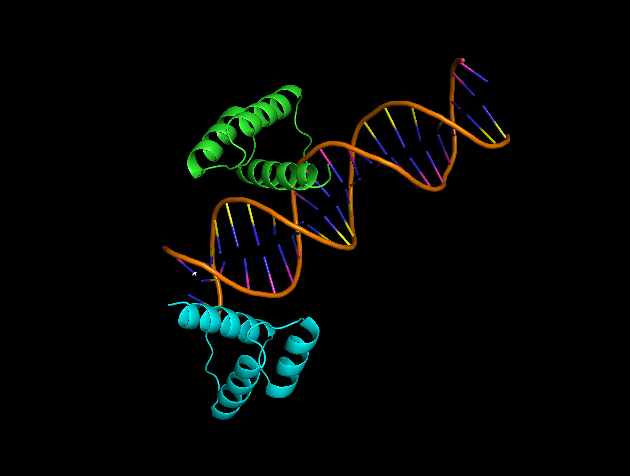 |
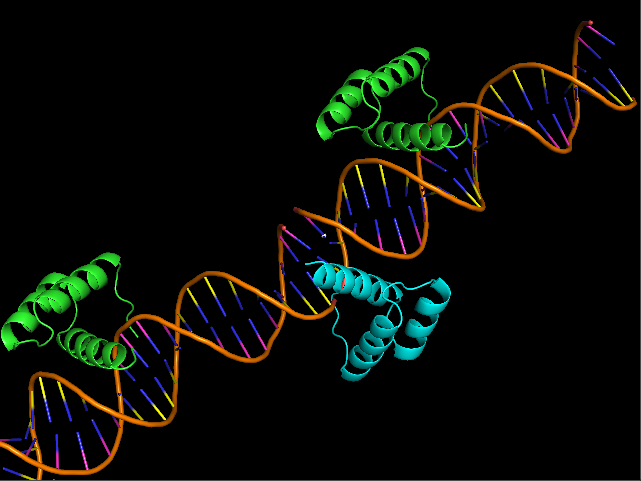 |
| Рис. 6. Одна ячейка стркутуры комплекса гомеодомена с ДНК (3HDD) | Рис. 7. Две соседние ячеки структуры комплекса гомеодомена с ДНК (3HDD) |
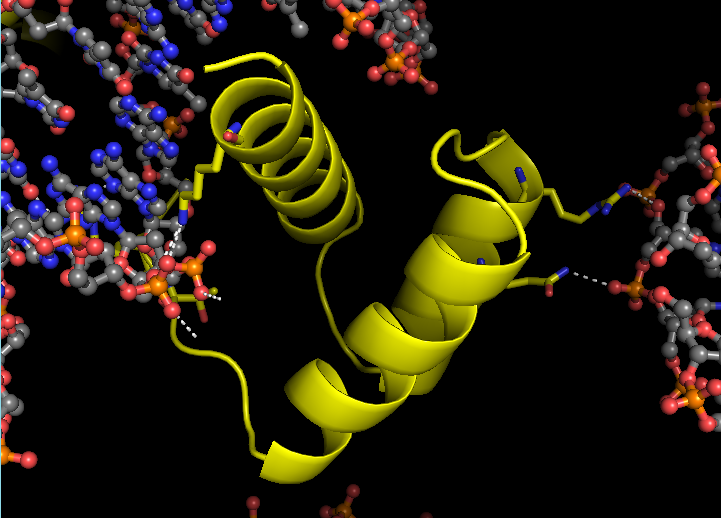
При более тщательном и близком рассмотрении данной струкуры с использованием следующих команд:
symexp sym, 3hdd, 3hdd, 4, 1
select chB, byres ((chain B and 3hdd) within 3.5 of (sym* and (resn DA or resn DT or resn DG or resn DC)))
select DNA, byres ((sym* and (resn DA or resn DT or resn DG or resn DC) within 3.5 of (chain B and 3hdd)))
show sticks, chB
show sticks, DNA
distance hbonds, chB, DNA, 3.5, 2
 |
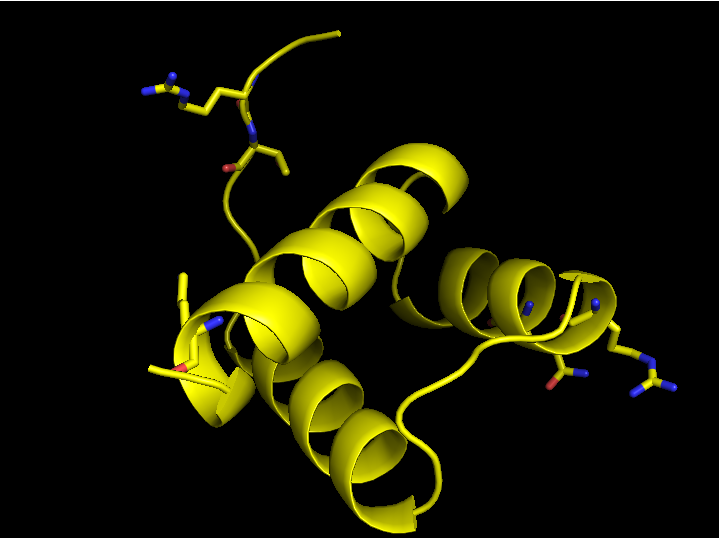 |
| Рис. 8. Контактообразующие остатки цепи В структуры 3HDD | Рис. 9. Контактообразующие остатки цепи В структуры 3HDD; без цепей ДНК |
Таким образом, крайнее положение цепи В относительно молекулы ДНК объясняется ее котактом с цепями ДНК из соседних ячеек.
© Elizaveta Besedina, FBB 2012
lizaveta@kodomo.fbb.msu.ru