Описание структуры RNA pyrophosphohydrolase BdRppH в комплексе с GTP и Mg2+
Структура в целом
RNA pyrophosphohydrolase BdRppH (РНК-пирофосфогидролаза) оносится к гидролазам - ферментам, катализирующим гидролиз ковалентной связи. Эксперименты показывают, что BdRppH катализирует гидролиз 5'-трифосфат РНК, высвобождая монофосфорилированную РНК и пирофосфат[1]. Комплекс фермента с GTP и Mg2+ в PDB (Protein Data Bank) имеет pdb_id 3FFU.
Молекула фермента состоит из двух полимерных цепей, идентичных по последовательности (однако различаются по вторичной структуре). В биологическую единицу также входят две идентичные цепи - фермент является гомодимером.
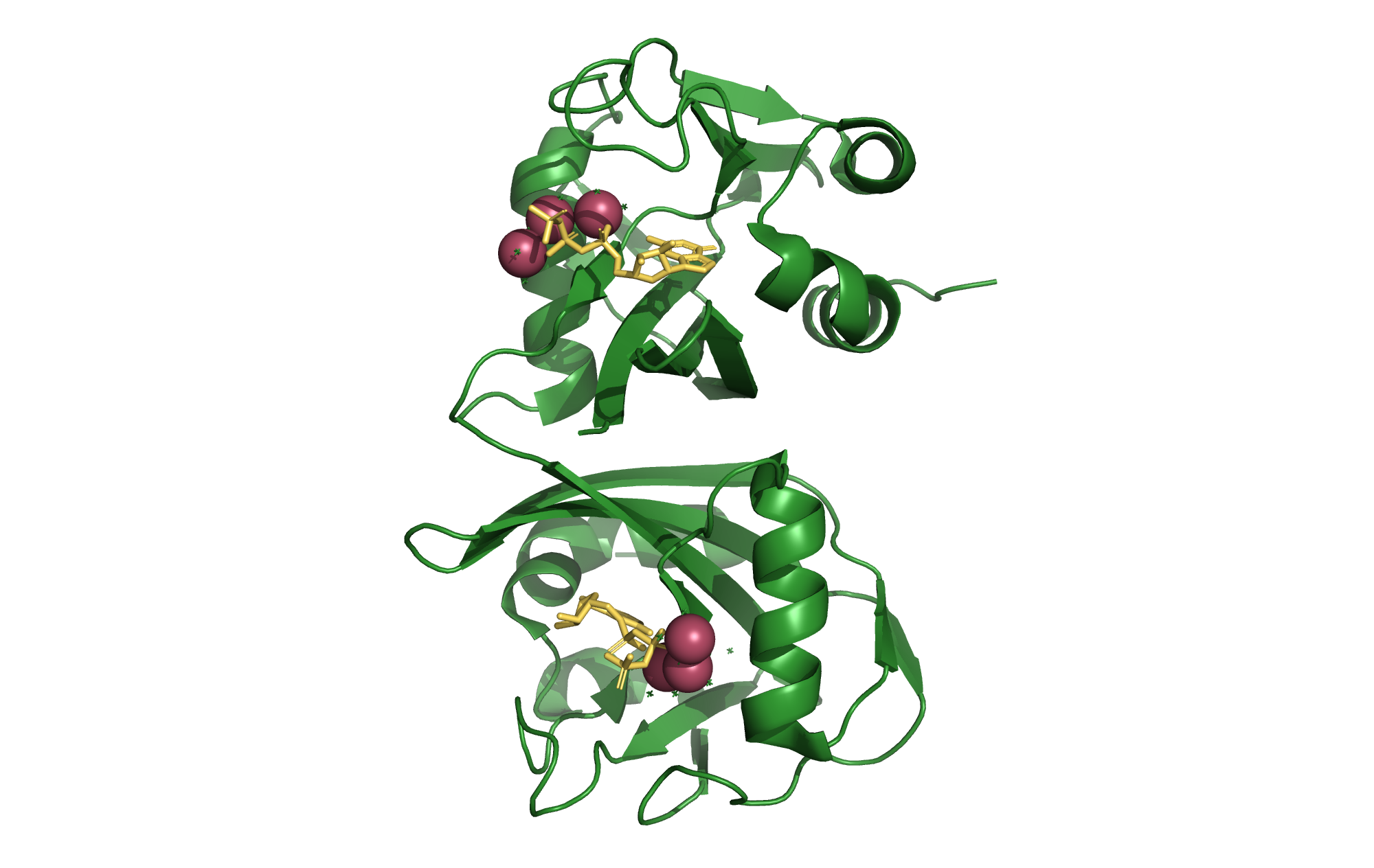
Отдельные цепи
Данный фермент был обнаружен в бактерии Bdellovibrio bacteriovorus -
граммотрицательной хищной бактерии, которая питается другими граммотрицательными бактериями.
Для исследований фермент синтезировали в штамме Escherichia coli, трансформированном
плазмидами, кодирующими BdRppH[1].
Данные UniProt:
uniprot_id: Q6MPX4
Название: Probable pyrophosphohydrolase
Функция: 8-oxo-7,8-dihydroguanosine triphosphatase activity
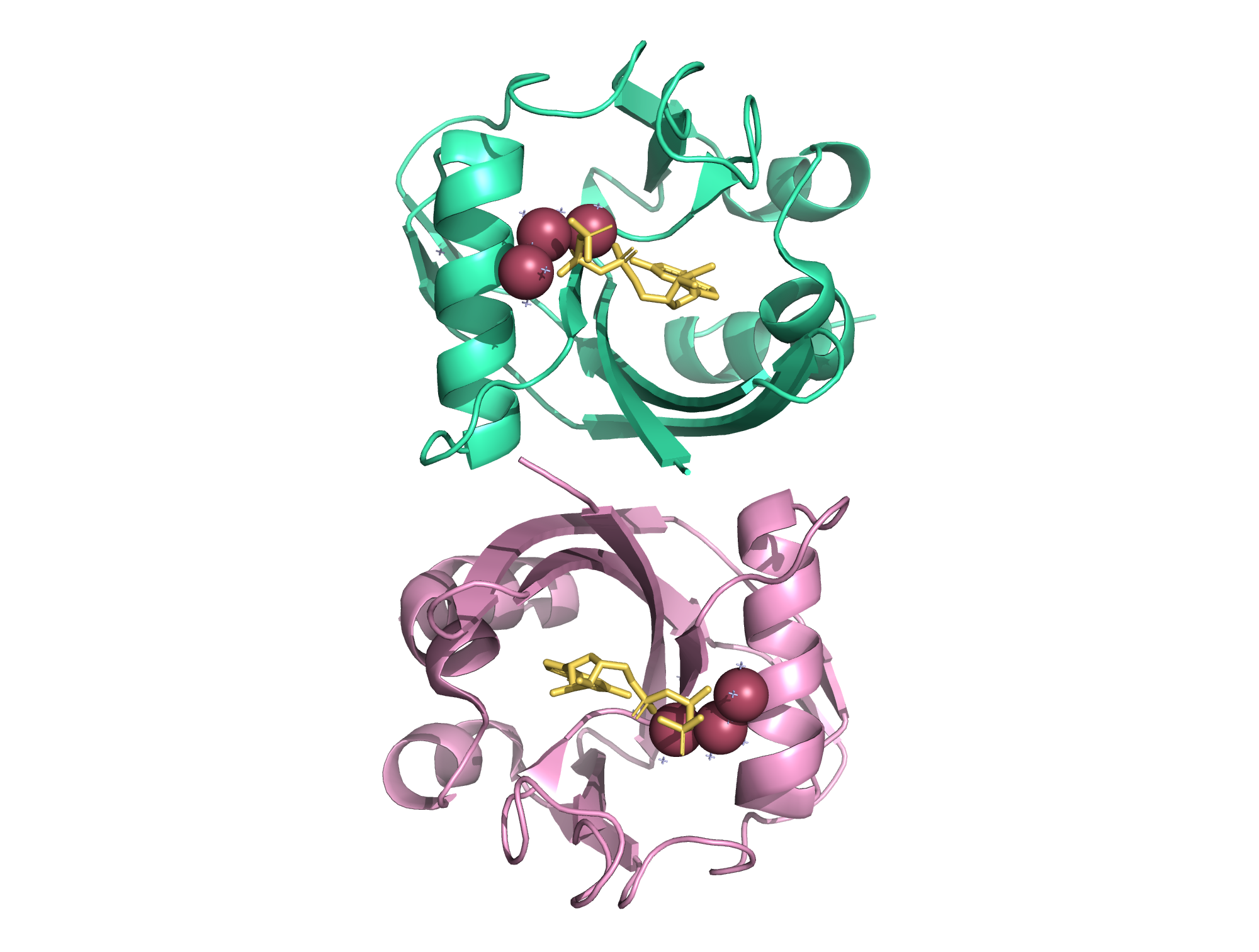
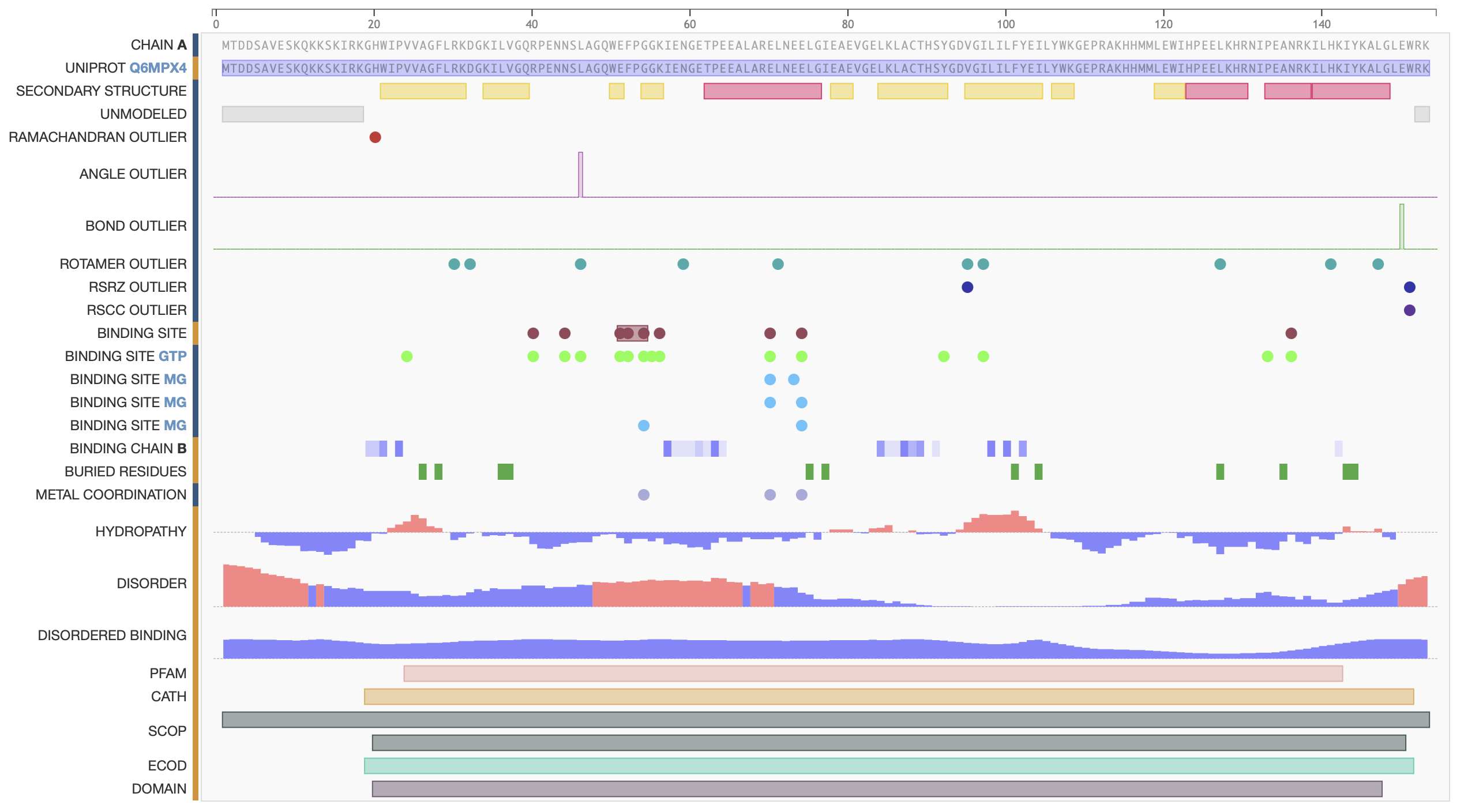
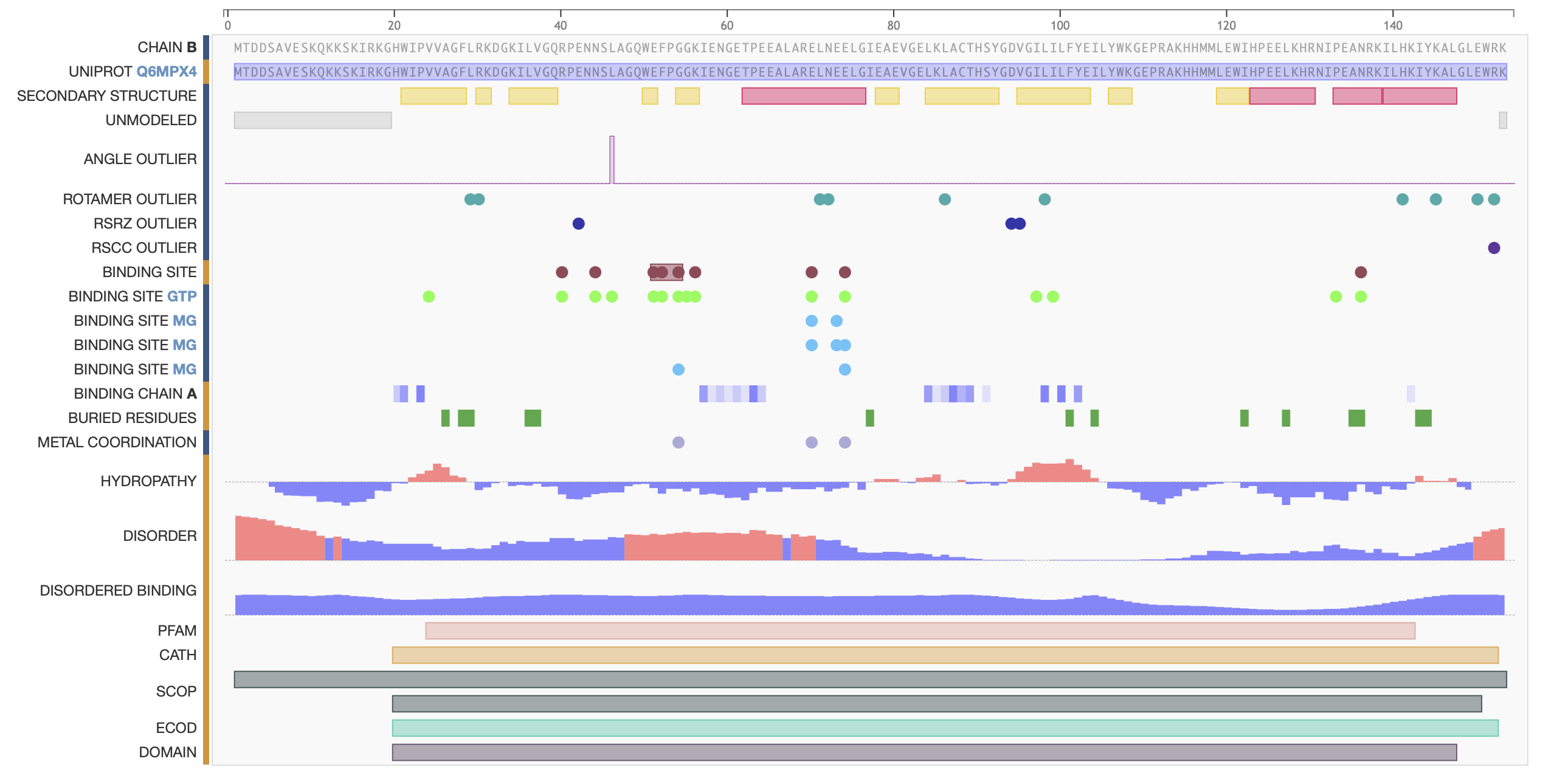
По аминокислотной последовательности цепи идентичны, однако по вторичной структуре различаются: в цепи A 4 α-спирали и 9 β-тяжей, в цепи B - 4 α-спирали и 10 β-тяжей (по сведениям UniProt, 3-я и 4-я α-спирали каждой из цепей расположены друг за другом, поэтому на рисунке выглядят как одна спираль). Таким образом, тяжей во вторичной структуре 3FFU больше.
Каждая цепь состоит из 153 аминокислот и не содержит мутаций относительно референса из базы Uniprot.
Модифицированные аминокислотные остатки не обнаружены (но на самом деле, белок не до конца исследован PDB и UniProt).
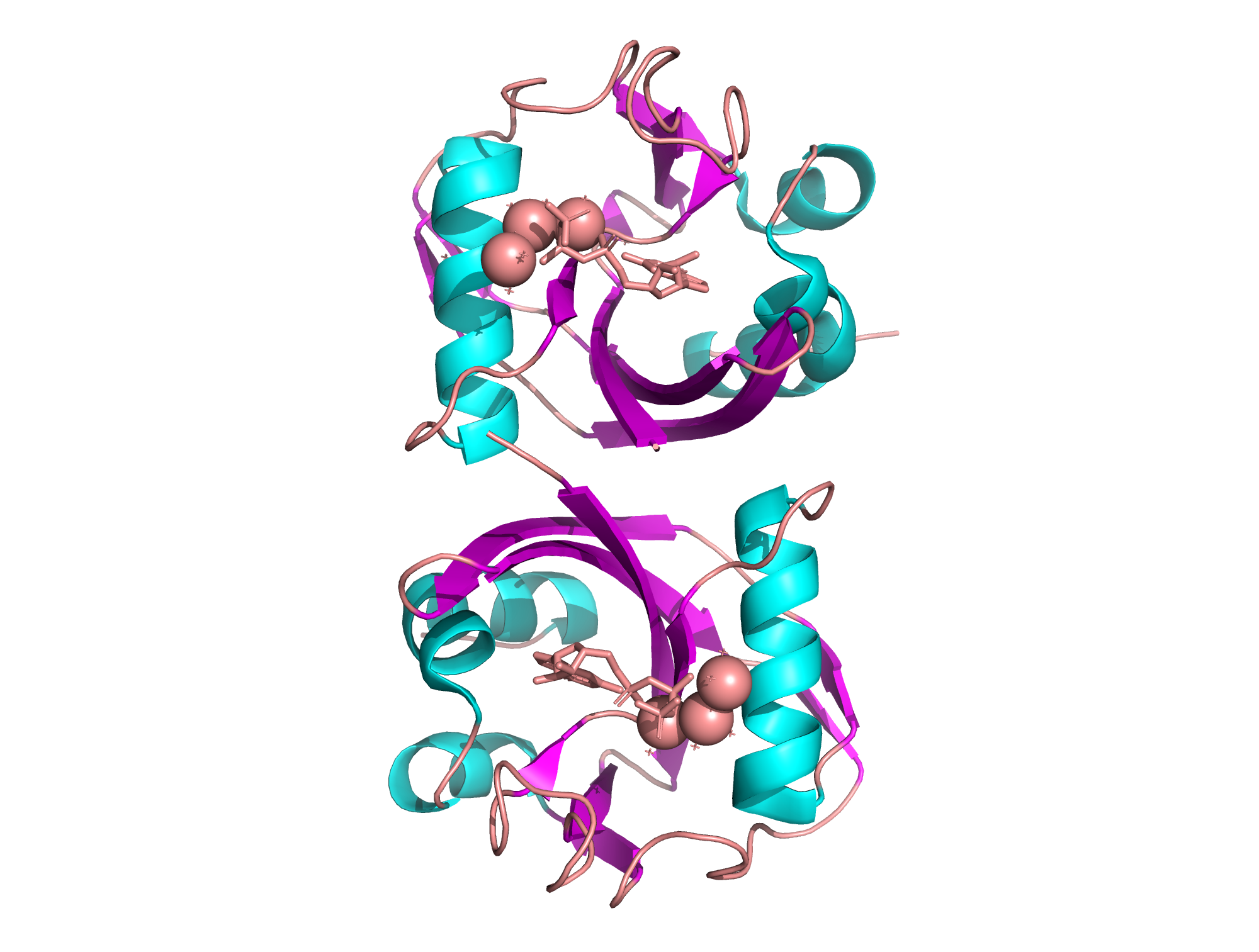
Малые молекулы
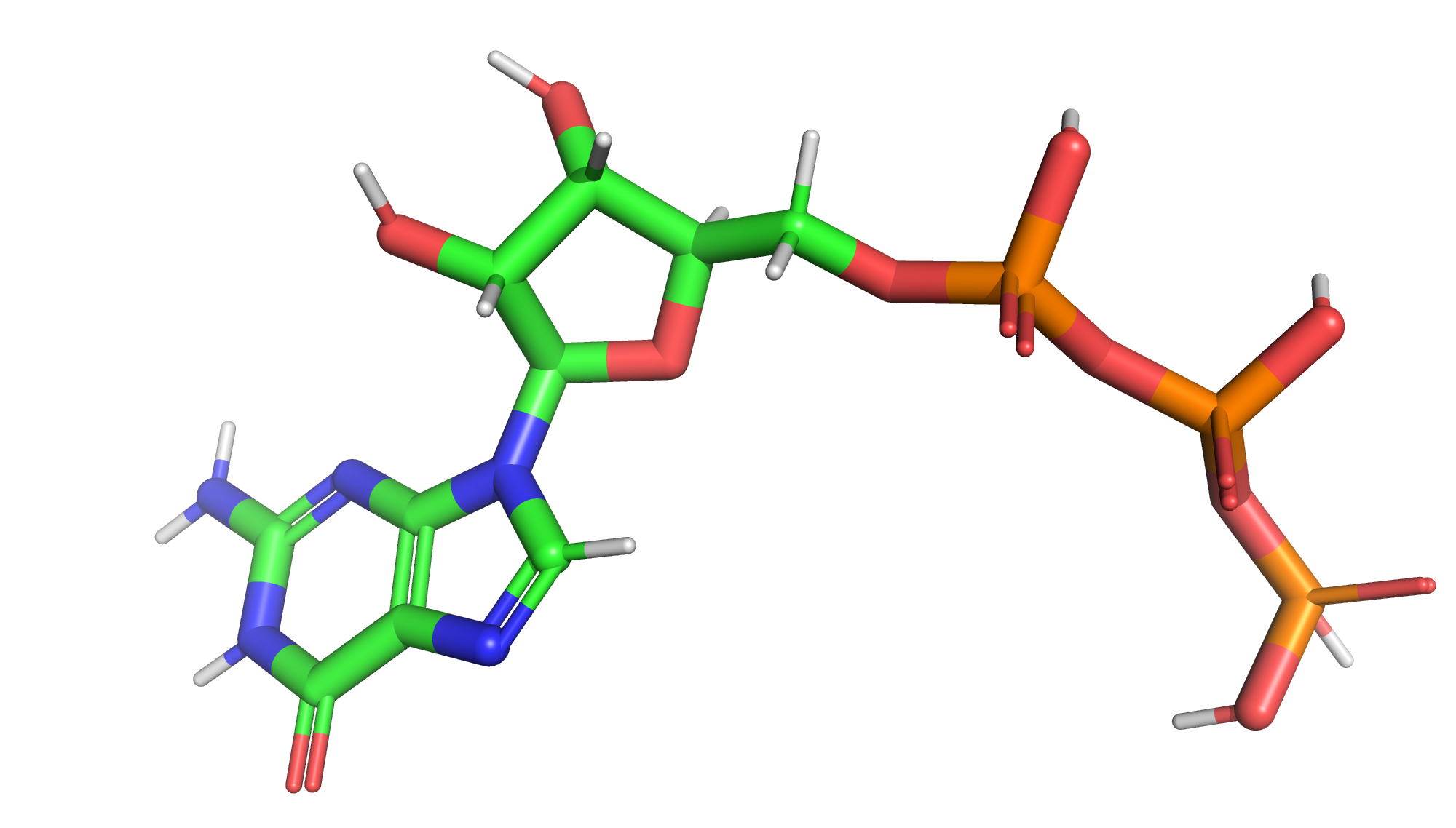
GTP: GTP - GUANOSINE-5'-TRIPHOSPHATE
Mg2+: MG - MAGNESIUM ION
ссылка на pdb с малыми молекулами (включая воду)
ссылка на pdb с малыми молекулами (без воды)
Синтез комплекса и функции малых молекул[1]
Комплекс BdRppH-GTP-Mg2+ был синтезирован для того, чтобы получить дополнительное представление о распознавании субстрата ферментом. Синтез комплекса проводили путем сокристаллизации фермента в присутствии субстрата - GTP - при pH=7 с последующим вымачиванием в том же маточном растворе с добавлением Mg2+.
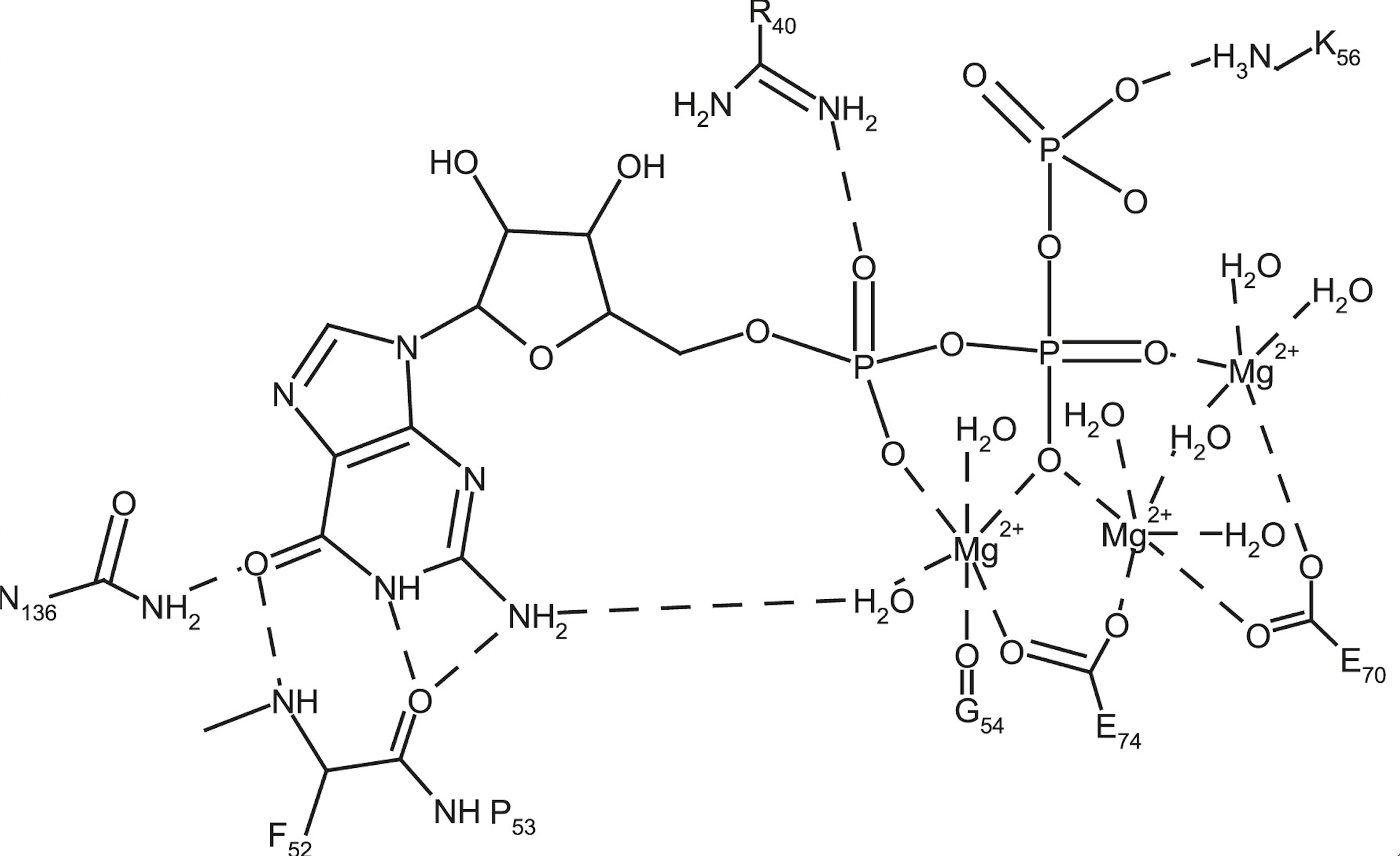
С каждой цепью связана 1 молекула GTP и 3 молекулы Mg2+ (и 9 молекул H2O). В ассиметричной единице находятся 2 молекулы GTP, 6 молекул Mg2+ и 18 молекул H2O. Октаэдрически скоординированные ионы металла связаны с молекулами воды и соединяют фосфаты GTP с активным центром фермента.
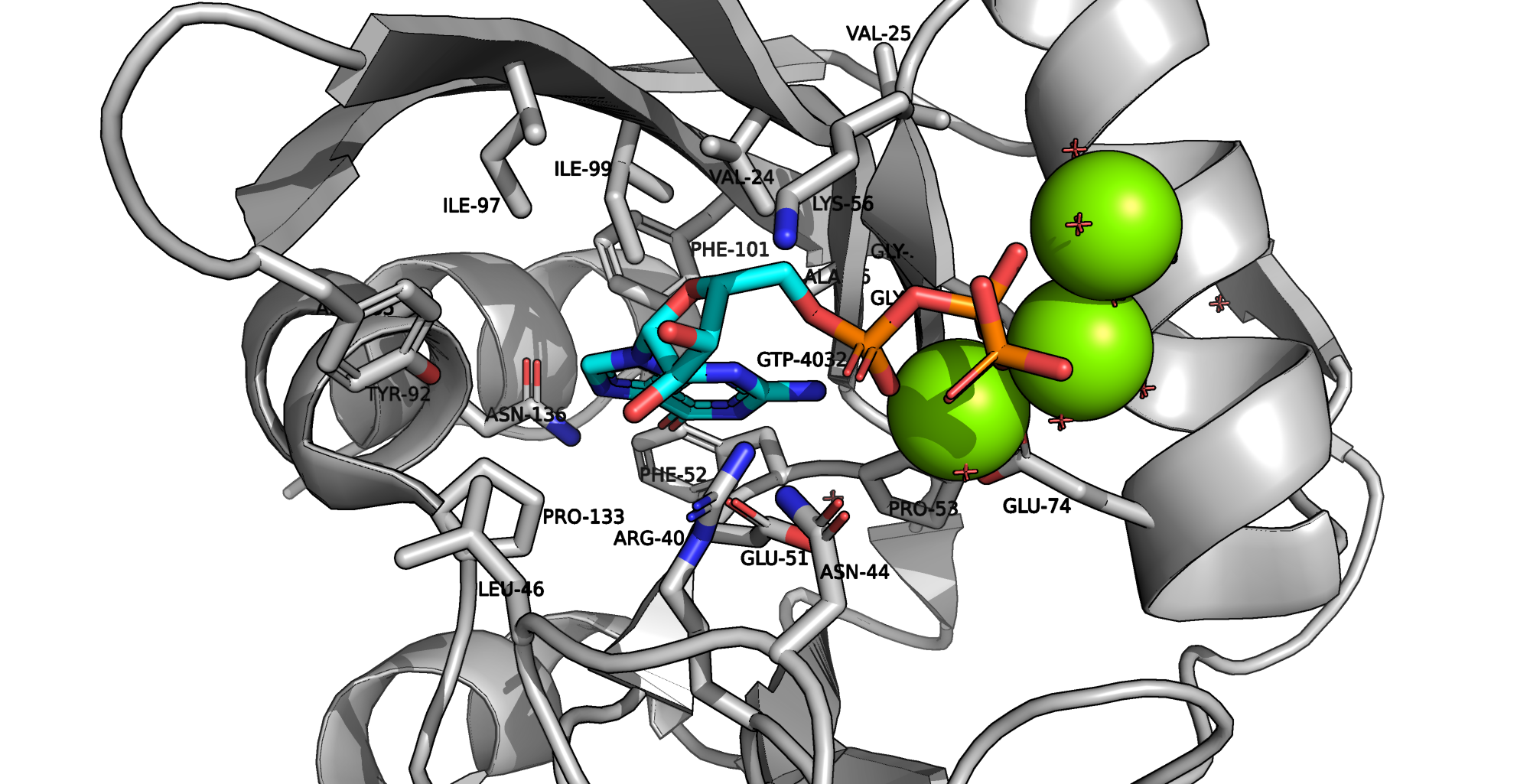
Наиболее удаленный Mg2+: карбонилом Gly54, двумя молекулами воды, карбоксилатом Glu74, кислородом из α-фосфата и кислорода β-фосфата.
Центральный Mg2+: молекулой воды, карбоксилатом Glu70, двумя молекулами воды, карбоксилатом Glu74 и кислородом из β-фосфата.
Третий Mg2+: карбоксилатом Glu70, молекулой воды и кислородом из β-фосфата и молекул воды.
Референсы
DOI: 10.1016/j.str.2008.12.022