Взаимодействие аминокислотных остатков в белке 3FFU
Белок 3FFU является гомодимером, поэтому рассматривать взаимодействия я буду на цепи B.
Водородная связь атомов остова белка
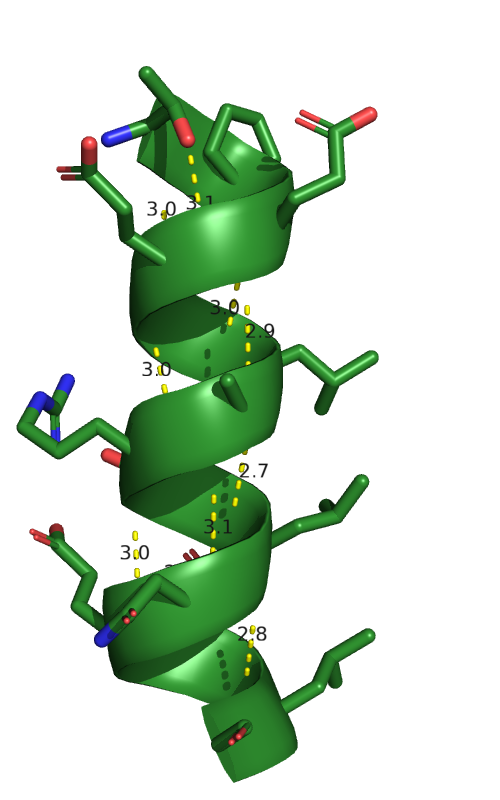
Самым простым способом рассмотреть водородную связь атомов остова белка в α-спирали.
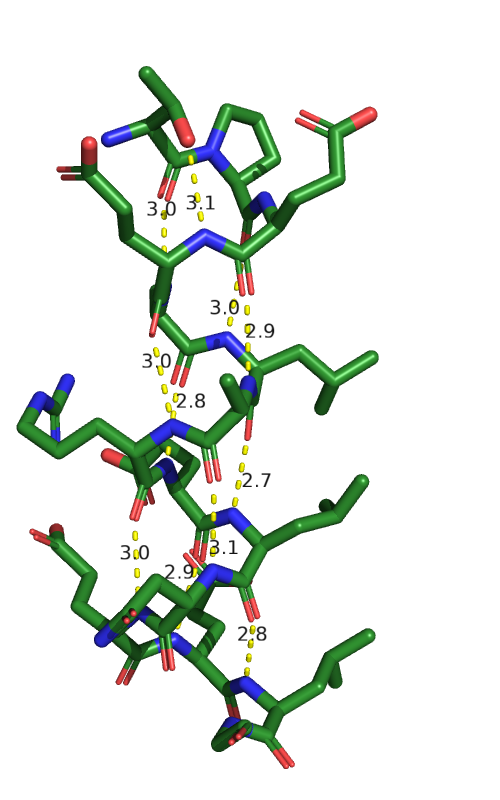
В цепи B 4 спирали, рассмотрим поподробнее спираль в позиции [62-76]. Первая водородная связь не
на остове: связь длиной 3,1 Å образована кислородом гидроксогруппы треонина (THR'62) и азотом
азотом глутаминовой кислоты (GLU'65). Остальные водородные связи образованы по типичному для α-спиралей
механизму: кислород (C=O) с i остатка соединяется с азотом (NH) i+4 остатка. Так, в данной спирали 11 водородных связей.
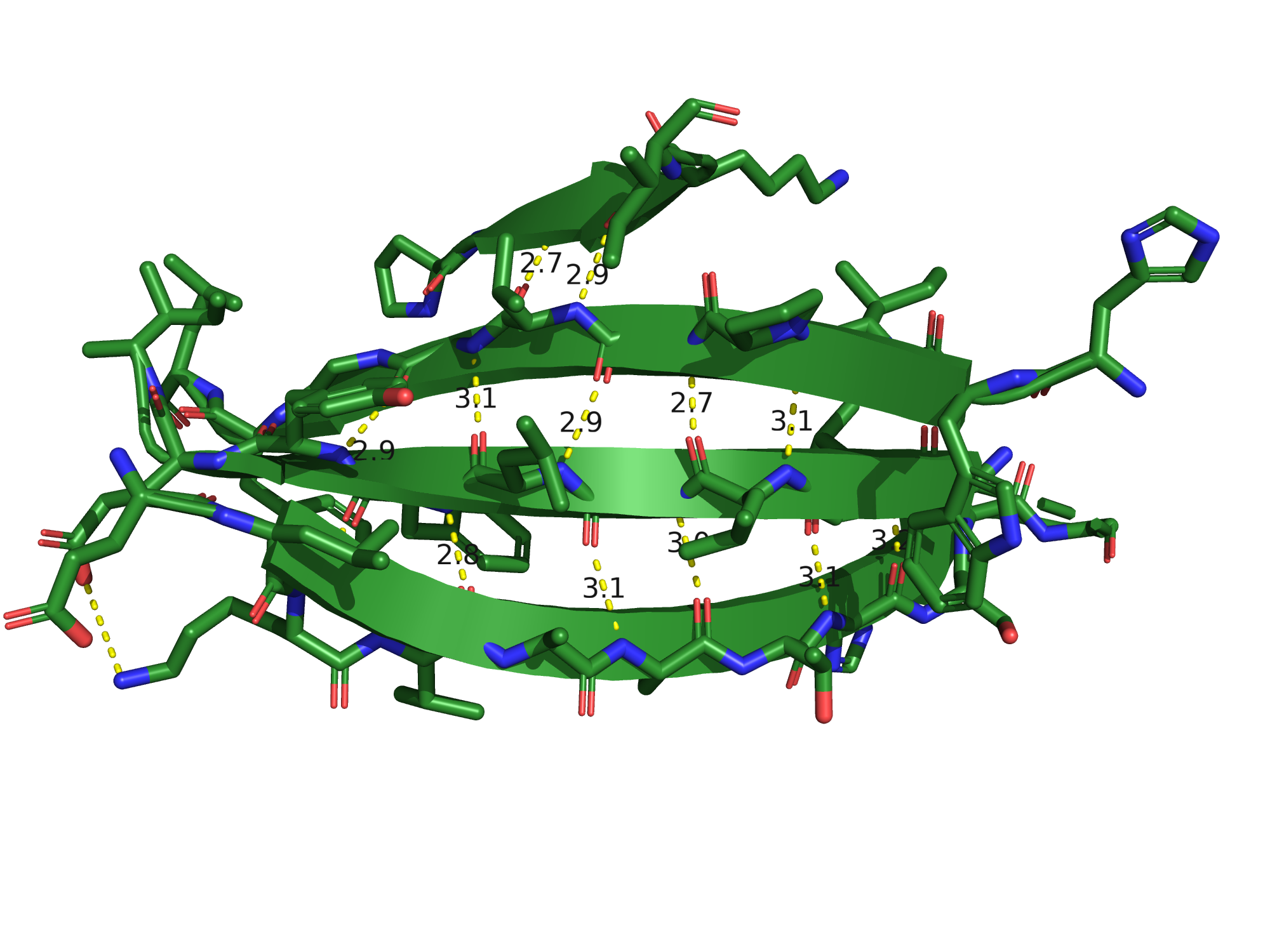
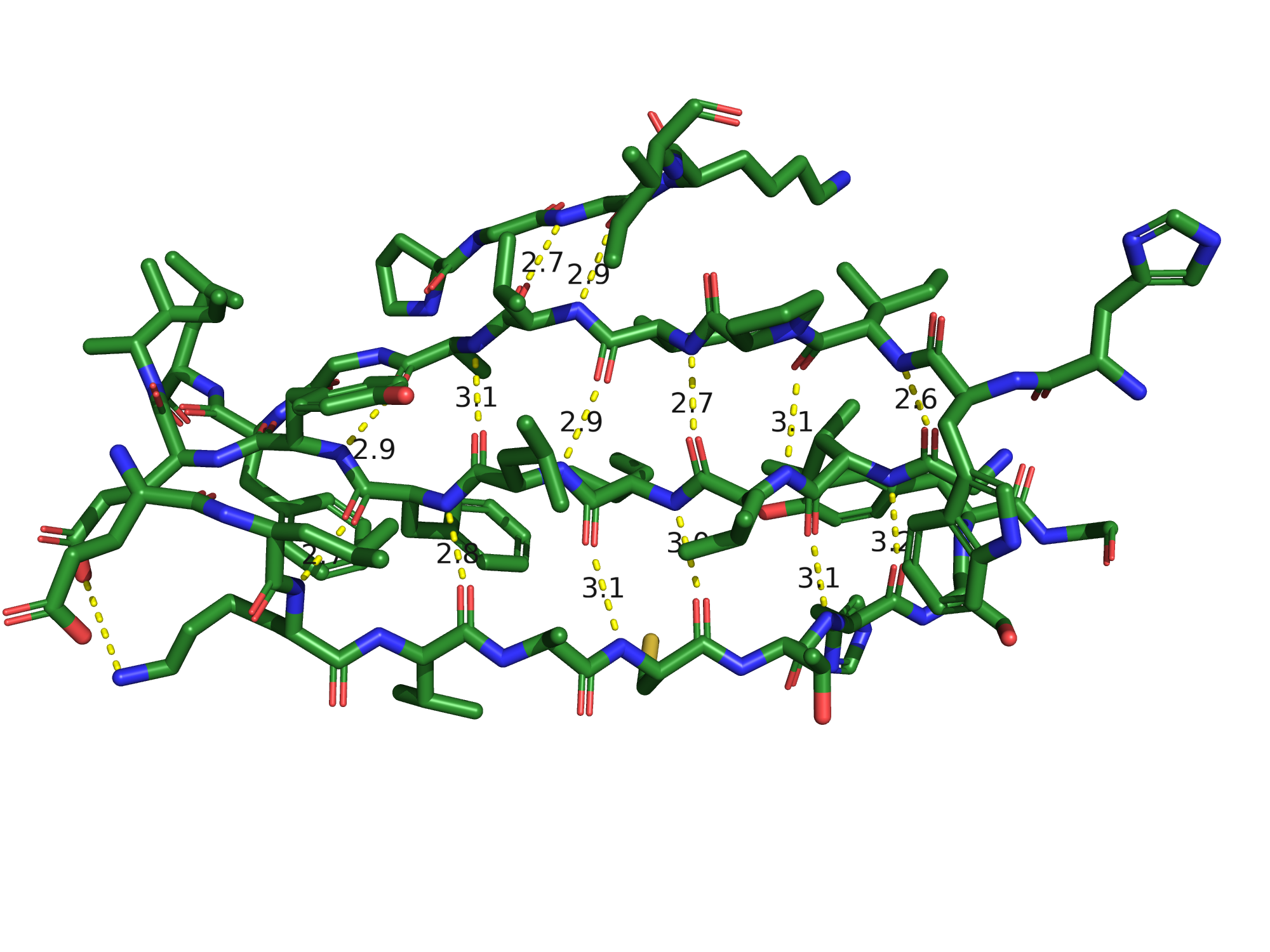
Рассмотрим также водородные связи между β-тяжами. Всего этих тяжей 9, принцип взаимодействия
хорошо заметен на группировке тяжей следующих позиций: [21-28], [54-56], [84-92] и [95-103].
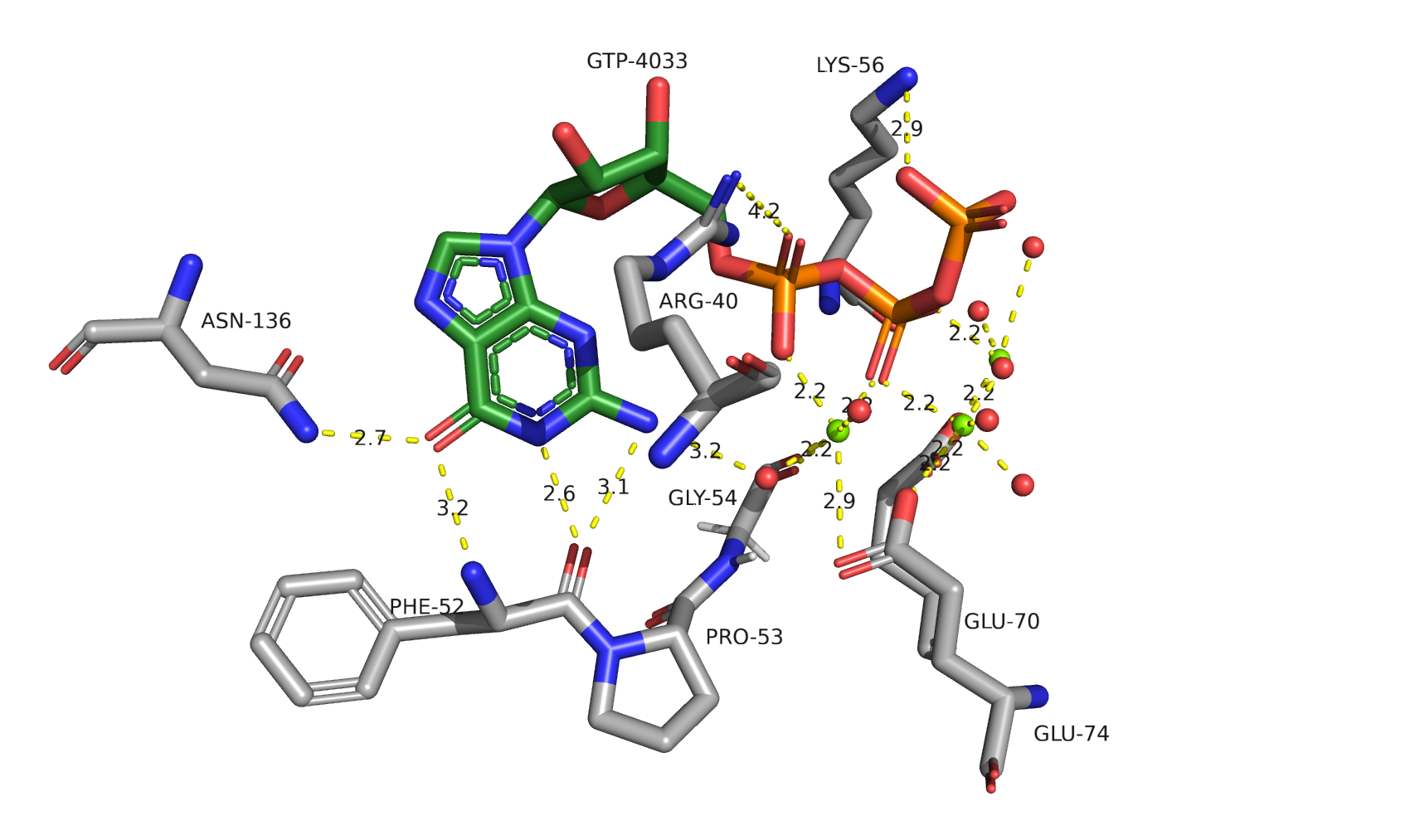
Водородная связь боковых радикалов белка
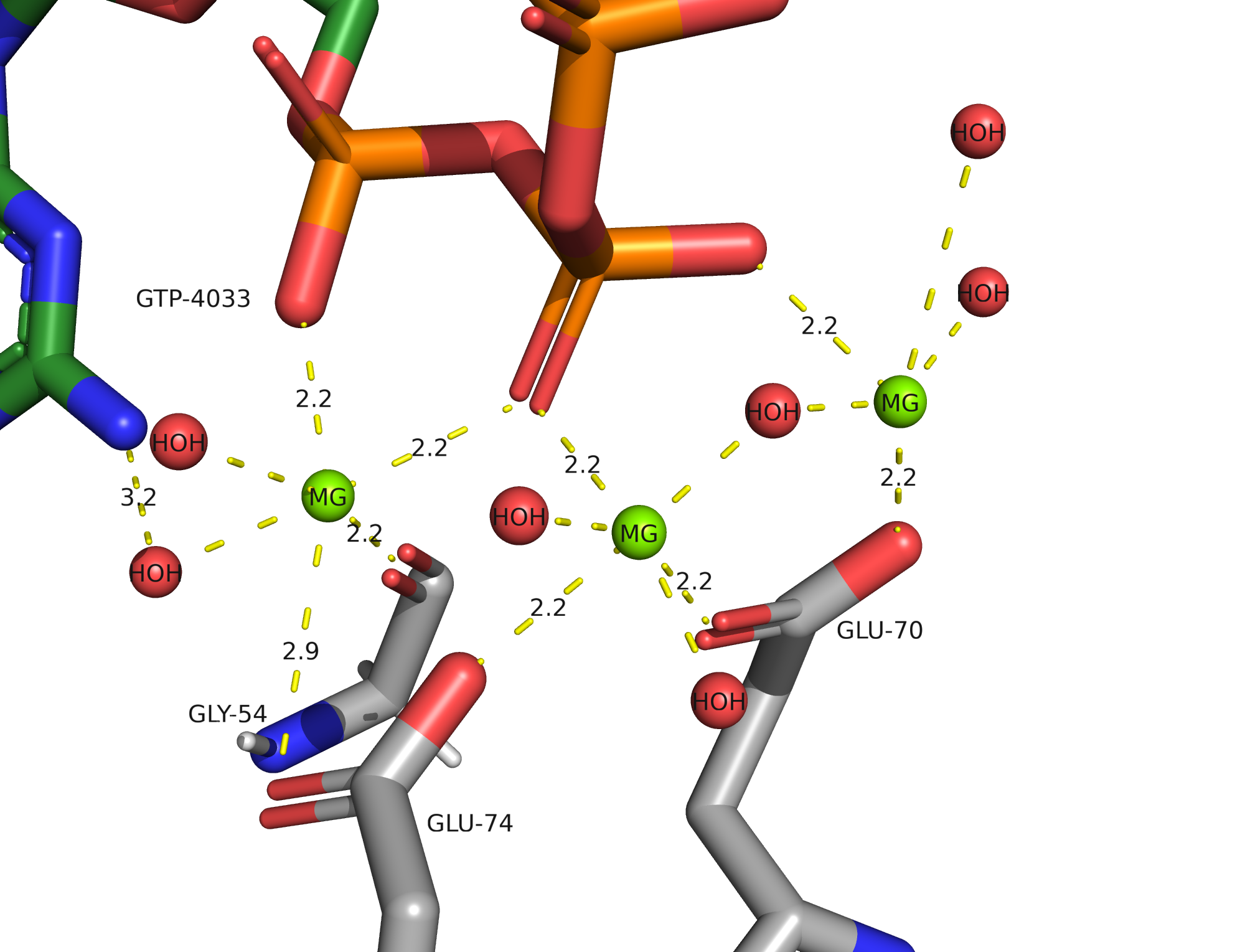
Рассмотрим водородные связи радикалов АК с лигандом GTP и ионами Mg2+.
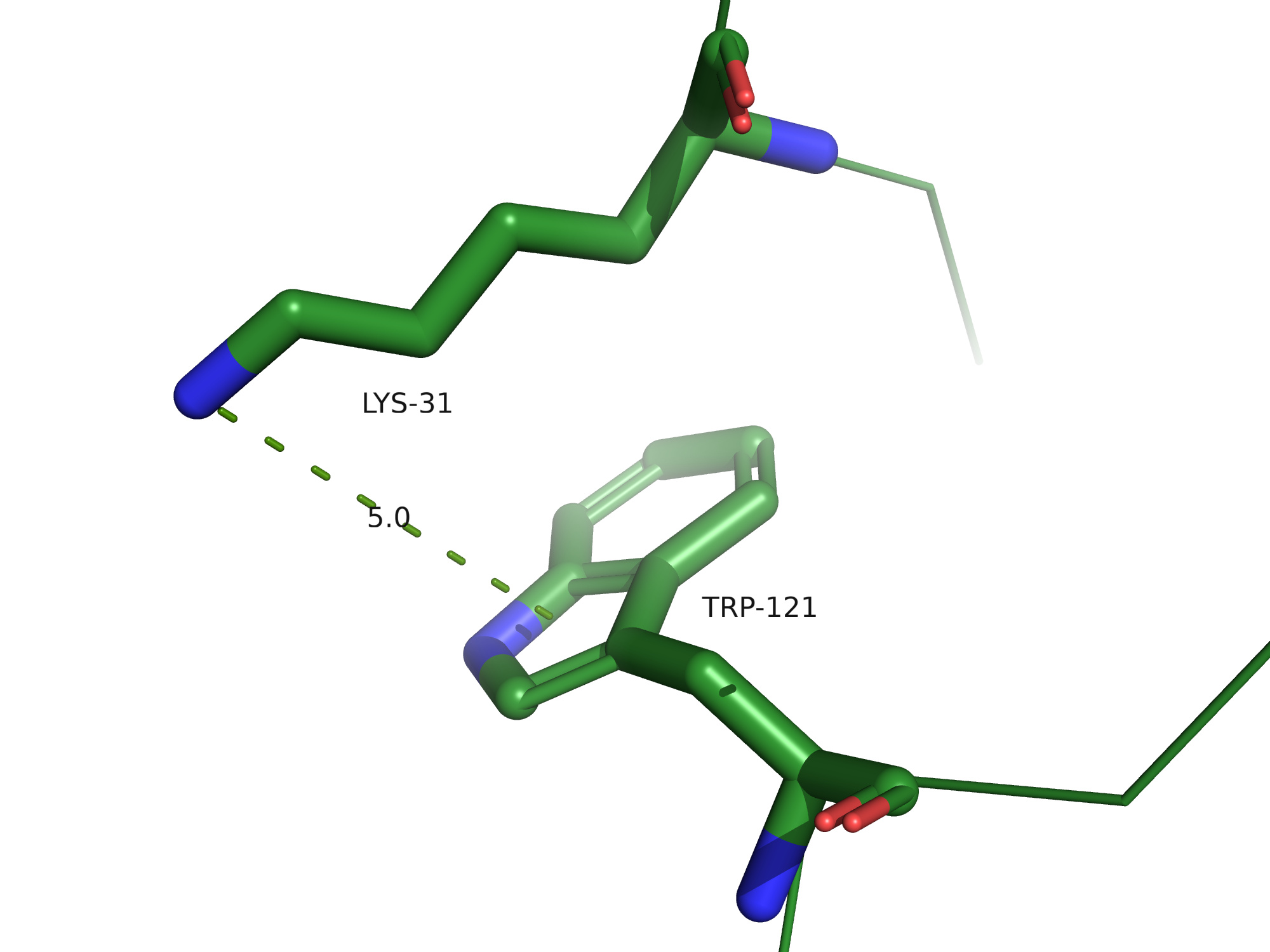
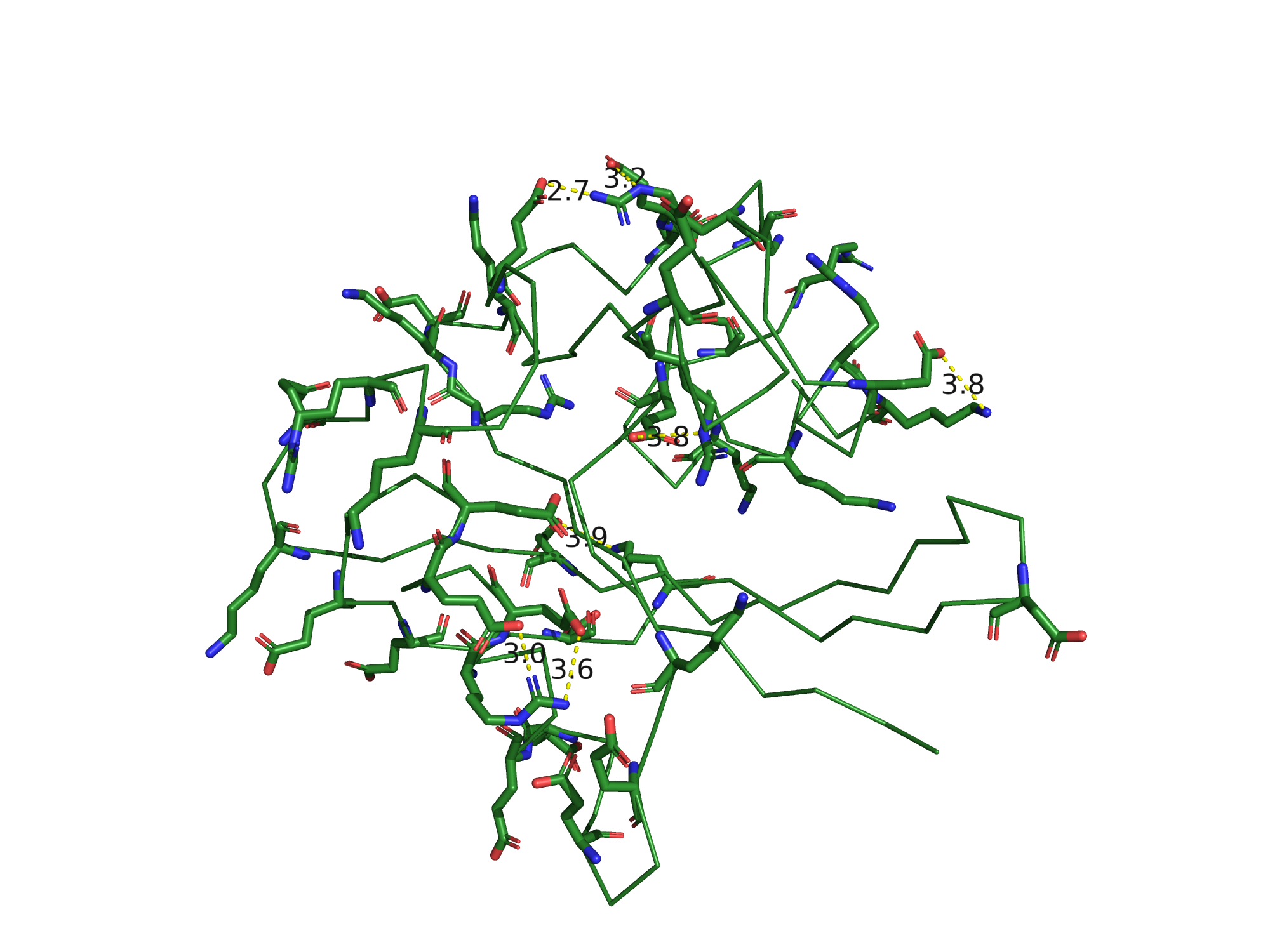
Солевые мостики
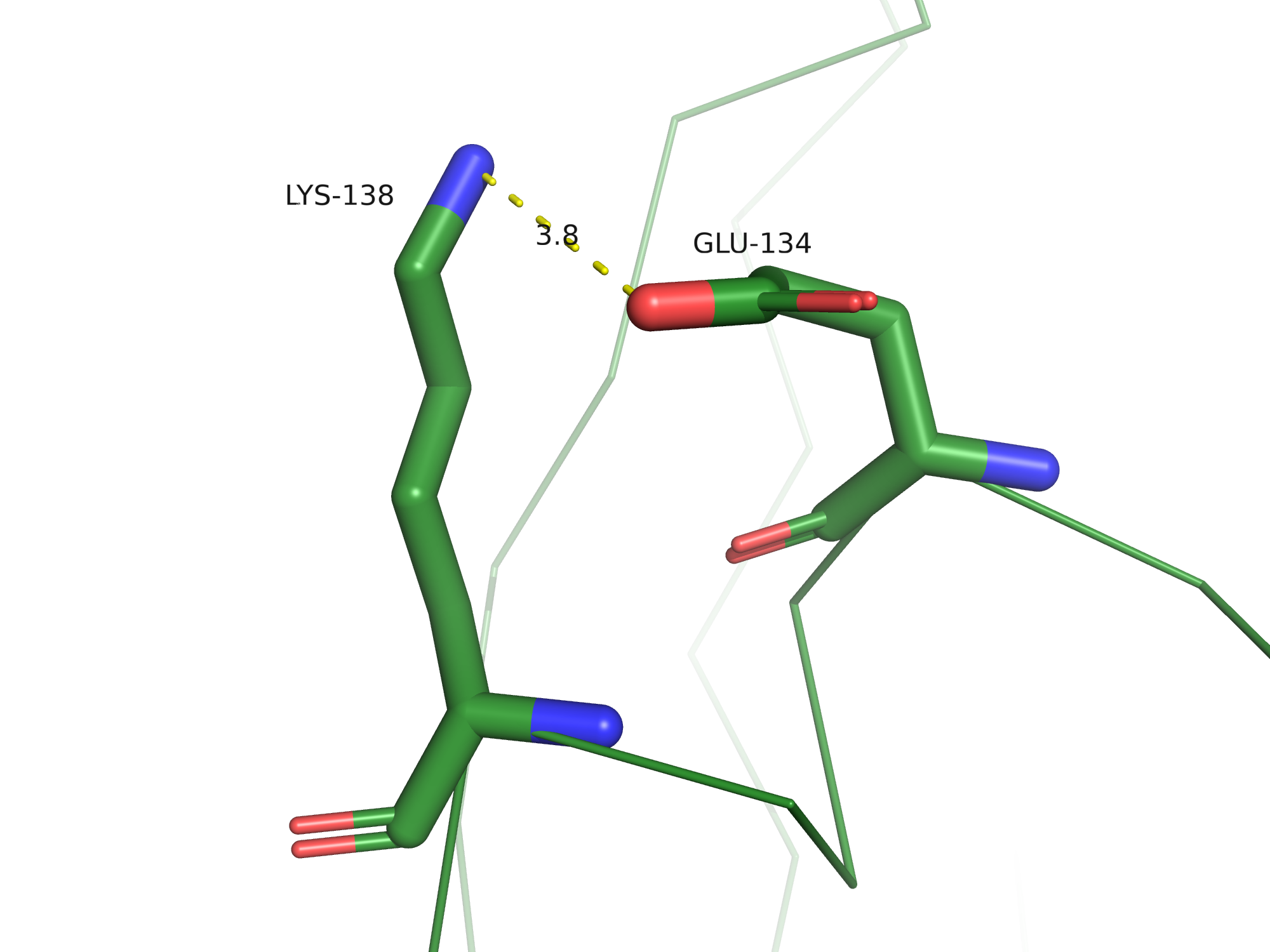
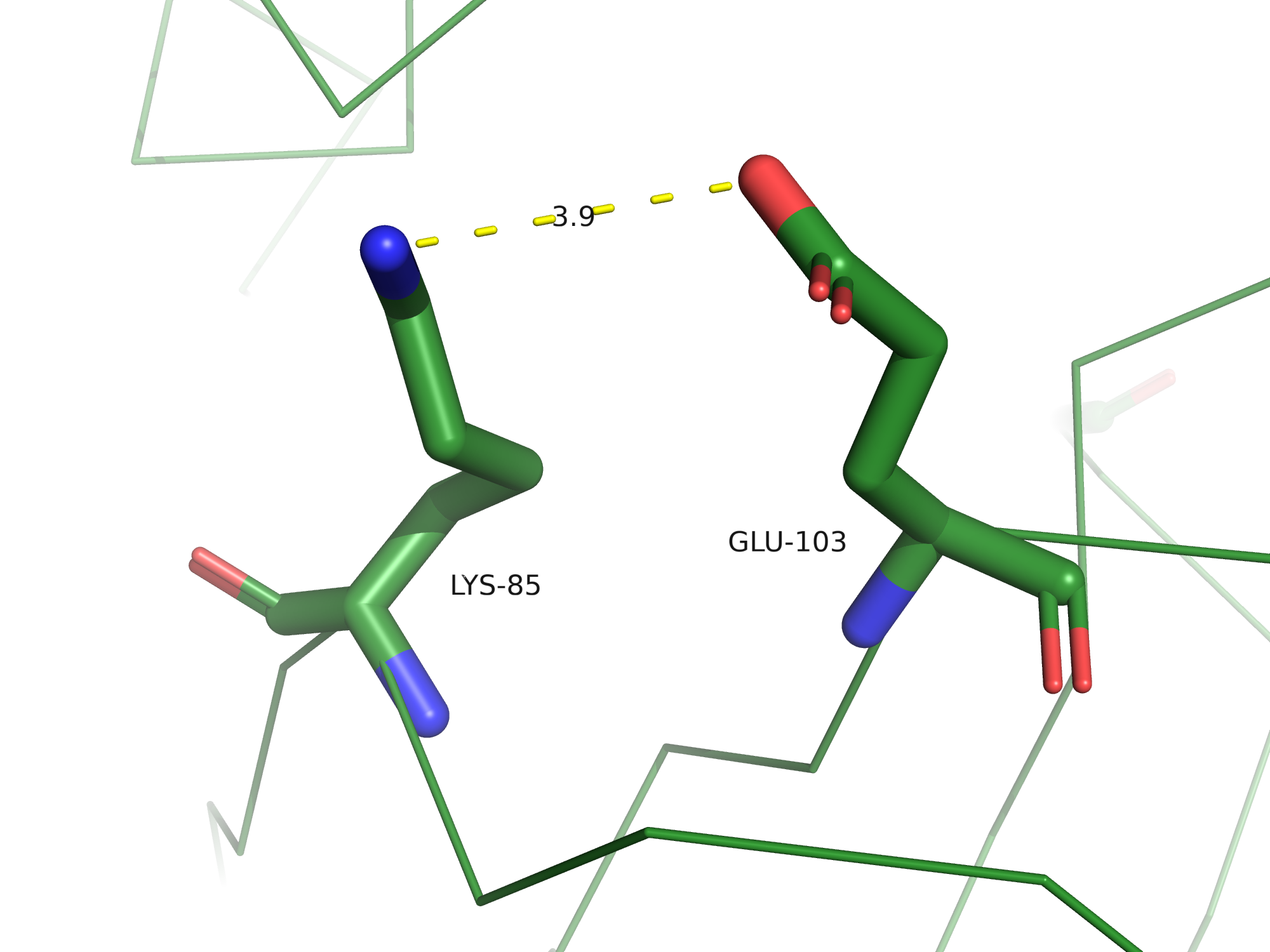
Солевые мостики - электростатические взаимодействия между положительно заряженными остатками
Lys, Arg и His и отрицательно заряженными остатками Asp и Glu, по длине не превышающие 4,5 Å.
В 3FFU можно найти солевые мостики, всего их было обнаружено 7 на цепи B.
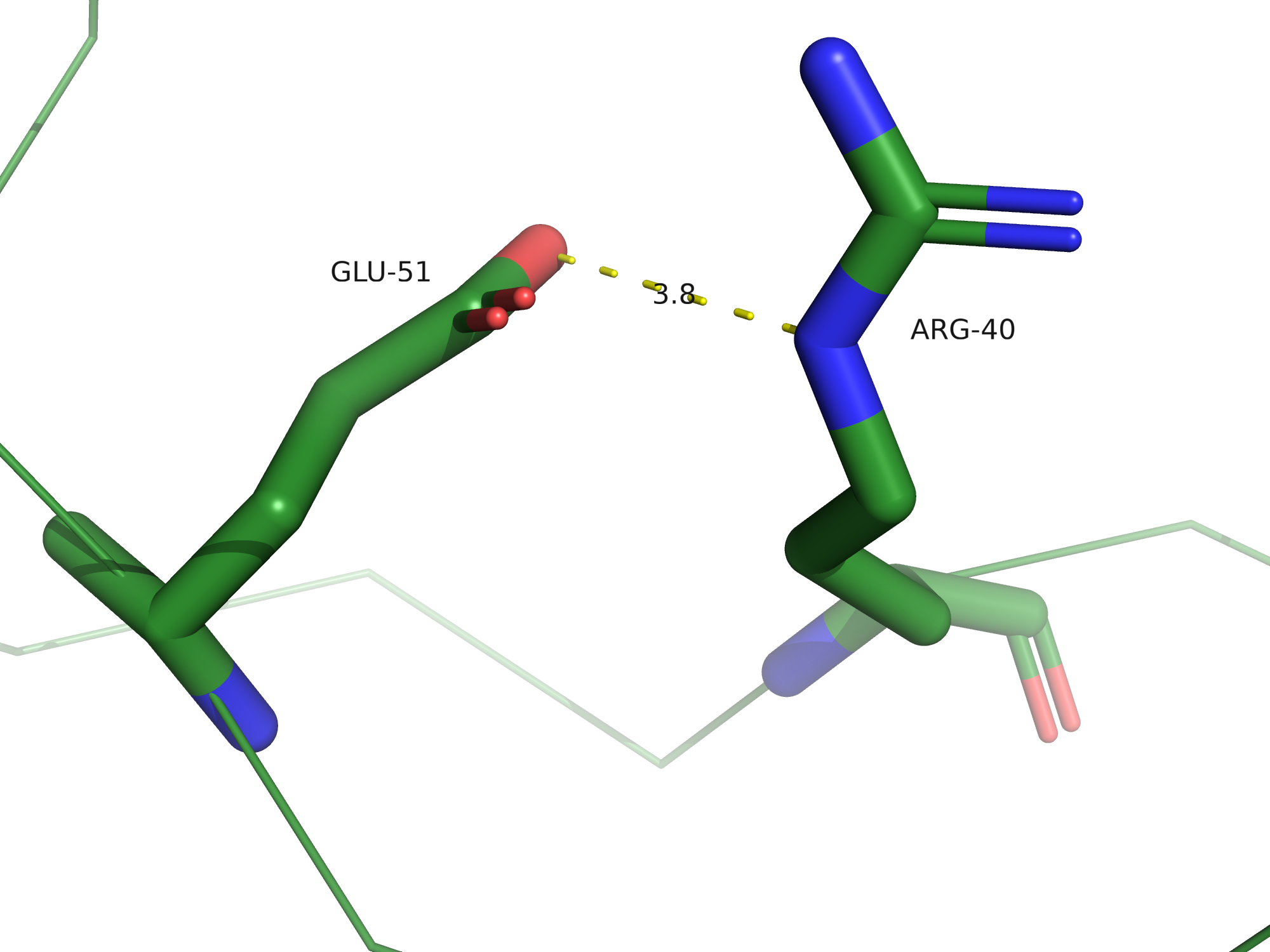
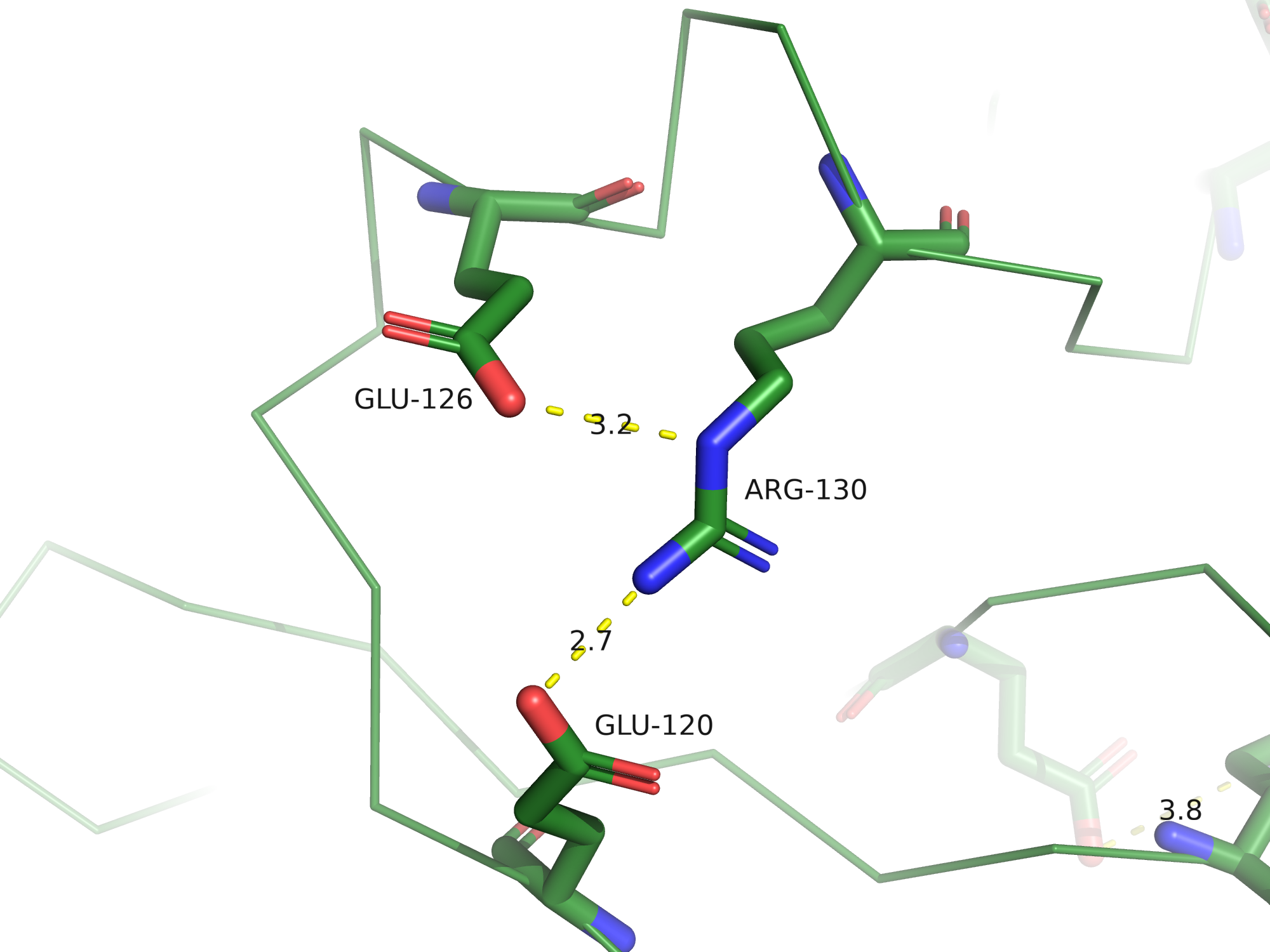
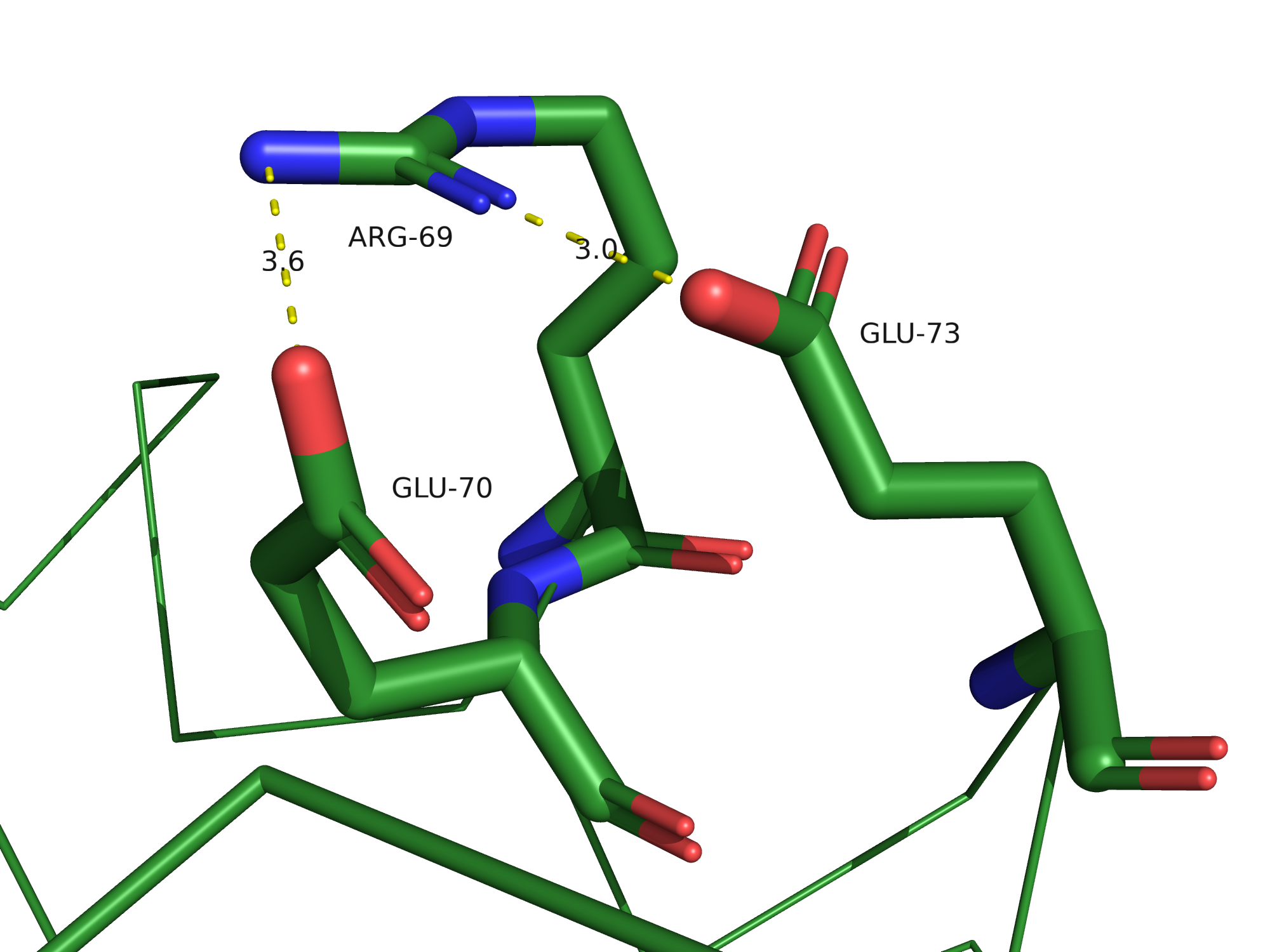
Дисульфидная связь
Дисульфидная связь отсутствует, так как на каждой из цепей расположено по 1 Cys (и между собой
их радикалы не образуют связь, так как остатки отдалены).
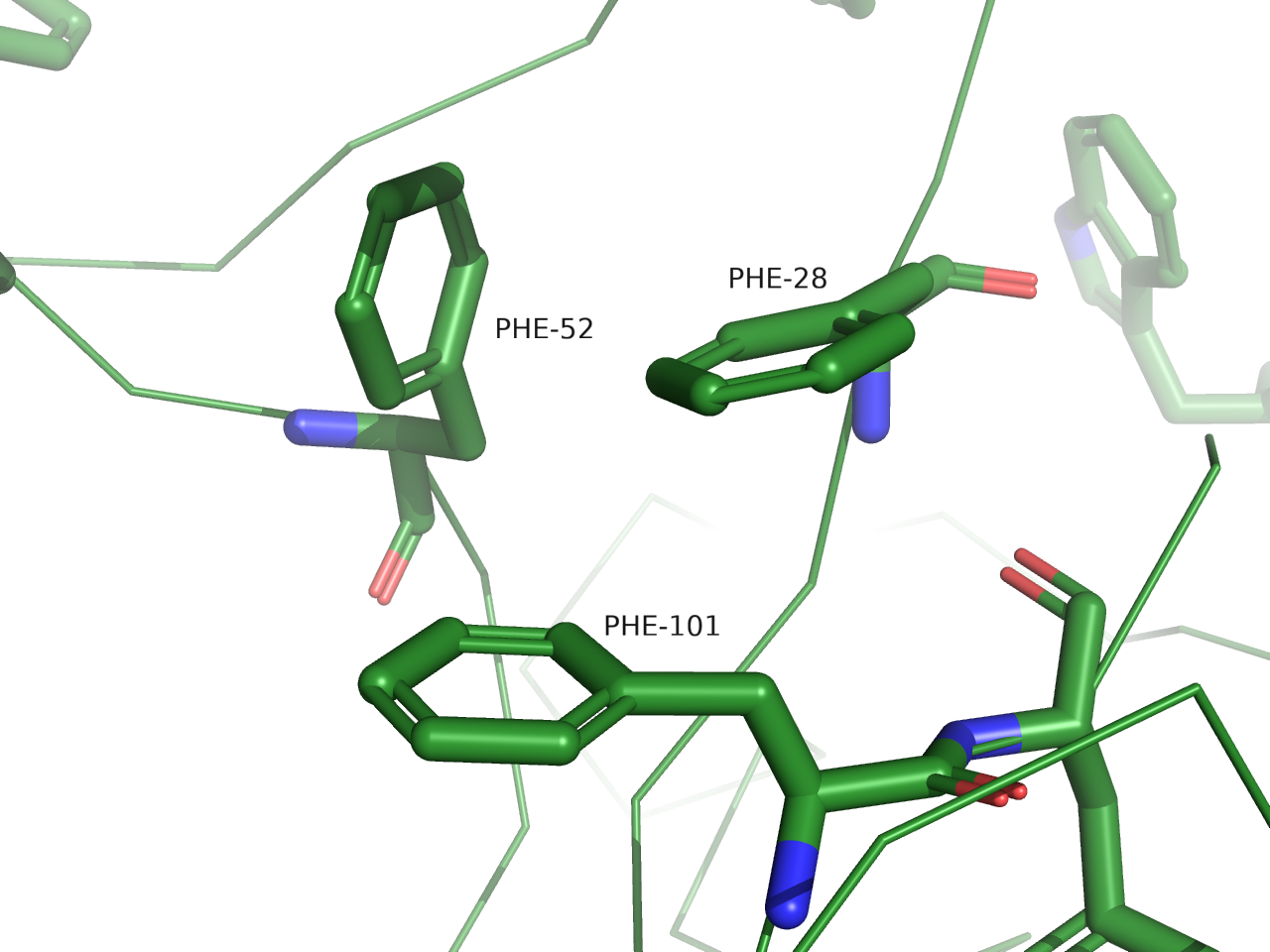
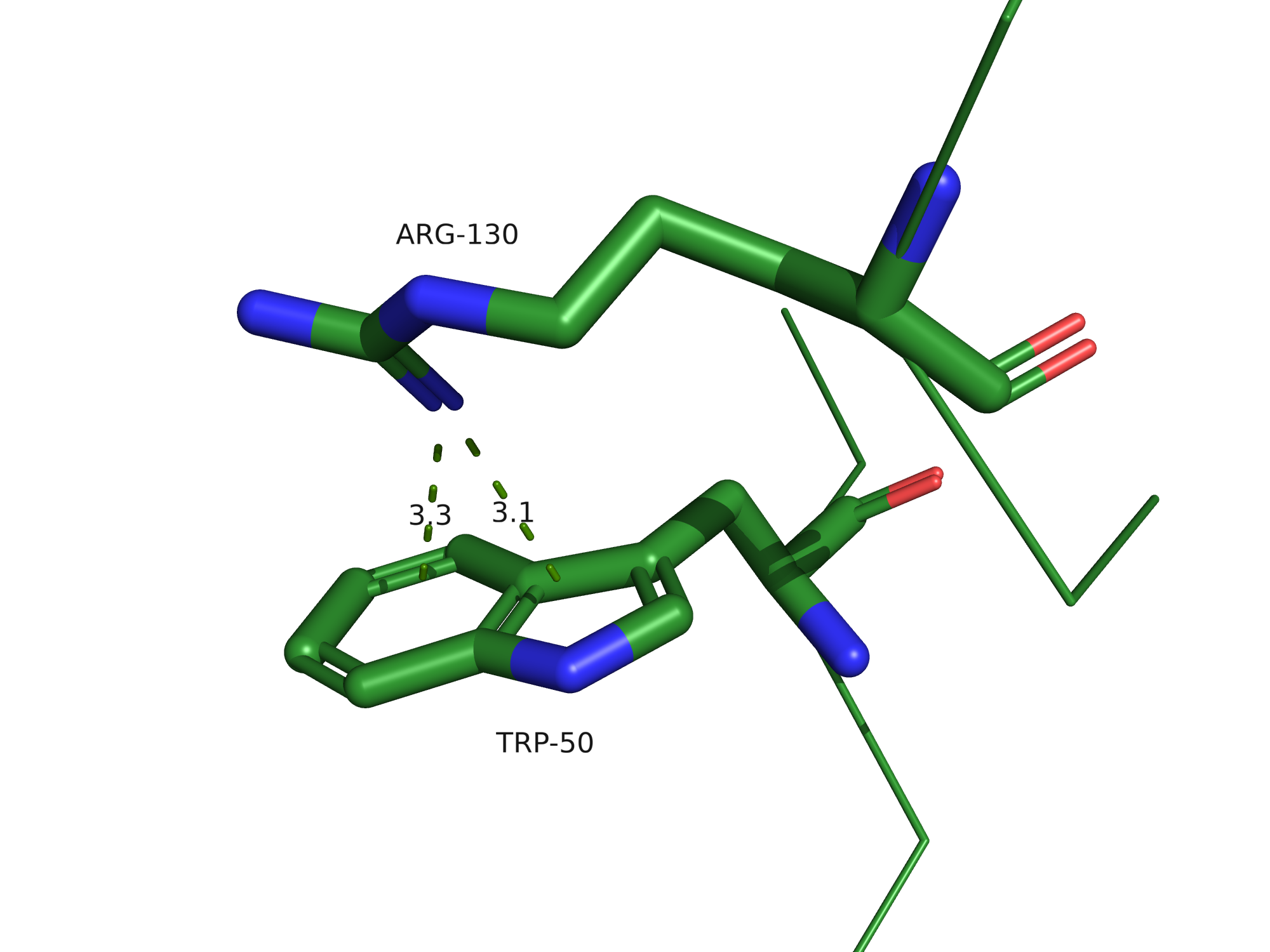
Стекинг