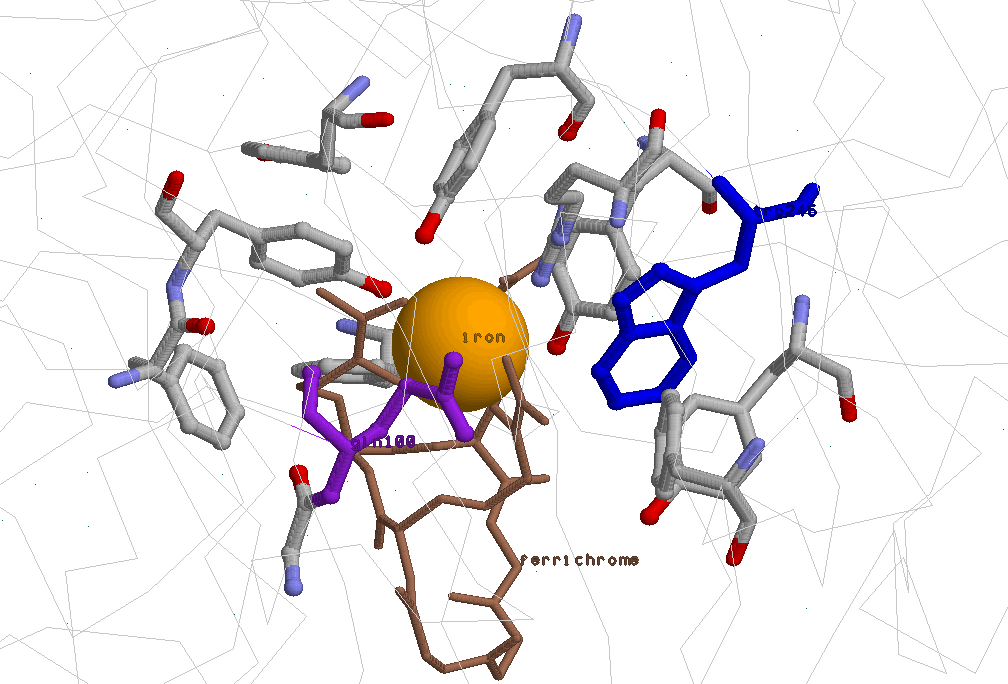
Остов белковой цепи изображён тонкими серыми линиями, показаны лиганд ferrichrome (цепь B белка), ион железа (iron) — оранжевый шарик в центре; аминокислотные остатки цепи A, контактирующие с лигандом, показаны в проволочной модели и раскрашены "по атомам". Два из них — Gln100 и Trp246, используемые для описания генно-инженерного эксперимента, выделены фиолетовым и синим цветами.