- EC 5.Изомеразы Ферменты, катализирующие изменения внутри одной молекулы.
- EC 5.4 Внутримолекулярные Трансферазы Ферменты, переносящие функциональные группы (ацил-, фосфо-, амино-, гидрокси- или другие) из одного положения в другое внутри одной молекулы.
- EC 5.4.2 Фосфортансферазы (Фосфомутазы) Переносят фосфатную группу. При этом фермент имеет донорную
фосфатную группу, которая необходима при протекании изомеризации через бифосфорилированный интермедиат. Ниже приведена реакция
изомеризации молекулы АР в молекулу ВР посредством фосфотрансферазы Е-Р. Бифософрилированный интермедиат показан как Х-(Р)2
E-P + AP = E + X-(P)2
X-(P)2 + E = BP + E-P
- EC 5.4.2.1 фосфоглицерат мутазы
- ((([uniprot-AllText:EC*] & [uniprot-AllText:5.4.2.1]) | [uniprot-AllText:EC 5.4.2.1]) & [uniprot-ID:*_ECOLI*])
- ((([uniprot-AllText:EC*] & [uniprot-AllText:5.4.2.1]) | [uniprot-AllText:EC 5.4.2.1]) & (([uniprot-Organism:Picrophilus*] & [uniprot-Organism:torridus*]) | [uniprot-Organism:Picrophilus torridus*]))
- ((([uniprot-AllText:EC*] & [uniprot-AllText:5.4.2.1]) | [uniprot-AllText:EC 5.4.2.1]) & [uniprot-ID:*_HUMAN*])
Характеристики:
1. число указанных ферментов в каждом из трех организмов:
- Escherichia coli - 3 последовательности (GPMA_ECOLI, GPMB_ECOLI, GPMI_ECOLI)
- Picrophilus torridus - 1 последовательность (APGM_PICTO)
- Human - 3 последовательности (PGAM1_HUMAN, PGAM2_HUMAN, PMGE_HUMAN)
2. названия доменов Pfam в найденных последовательностях, ответственных за данную ферментативную активность:
- Escherichia coli Для белков GPMA_ECOLI и GPMB_ECOLI это домен PF00300 (Phosphoglycerate mutase),
для белка GPMI_ECOLI за данную ферментативную активность отвечают два домена: PF06415 (BPG-independent PGAM N-terminus (iPGM_N)) и PF01676 (Metalloenzyme);
- Picrophilus torridus За данную ферментативную активность белка APGM_PICTO отвечают домены: PF10143
(2,3-bisphosphoglycerate-independent phosphoglycerate mutase) и PF01676 (Metalloenzyme);
- Human Для всех белков это домен PF00300 (Phosphoglycerate mutase).
3. результаты сравнения последовательностей двух ферментов, наиболее далеких по последовательностям (APGM_PICTO и PGAM1_HUMAN):
С помощью программы needle было сделано парное выравнивание наиболее, на мой взгляд, разнящихся ферментов из данной выборки. Видно, что последовательности сильно отличаются. V�>
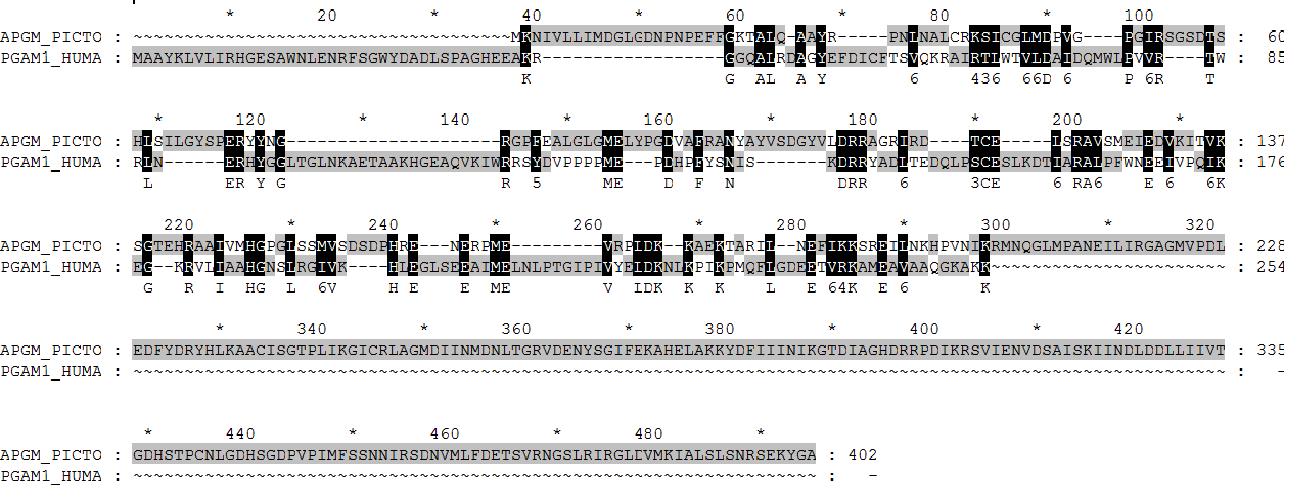
4. вывод о гомологичности – домены, отвечающие за одну и ту же ферментативную активность могут быть не родственны
Результаты исследования :
| Фермент 1 (Escherichia coli , P62707) | Фермент 2 (Escherichia coli , P0A7A2) | Фермент 3 (Escherichia coli , P37689) | Фермент 4 (Picrophilus torridus, AC последовательности) | Фермент 5 (Human,P18669) | Фермент 6 (Human,P15259) | Фермент 7 (Human,P07738) | ||
| Идентификатор, название домена Pfam | Положение в последовательности | Положение в последовательности | Положение в последовательности | Положение в последовательности | Положение в последовательности | Положение в последовательности | Положение в последовательности | |
| Домен 1 | PF00300 (Phosphoglycerate mutase) | 5-191 | 3-157 | 5-193 | 5-193 | 5-195 | ||
| Домен 2 | PF06415 (BPG-independent PGAM N-terminus (iPGM_N)) | 4-363 | ||||||
| Домен 3 | PF01676 (Metalloenzyme) | 373-489 | 268-373 | |||||
| Домен 4 | PF10143 (2,3-bisphosphoglycerate-independent phosphoglycerate mutase) | 38-256 |