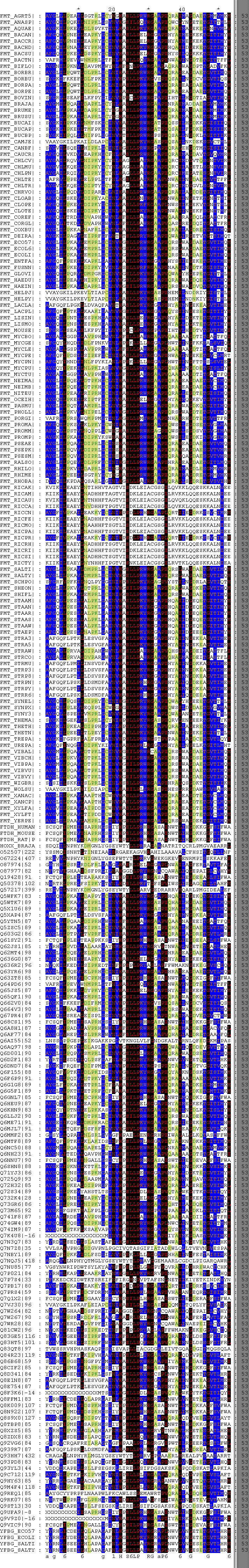

 |
 |
| Пара аминокислот (α — β) | nαβ | pαβ | qα | qβ | sαβ | |||||
| аспарагин — аспарагин | 20855 | 0,014629 | 0,03383 | 0,03383 | 7,352248 | |||||
| аспарагин — глутамин | 6950 | 0,004875 | 0,03383 | 0,031938 | 2,347712 | |||||
| аспарагин — гистидин | 3409 | 0,002391 | 0,03383 | 0,034613 | 0,060264 |
Условные обозначения:
N — общее число пар;
nαβ — общее количество пар в выравнивании;
pαβ — частота пары;
qα — частота аминокислоты α из данной пары;
qβ — частота аминокислоты β из данной пары;
sαβ — вес аминокислотной замены.
Формулы для вычисления весов замен:
N = 1425558;
pαβ = nαβ/N;
qα = pαα + ½∑i=1i=19(pαβi);
sαα=2log2(pαα/qα2);
sαβ = 2log2(pαβ/(2qαqβ)).
| Пара аминокислот | nαβ | pαβ | qα | qβ | sαβ | |||||
| аспарагин — аспарагин | 1224888 | 0,005345 | 0,033804 | 0,033804 | 4,451428 | |||||
| аспарагин — глутамин | 684903 | 0,002989 | 0,033804 | 0,039976 | 0,290218 | |||||
| аспарагин — гистидин | 408389 | 0,001782 | 0,033804 | 0,021623 | 0,57143 |
Условные обозначения и расчётные формулы те же, только N = 229168446.
| Пара аминокислот | Блок IPB005793 | 200 блоков | BLOSUM62 | |||
| аспарагин — аспарагин | 7 | 4 | 6 | |||
| аспарагин — глутамин | 2 | 0 | 0 | |||
| аспарагин — гистидин | 0 | 1 | 1 |
Данные, полученные на основании 200 блоков больше похожи на данные из таблицы blossum, чем данные, полученные на основании одного моего блока.
Видимо, есть общие закономерности весов аминокислотных замен, обнаруживаемые при сравнении данных по группам белков, скомпанованным при одинаковых требованиях к кластеризации (одинаковом максимальном проценте идентичности). Отклонения от этих закономерностей
Предлагая нам это зачётное задание, видимо от нас ожидали подтверждения
на примере трёх аминокислот следующей, насколько я понял, прописной истины: вес замены
одной аминокислоты на другую тем больше, чем ближе эти аминокислоты по физико-химическим
свойствам; кроме того вес замены аминокислоты на саму себя больше, чем вес замены на другую,
сколь угодно близкую ей, аминокислоту.
Откуда следует приведённое утверждение?
Оно, скорее всего, обосновывается следующим образом:
Если две аминокислоты сильно отличаются по строению и свойствам,
то, следовательно, одна из аминокислот не может выполнять ту роль в
формировании структуры, функциональных центров белка, которую выполняют другая, а та,
в свою очередь, не может быть равноценной заменой для первой.
Такие замены зачастую приводят к изменению, или даже потере функциональной активности белка
и оставляются эволюцией только в том случае, если такие мутации оказываются нейтральными
или полезными для вида, что происходит в меньшинстве случаев и чаще в тех белках,
дисфункция и удаление которых не приводят к летальному для организма исходу.
Проанализируем данные по близким гомологам — аминокислотам аспарагину и глутамину.
Данные таблицы подтверждают, что вес замены аспарагина на аспаргин превышают вес замены
аспарагина на глутамин, несмотря на их сильное сходство. Это наблюдение согласуется с
теорией, в отличие от следующего.
¡NB Исходя из изложенных выше соображений можно предположить, что вес замены аспарагина на
гистидин должен быть меньше, чем вес замены аспарагина на глутамин, и эта разница должна
проявляться тем более явно, чем больше выборка. Но это не так! В действительности это предположение
подтверждается лишь данными моего блока, а данными, полученными на основании куда большей
выборки, не подтверждаются. Почему? NB!
У меня есть догадка по этому поводу. Разница между значениями
аспарагина и гистидина по шкале гидрофобности не намного меньше, чем разница между
аспарагином и глутамином. Всё это умеренно гидрофильные аминокислоты. Однако кодоны,
соответствующие аспарагину больше похожи на кодоны, соответствующие гистидину, чем на
кодоны, соответствующие глутамину:
Доля прижившихся мутаций α→β среди всех прижившихся замен
α→X, где X=α или X≠α, видимо, зависит не только (i)от того,
какова доля прижившихся замен с конкретной аминокислоты α на конкретную
аминокислоту β среди всех спонтанно произошедших замен α→β, мерой
чего является близость этих аминокислот, но и (ii) от доли спонтанно происходящих в течение
некоторого промежутка времени мутаций α→β среди всех происходящих с течение
этого промежутка времени замен α→X, что может быть, с определённой степенью
достоверности, выяснено на основании конкретных химических данных о термодинамике и кинетике
различных форм мутагенеза ДНК.
Я полагаю, что веса замен между аминокислотами зависят от их структурной
и функциональной близости лишь отчасти, и на самом деле всё куда глубже и тоньше.
У науки нет широкой столбовой дороги.
©
LOUKIANOV MIKHAIL, 2005
His Asn Gln
CAT AAT CAA
CAC AAC CAG Мне кажется, в связи с этим замены с аспарагина на гистидин
должны происходить чаще,чем с аспарагина на глутамин (если принять замену аденина на цитозин
легче осуществимой, чем инверсия триплета с последующей заменой пиридинового нуклеотида на
пиридиновый или пиримидинового на пиримидиновый).