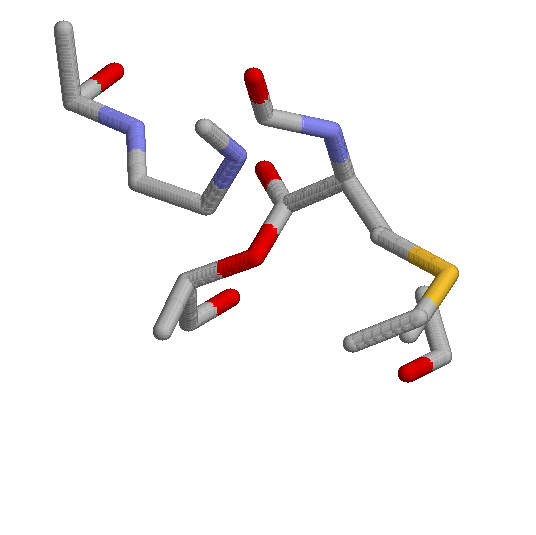
Слева от неё видна часть 89-го остатка полипептидной цепи А (аланин).
Справа внизу виден двухатомный фрагмент 14-го остатка полипептидной цепи А (фенилаланин). Они расположены ближе к наблюдателю, чем молекула N-формилметионина.
 |
Здесь изображена область контакта лиганда и белка.
В центре видна молекула N-формилметионина, ковалентно связанная с рибонуклеиновой цепью (C), небольшой участок которой также виден.
Слева от неё видна часть 89-го остатка полипептидной цепи А (аланин). Справа внизу виден двухатомный фрагмент 14-го остатка полипептидной цепи А (фенилаланин). Они расположены ближе к наблюдателю, чем молекула N-формилметионина. |
С молекулой fme контактируют следующие аминокислотные остатки: Phe 14, Val 88, Ala 89, Tyr 90, Ala 120. 89-й остаток сильно влияет на связывание с fme за счёт 1)водородной связи между атомом водорода при атоме азота этого остатка и атомом кислорода альдегидной группы N-формилметионина, 2)гидрофобных и вандерваальсовых взаимодействий между альфа-атомом углерода этого остатка и атомом углерода альдегидной группы N-формилметионина. Если заменить аланин на валин, скорее всего на связывание белка с N-формилметионином это не повлияет. Если заменить аланин на пролин, то при азоте не будет атома водорода, следовательно не будет водородной связи и вероятно связывание будет нарушено.
14-й остаток предположительно мало влияет на связывание цепи А данного белка с соответутвующей молекулой, так как вандер-ваалсовых и гидрофобные взаимодействия, которые имеют место между радикалом фенилаланина (двумя атомами) и fme, не настолько сильны при учёте расстояния между взаимодействующими участками и количества взаимодействующих атомов.
© LOUKIANOV MIKHAIL,2004