Занятие 9. Исследование белок-нуклеиновых контактов
- Исследование контактов между молекулами белка и нуклеиновой кислоты
- Поиск специфических контактов, обеспечивающих узнавание сайта в молекуле ДНК.
- Описание функций исследованного белка
- Построение схемы контактов белка с ДНК.
Таблица. Контакты разного типа в комплексе H2TH домена белка MutM с ДНК
| Полярные | Гидрофобные | Всего | |
| Контакты белка с ... | |||
| ... остатками 2'-дезоксирибозы | 8 | 13 | 21 |
| ... остатками фосфорной кислоты | 19 | - | 19 |
| ... остатками азотистых оснований со стороны большой бороздки | - | 3 | 3 |
| ... остатками азотистых оснований со стороны малой бороздки | 3 | 2 | 5 |
Если посмотреть структуру комплекса H2TH домена белка MutM с ДНК, то можно увидеть, что остатки фосфорной кислоты торчат наружу из ДНК
и ближе расположены к белку. Поэтому более вероятно, что белок будет образовывать связи именно с ними, и эти связи будут служить для
прикрепления ДНК к белку и её удерживания. Функция белка MutM - base-excision repair, т.е. репарация ДНК, а в частности, первоначальная функция
белка - замена "неправильных" азотистых оснований. Поэтому логично предположить, что аминокислотные остатки белка в активном центре
(скорее всего он находится на уровне между 426 и 428 нуклеотидами ДНК) будут
связаны с азотистыми основаниями. Но так как активный центр занимает малое пространство по сравнению с участком ДНК-белок, следовательно
АК остатков, составляющих активный центр будет меньше АК остатков, удерживающих ДНК на белке. Как видно из таблицы, полярных связей
остатков фосфорной кислоты с белком больше, чем связей азотистых оснований с белком. Аналогично можно рассуждать и о связях
остатков сахара с белком по сравнению с азотистыми основаниями, так как связи остова с белком нужны в первую очередь для удерживания
нужного участка ДНК прямо напротив активного центра. Но все-таки, исходя из количества связей с остатками сахара по сравнению с остатками
фосфорной кислоты, можно сказать, что роль связи сахар - белок важнее чем с фосфорной кислотой. Также сахар принимает участие в
образовании связей в активном центре, что также влияет на их количество (т.к. активный центр занимает малое пространство). А неполярных связей
фосфорная кислота - белок в принципе быть не может, так как фосфорная кислота не содержит в себе неполярных атомов.
Белок MutM участвует в процессе base-excision repair, при котором он ищет "неправильные" (это могут быть модифицированные, неправильно спаренные и т.п.) азотистые основания. Такое основание, в виду того, что оно не подходит к противоположному "правильному" основанию либо образует нехарактерные водородные связи, тем самым локально чуть чуть меняя конформацию ДНК. Это изменение в положении азотистого основания влечет за собой изменение положения остова ДНК (выпячивание наружу, например) в таком участке. Белок MutM, проходя через это место, улавливает изменение пространственного положения остова и производит репарацию. Поэтому логично предположить, что в узнаваниии сайта связывания белка MutM с ДНК участвуют АК остатки, расположенные напротив активного центра, то есть так , что репарируемый участок ДНК находится между активным центром и АК остатками, которые участвуют в узнавании. Это, например, остаток GLU 2. Ниже приведена картинка связи этого остатка с фрагментом ДНК в шарнирной модели.
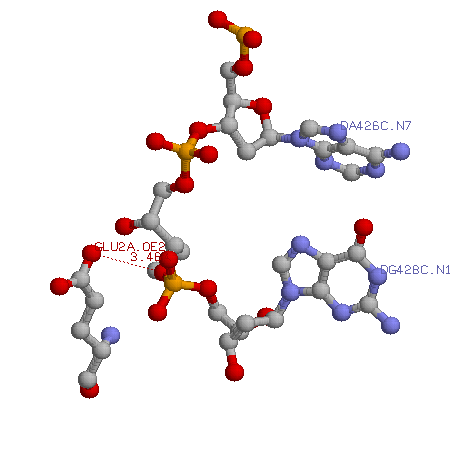 |
На рисунке виден участок между двумя нуклеотидами, где отщиплено азотистое основание - место репарации.
Белок MutM участвует в репарации ДНК, основанной на отщиплении азотистых оснований, поврежденных окислением или каким-либо мутагеном. Действует как ДНК-гликозилаза. Имеет некоторую специфичность к окисленным пиримидинам: thymine glycol, 5,6-dihydrouracil and 5,6-dihydrothymine. Создает ники в цепочке ДНК в процессе репарации. Может разрывать остов ДНК, создавая одноцепочечный разрыв на месте отщипленного основания.
Белок относится к семейству Formamidopyrimidine-DNA glycosylase (Fpg). Белки этого семейства являются участниками репарации ДНК,
отщипляющими окисленные пурины (2,6-diamino-4-hydroxy-5N-methylformamido- pyrimidine (Fapy) and 7,8-dihydro-8-oxoguanine (8-OxoG) )
поврежденной ДНК. Вдобавок к тому, что они обладают гликозилазной активностью, они также могут образовывать одноцепочечные разрывы на
АП-сайтах( от слов apurine/apirymidine, англ.). Семейство FPG - односубъединичные белки с весом около 32 кД, которым для нормального
функционирования нужен цинк (Zn). N-концевой участок имеет цинк-связывающий сайт.
Построено изображение схемы контактов между ДНК и белком, рисунок ниже
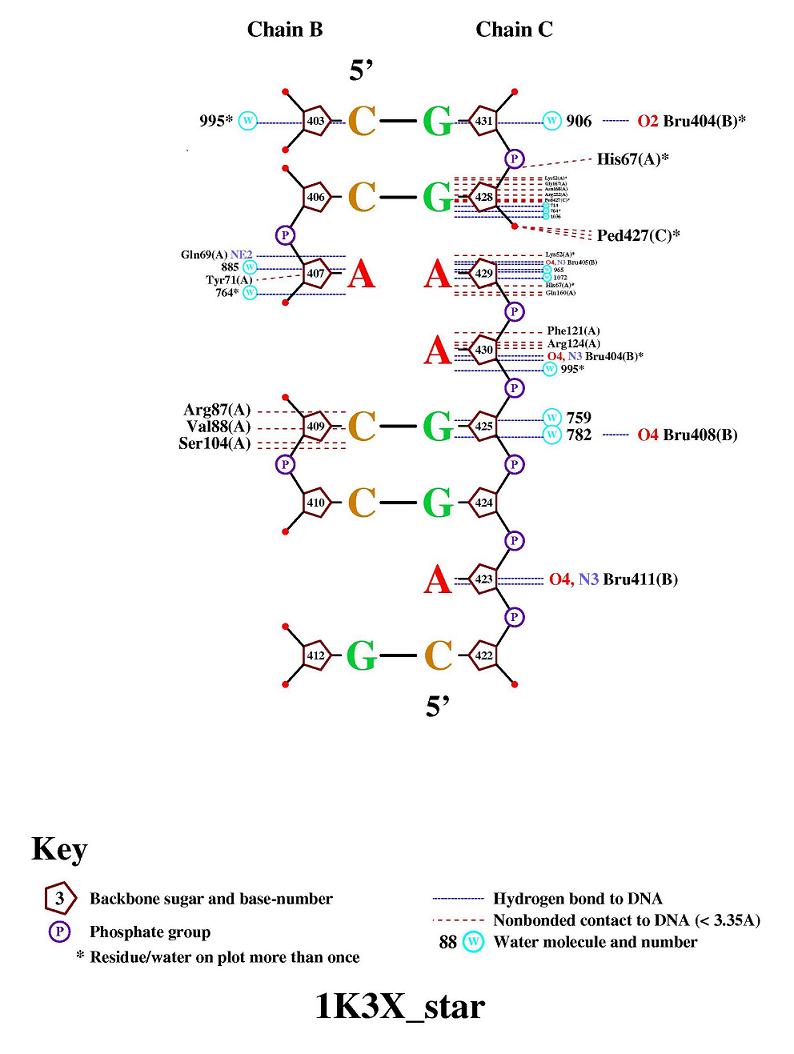
Были выявлены следующие различия между ручным определением контактов и результатом, выданным программой nucplot:
| Различия | Причины различия |
| программой nucplot отмечено 4 контакта (вручную они определены как полярные)с остатками сахара против 21 контакта ручного определения, не выявлено ни одного неполярного контакта | nucplot не видит нуклеотида BRU 408 (hetero), с которым есть 2 полярные связи видимо, по тем же причинам, что и ниже не определено еще 2 полярные связи с нуклеотидом G 428 |
| nucplot выявил 1 полярную связь с остатком фосфора против 19 связей, определеных вручную | это может быть связано с тем, что Raswin определяет атомы, находящиеся на расстоянии полярной связи, хотя для её образования нужно, чтобы один атом был акцептором, а другой донором протона |
| nucplot выявил минимум 28 связей с нуклеотидами против 8 связей, определеных вручную | причины неясны |
Общей причиной того, что nucplot выявляет меньше полярных связей могут быть более жесткие критерии образования связи в алгоритме этой программы. Например, для образования водородной связи помимо того, что расстояние между протоном (Н) и акцептором (А) должно быть меньше 2.7 ангстрем, расстояние донор (Д) - (А) <3.35 ангстрем, нужно еще, чтобы углы были следующие: Д-Н-А >90 градусов , Н-А-АА >90 градусов, где АА - атом, присоединенный к акцептору. Дополнительную информацию можно посмотреть по ссылке: http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=147160&blobtype=pdf
Замечено, что nucplot выявил еще 2 контакта "через воду" с азотистыми основаниями нуклеотидов G 425 & G 431 (см. рис. выше).