 Водородных связей: 300
Водородных связей: 300 α-спиралей: 20
β-тяжей: 17
β-листов: 4
β-поворотов: 15
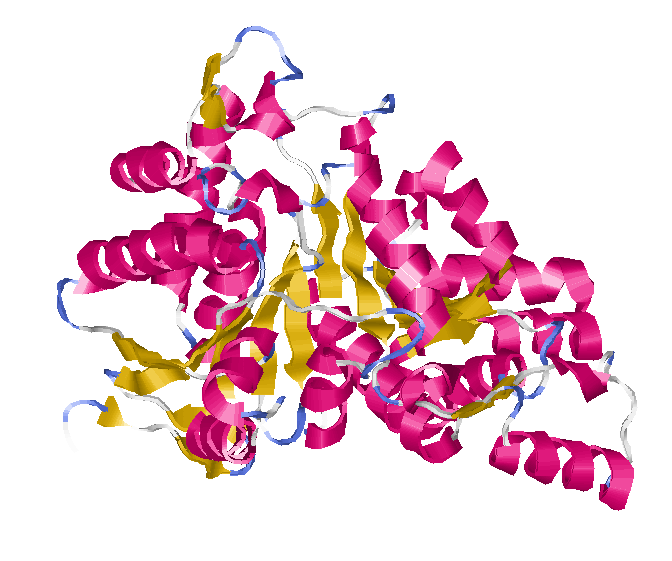
IDH_Bacsu относится к α/β-белкам, т.к наблюдается упорядоченная структура из чередующихся α-спиралей и β-тяжей.
Самая длинная спираль: TRP A 30 - LYS A 51;
Самый длинный β-тяж: SER A 185 - SER A 193; но для исследования я выбрала другой (ALA A 339 - ALA A 343), т.к. этот не соседствует с 2мя другими β-тяжами.
Самая длинная пара соседних антипараллельных β-тяжей: ALA A 339 - ALA A 343; PRO A 328 - ILE A 332;
Самая длинная пара соседних параллельных β-тяжей: PRO A 328 - ILE A 332;
Петля, в которой полипептидная цепь круто разворачивается на 180': ARN A 11 - GLY A 12;
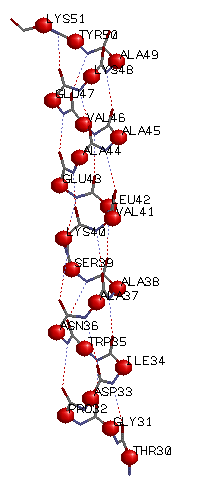
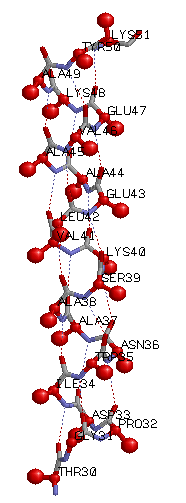 Паттерн Н-связей: Н(30,34); H(31,35); H(32,36); H(33,37);
H(34,38); H(35,39); H(36,40);
Паттерн Н-связей: Н(30,34); H(31,35); H(32,36); H(33,37);
H(34,38); H(35,39); H(36,40); H(37,41); H(38,42); H(39,43); H(40,44); H(41,45); H(42,46); H(43,47); H(44,48); H(45,49); H(46,50); H(47,51);
Из приведённых выше значений видно, что обобщенный паттерн Н-связей можно записать в виде: Н(k,k+4), где k натуральное число, причем k изменяется от 30 до 47.
В структуре все Cβ-атомы находятся "снаружи" спирали.
Маленькими красными шариками помечены Cα, большими - Cβ.
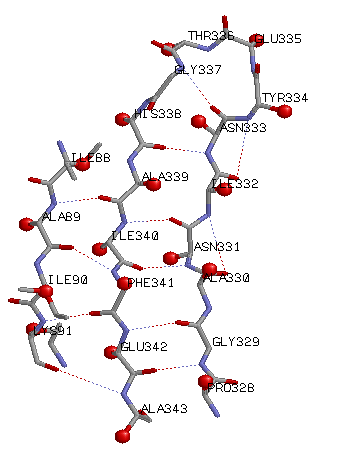
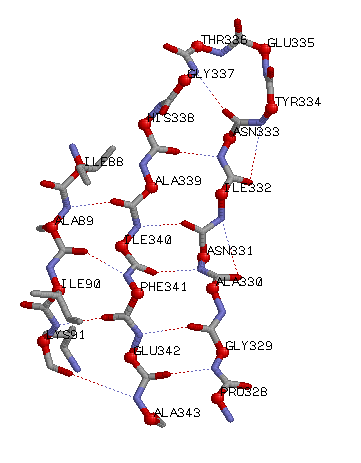 Маленькими шариками показаны Cβ.
Cβ выходят за плоскость β-листа.
Маленькими шариками показаны Cβ.
Cβ выходят за плоскость β-листа.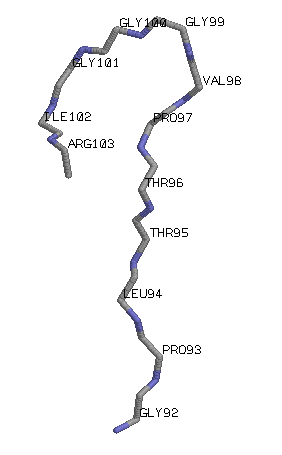 Выбранный
Cβ-поворот - Val98Gly99Gly100Gly101.
Выбранный
Cβ-поворот - Val98Gly99Gly100Gly101. Н-связи, "скрепляющей" поворот, не наблюдается.