
|
| главная страница | первый семестр | второй семестр | |
Общее описание вторичной структуры RSGA_BACSU |
|
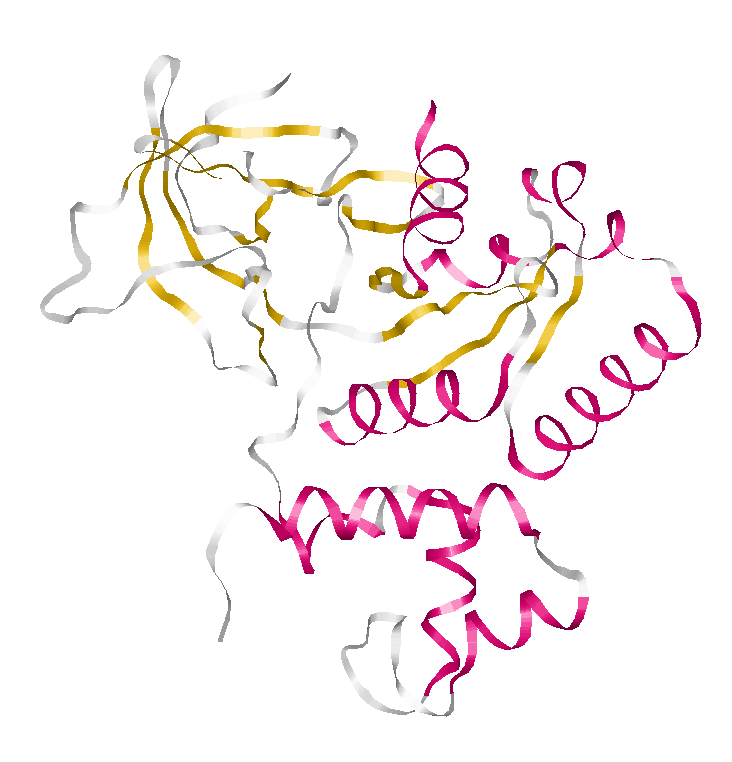 |
Описание по файлу PDB (записи HELIX и SHEET) :
Описание по алгоритму DSSP:
|
Выбранные элементы вторичной структуры |
|
 |
α-спираль: Цепь A. Участок 123-141(19 остатков). |
 |
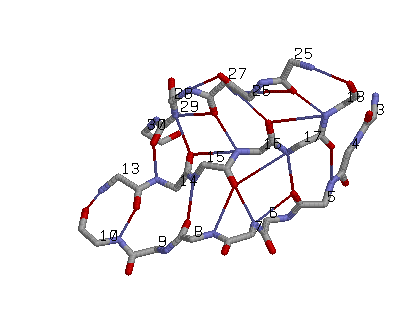
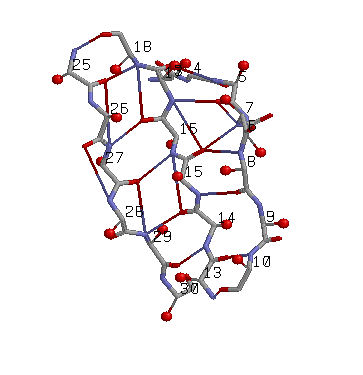
антипараллельный β-слой: три соседних антипаралельных β-тяжа: участки (3-10), (13-18), (25-30) цепи A |
 |
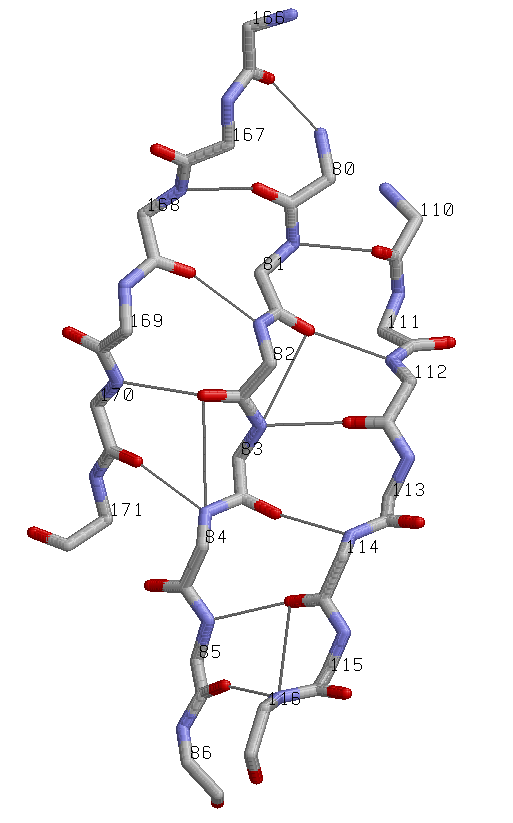
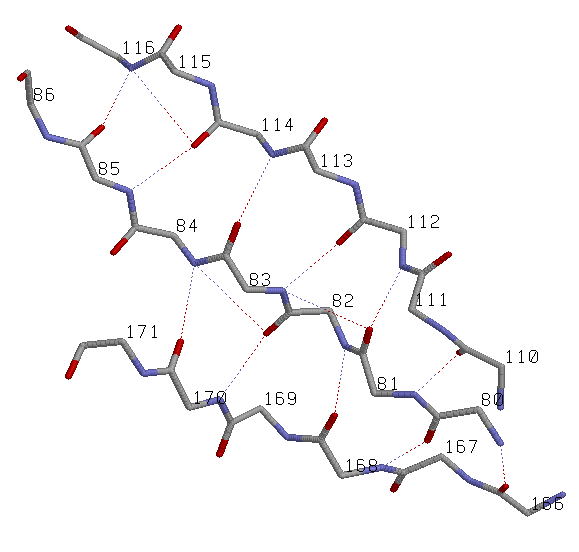
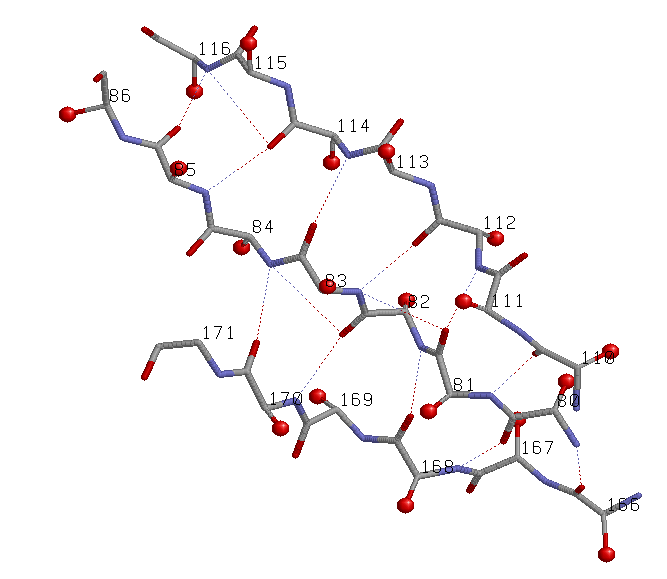
параллельный β-слой: три соседних параллельных β-тяжа: участки (110-116), (80-86), (166-171) цепи A |
 |
Поворот: был выбран реверсивный поворот (19-24) между антипараллельными тяжами (13-18) и (25-30) цепи A, соединенными между собой |
 |
Алгоритм DSSP, используемый программой RasMol, определяет на этом участке следующий поворот: 20-24 остатки цепи A. |
Иллюстрация свойств выбранной α-спирали |
|
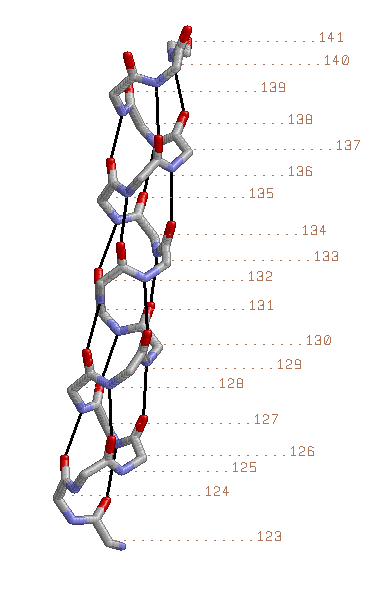 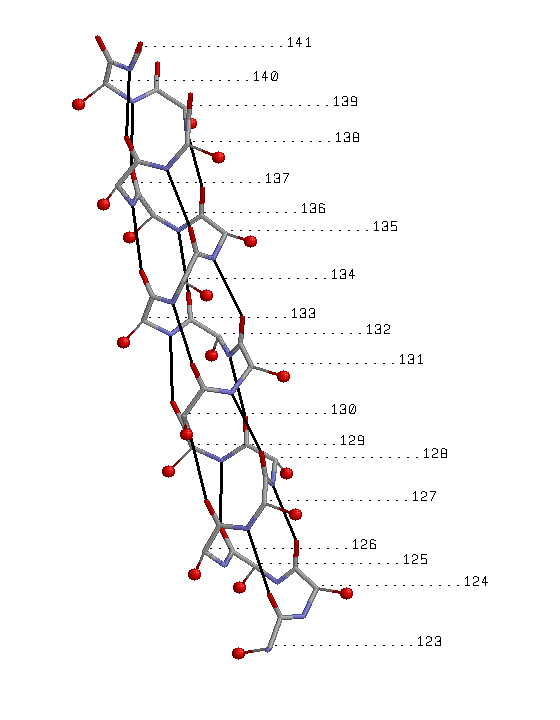 |
Рисунок1. Остов выбранной α-спирали представлен в толстой проволочной модели ( wireframe 50) с раскраской по атомам; показаны водородные связи между атомами остова(черный цвет); около каждого атома Сα указан номер остатка Рисунок 2. Уменьшена толщина проволочной модели, добавлены атомы Сβ в виде небольших красных шариков, соединенных тонкими линиями с атомами Сα |
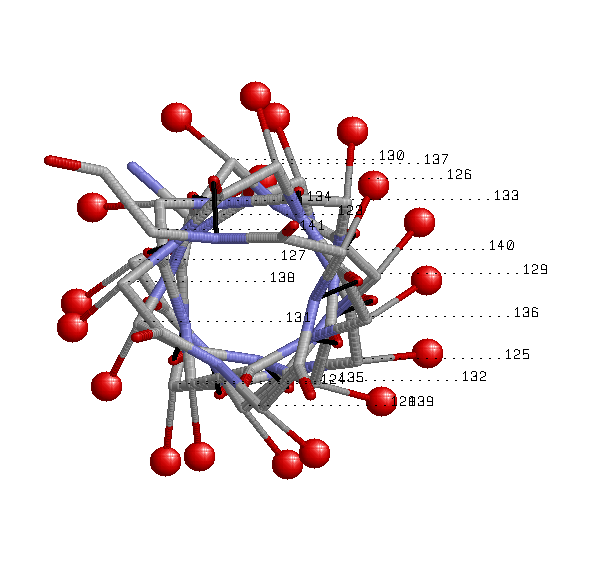 |
Спираль имеет правильную форму. Все Cβ располагаются снаружи спирали И напрвлены к N-концу спирали(кроме Cβ концевых остатков спирали). Паттерн водородных связей: i+4(по изображению видно, что каждый i-й остаток(i ∈ [123;137]) спирали соединен с (i+4)-м остатком). |
Иллюстрация свойств выбранного антипараллельного β-тяжа |
|
 |
|
 |
|
Иллюстрация свойств выбранного параллельного β-тяжа |
|
 |
|
 |
|
 |
|
Реверсивный поворот |
|
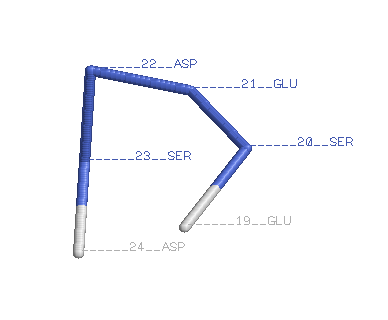 |
Остовная модель(backbone). Около каждого атома Сα. Имя остатка и его номер. |
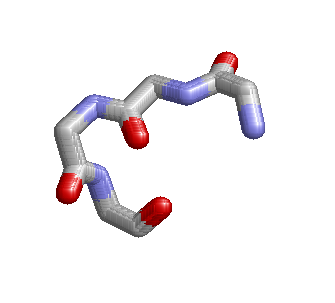 |
Выбранный поворот(4 остатка) — Ser20Glu21Asp22Ser23 В данном повороте программа RasMol не показывает водородную связь. |