-
Последовательность белка RSGA_Bacsu в формате FASTA
>sp|O34530|RSGA_BACSU Catabolite control protein A
MPEGKIIKALSGFYYVLDESEDSDKVIQCRGRGIFRKNKITPLV
GDYVVYQAENDKEGYLMEIKERTNELIRPPICNVDQAVLVFSAVQPSFSTALLDRFLV
LVEANDIQPIICITKMDLIEDQDTEDTIQAYAEDYRNIGYDVYLTSSKDQDSLADIIP
HFQDKTTVFAGQSGVGKSSLLNAISPELGLRTNEISEHLGRGKHTTRHVELIHTSGGL
VADTPGFSSLEFTDIEEEELGYTFPDIREKSSSCKFRGCLHLKEPKCAVKQAVEDGEL
KQYRYDHYVEFMTEIKDRKPRY - Длина последовательности - 298 аминокислотных остатков
-
Молекулярная масса белка RSGA_Bacsu - 33802 а.е.м.
Подробнее см. книгу Credit.xls, лист MW. -
Аминокислотный состав белка RSGA_Bacsu:
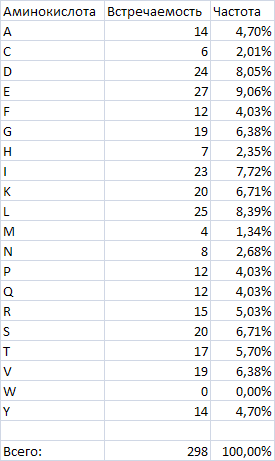
Самые частые аминокислотные остатки - E(27), L(25), D(24), I(23).
Самые редкие аминокислотные остатки - M(4), C(6).
Совсем не встречается - W.
-
Средний электрический заряд молекулы белка = -12.5 e.
Пояснения: Согласно исследованям, при рН=7.0 боковые группы аргинина
и лизина имеют средний заряд, равный (+1)е,гистидина – (+0.5)е, остатки ас-
парагиновой и глутаминовой кислот - (-1)е,а остальные аминокислотные ос-
татки практически не заряжены.
-
Сравнение со средним аминокислотным составом белков Bacillus subtilis. а также с аминокислотным составом мембранных белков этой же бактерии.
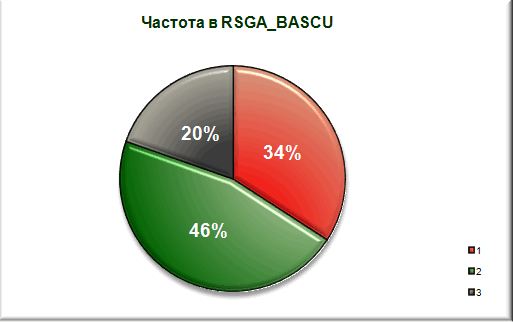
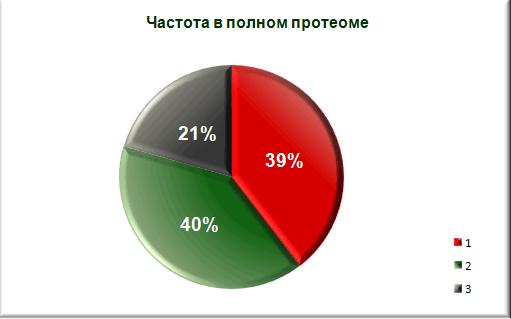
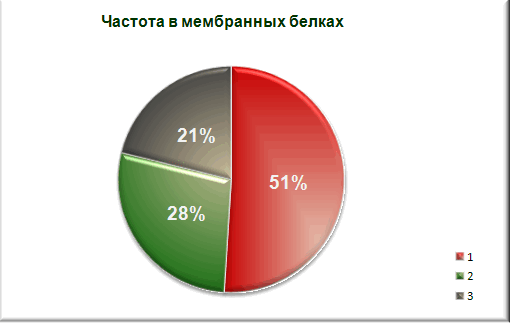
1 - явно гидрофобные аминокислотные остатки(а.о.)
2 - явно гидрофильные а.о.
3 - остальные а.о.
Вывод: процент содержания явно гидрофобных аминокислотных остатков меньше чем в протеоме
и гораздо меньше чем в среднем мембранном белке. Можно с уверенностью сказать, что белок не является мембранным. -
Дополнительные исследования.
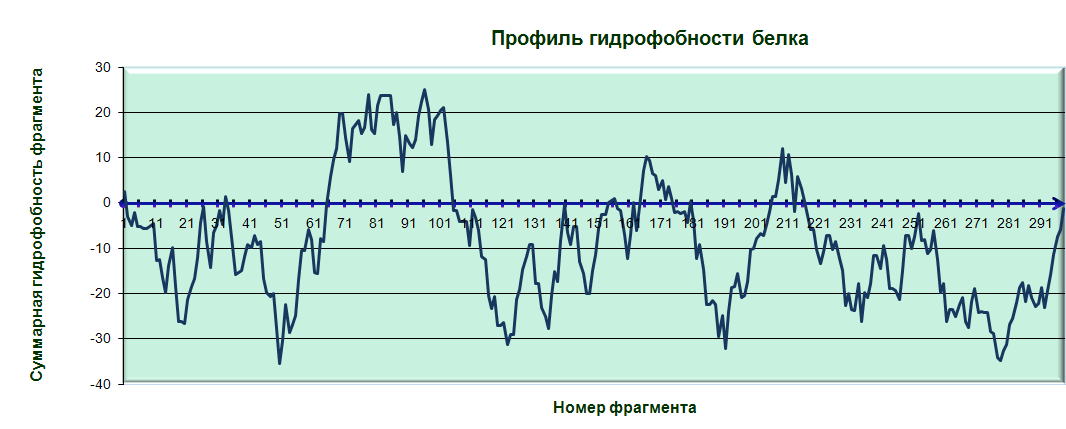
RSGA_Bacsu содержит гидрофобный участок из ~40 остатков(~65-~105:A).
Это также говорит о немембранной природе белка.