PyMOL
Задание 1
Для выполнения задания была дана структура с PDB ID 6HMQ (каталитическая субъединица протеинкиназы CK2) и следующие два аминокислотных остатка с альтернативными положениями: PHE122, TYR126.
На рисунке 1 показаны сразу все сочетания конформаций остатков. Очевидно, невозможно сочетание конформаций PHE A и TYR B, так как их структуры перекрываются. Сами боковые остатки мало с чем взаимодействуют, однако есть pi-pi связь между PHEB и HIS, за счет этого альт-лок B для фенилаланина кажется более стабильным и возможным. У тирозина нет заметных взаимодействий, к тому же, при конформации PHE B он может занимать любую позицию без пересечения. Таким образом, наиболее вероятны сочетания конформаций PHEB-TYRA и PHEB-TYRB.
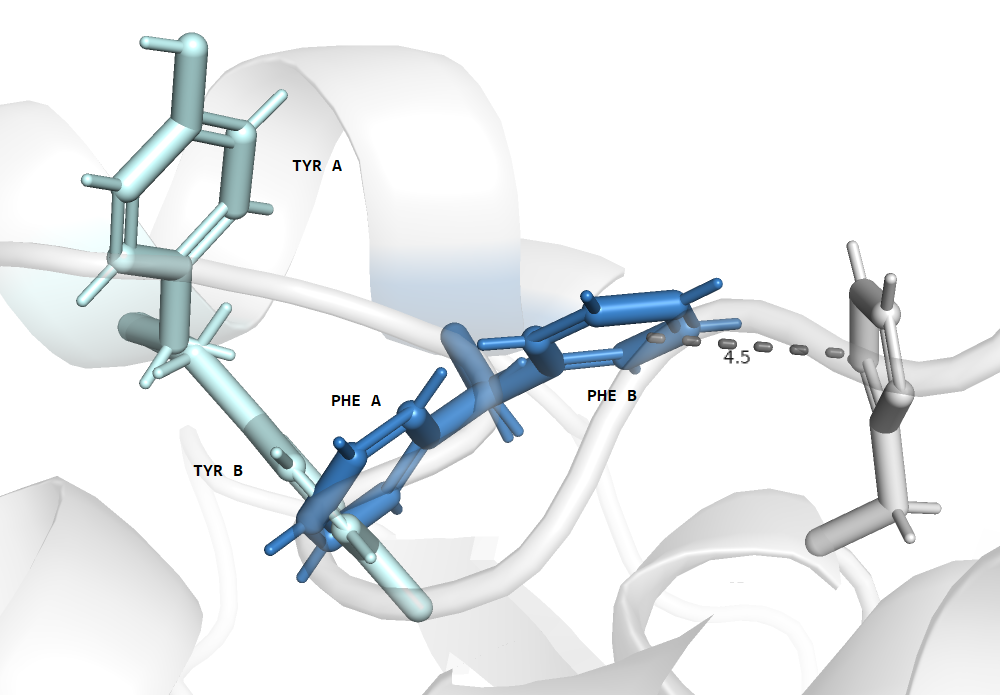
Согласно данным из PDB-файла, для PHE122 населенность альтернативного положения (B) равна 0.65, а для TYR126 (B) - 0.51. Эти данные согласовываются с предположениями выше. Альтернативное положение для фенилаланина более вероятно из-за стекинга, а положение для TYR не имеет предпочтения. Ссылка на сессию PyMOL здесь.
Задание 2
Атомы структуры 6HMQ были покрашены по B-фактору (рисунок 2). Чем выше значение B-фактора, тем краснее атом. На данной структуре красным изображена одна петля и два конца остова. Вероятно, это наиболее гибкие и непостоянные в расположении участки. Заметно, что наиболее синими являются атомы, “сидящие” в центре молекулы.

Далее по B-фактору была покрашена вся структура, включая боковые цепи. Был выбран аминокислотный остаток ARG 90, окончание бокового радикала которого резко меняло цвет на красный. Для него была построена электронная плотность на разных уровнях подрезки (0.5, 1.5 и 2.5). Результат на рисунке 3.
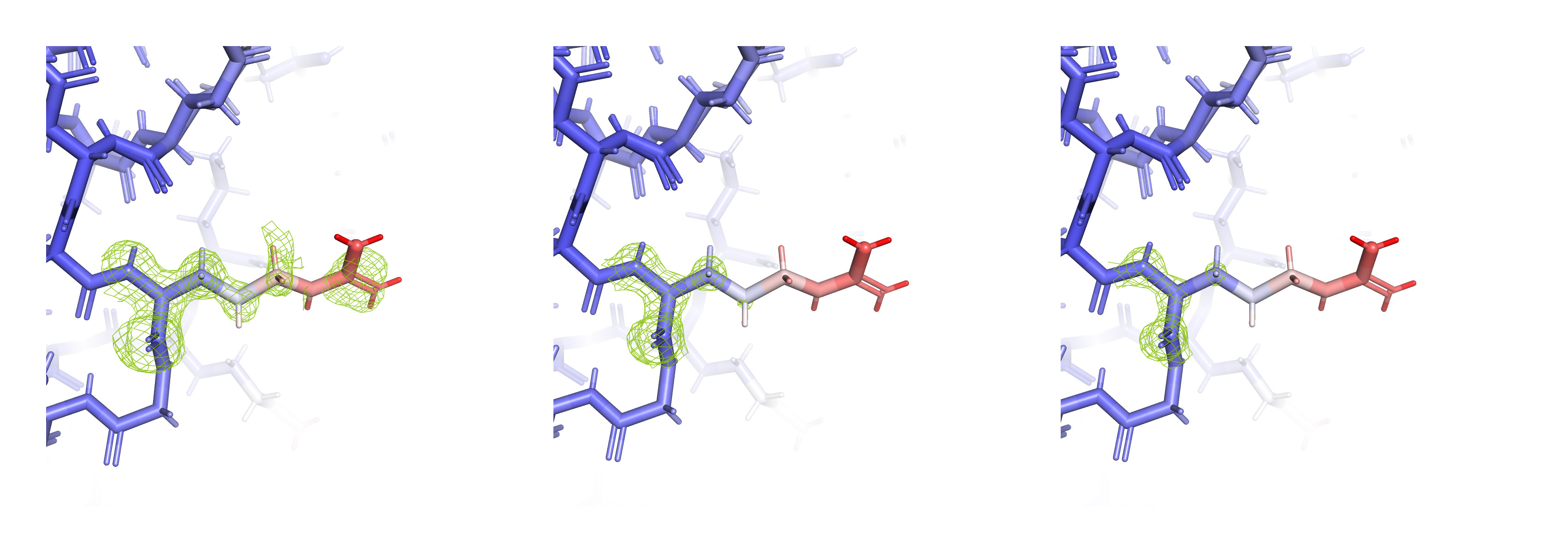
Заметно, что с увеличением уровня подрезки покрытие остатка электронной плотностью уменьшается, атомы с большими значениями B-фактора быстрее перестают быть покрытыми ЭП. Окончания остатков едва покрыты ЭП, там, где значение B-фактора максимально. Ссылка на сессию PyMOL здесь.
Задание 3
В этом задании нужно было “восстановить кристалл”, сгенерировав соседей белка. Для понимания структуры кристалла были сгенерированы соседи при отсечке, равной 50 А (рис. 4). Далее были сгенерированы ближайшие соседи при отсечке в 4 А. Оказалось 10 соседей.
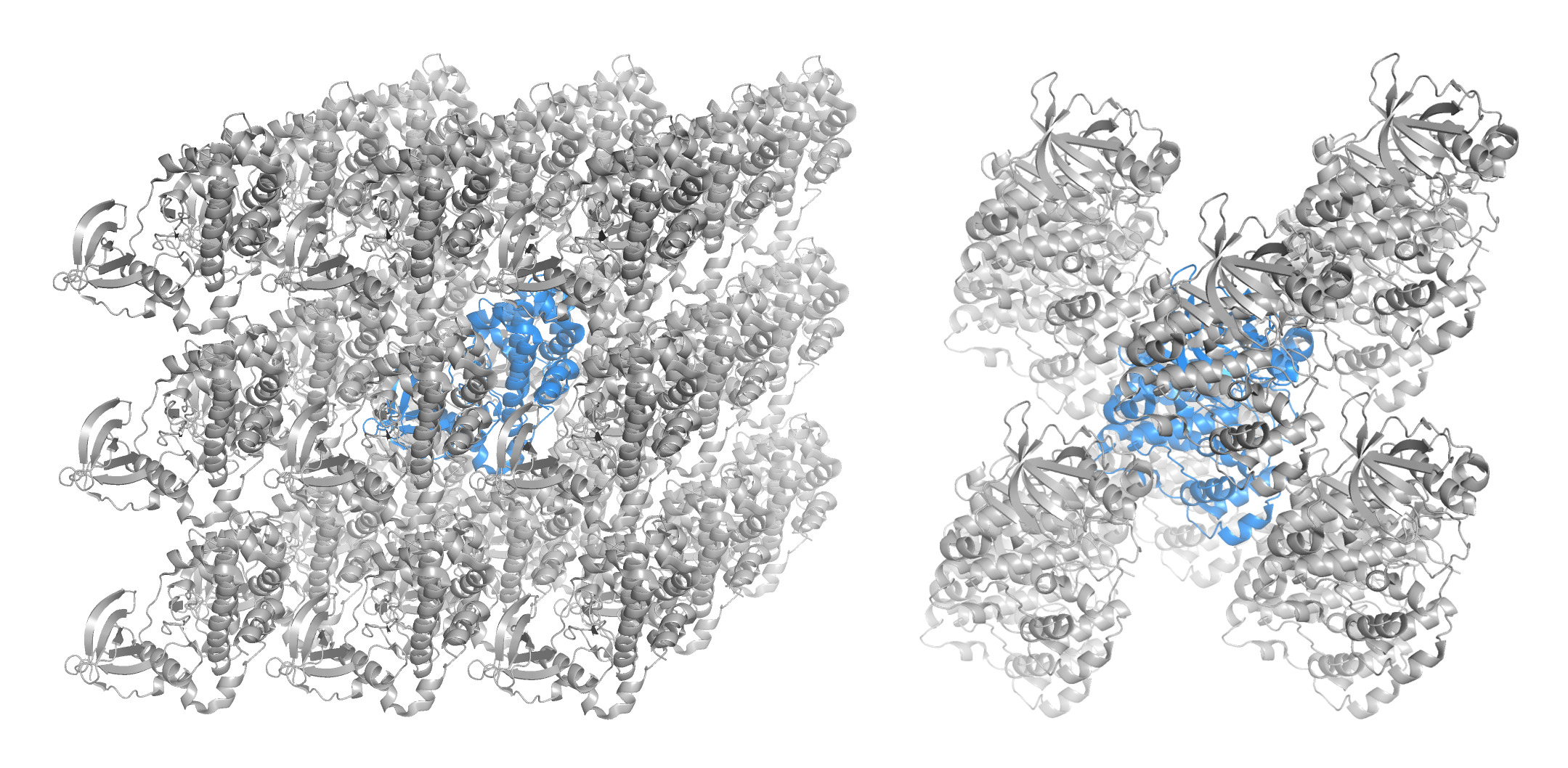
Ссылка на сессию PyMOL здесь.
Задание 4
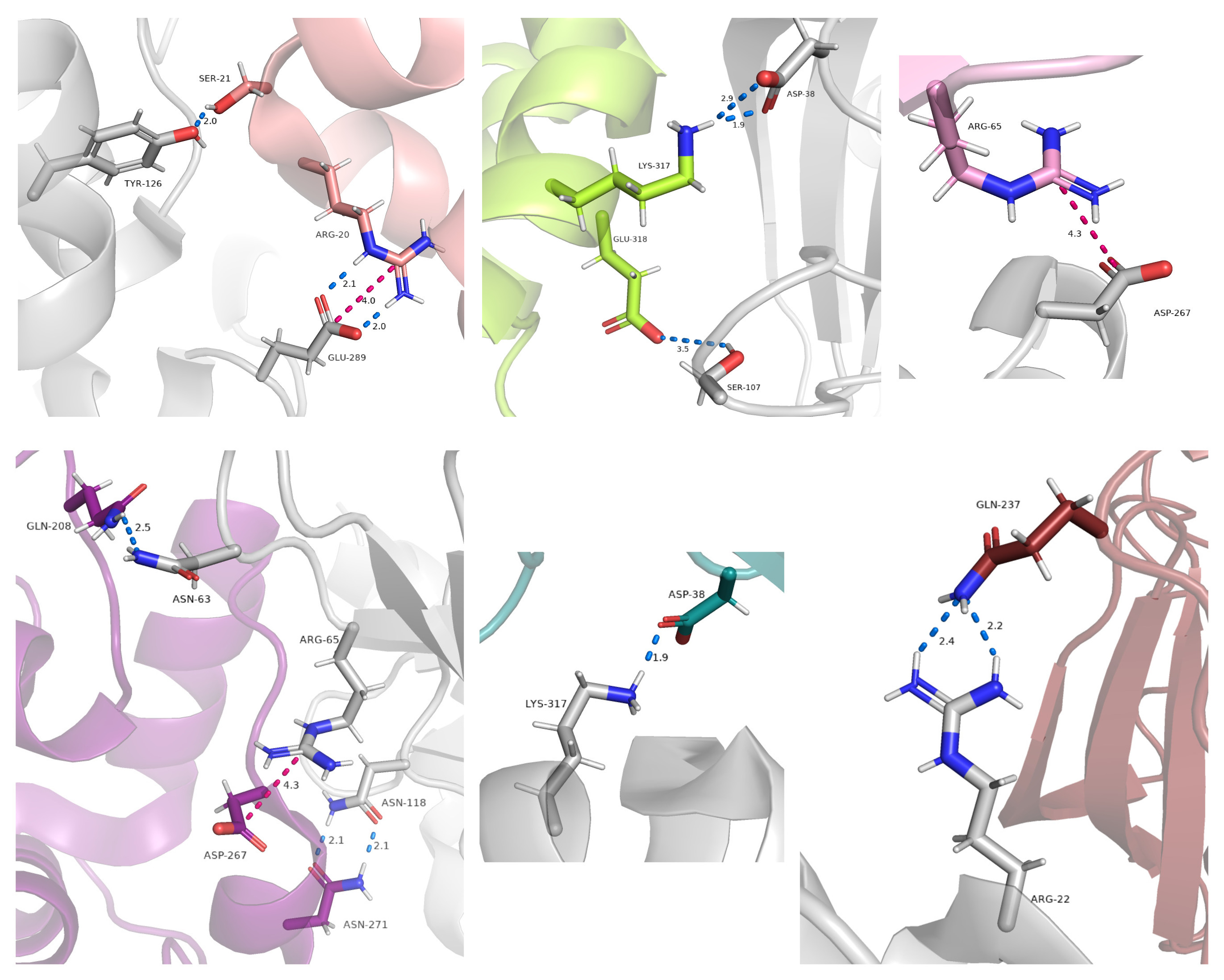
Далее были рассмотрены зоны контакта с соседями по кристаллу. Из 10 возможных зон было найдено 6, остальные 4 соседа были расположены на слишком большом расстоянии для образования каких-либо контактов. В большей части случаев найденные связи - единичные, которые не могут дать значимой стабильности структуре. Однако несколько зон имели более, чем один контакт между соседями. Так как кристалл был получен не в нативных условиях, то вряд ли найденные взаимодействия можно назвать истинными (как минимум те, что единичны), однако некоторые показанные зоны c большим числом связей, вероятно, могут участвовать в контактах при определенных условиях.