Практикум 5: ферментативная активность белка BtSCoV-Rf1.2004 PLpro
Исследуемый фермент, папаин-подобная протеаза, проявляет деубиквитинирующую активность за счет тиолзависимого гидролиза изопептидных связей, образованных С-концом убиквитина (EC 3.4.19.12).

В аннотации последовательности на сайте PDB не указаны аминокислотные остатки, входящие в состав каталитического центра, только сайты связывания, причем для всех типов лигандов, а также
позиции последовательности, участвующие в координации Zn.
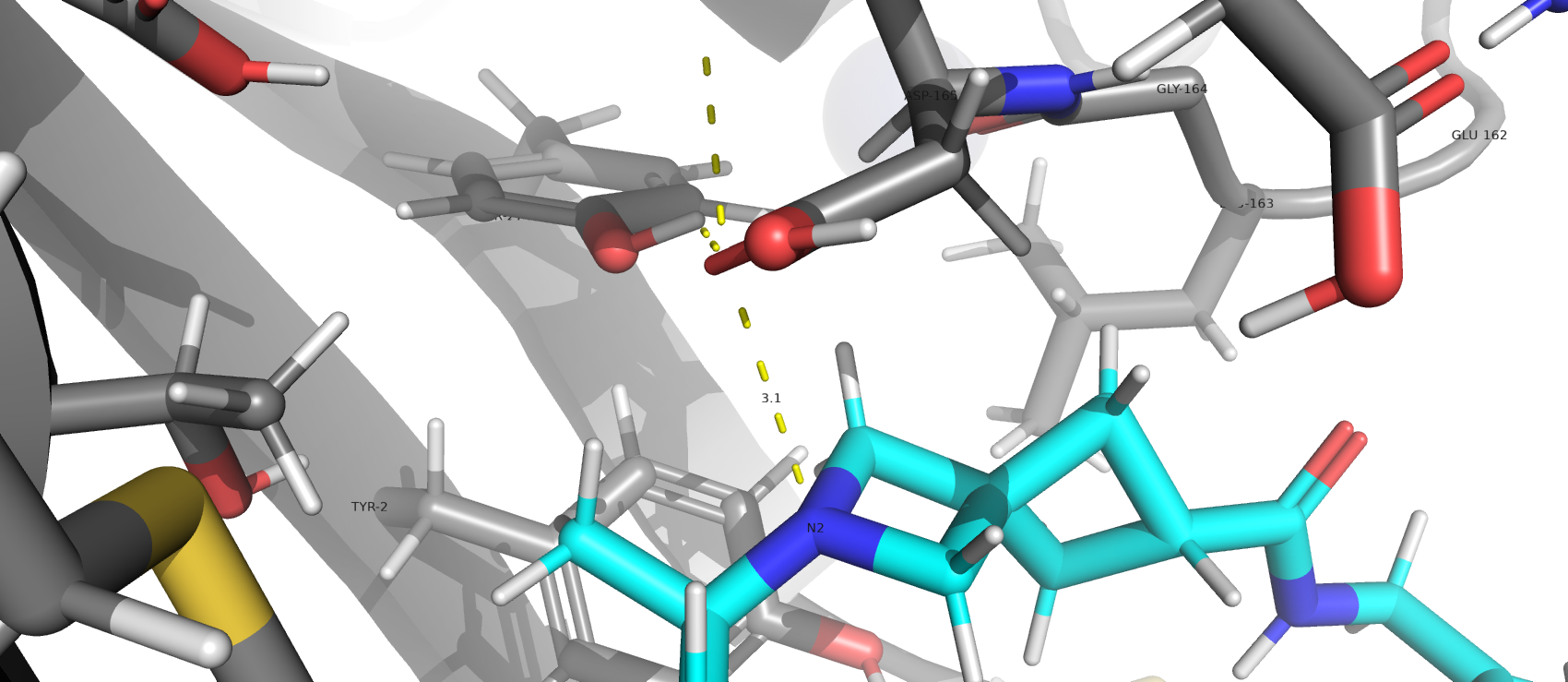
Анализ окружения лиганда показал, что водородными связями стабилизирован только N2 с Asp-165. Можно предположить, что данный
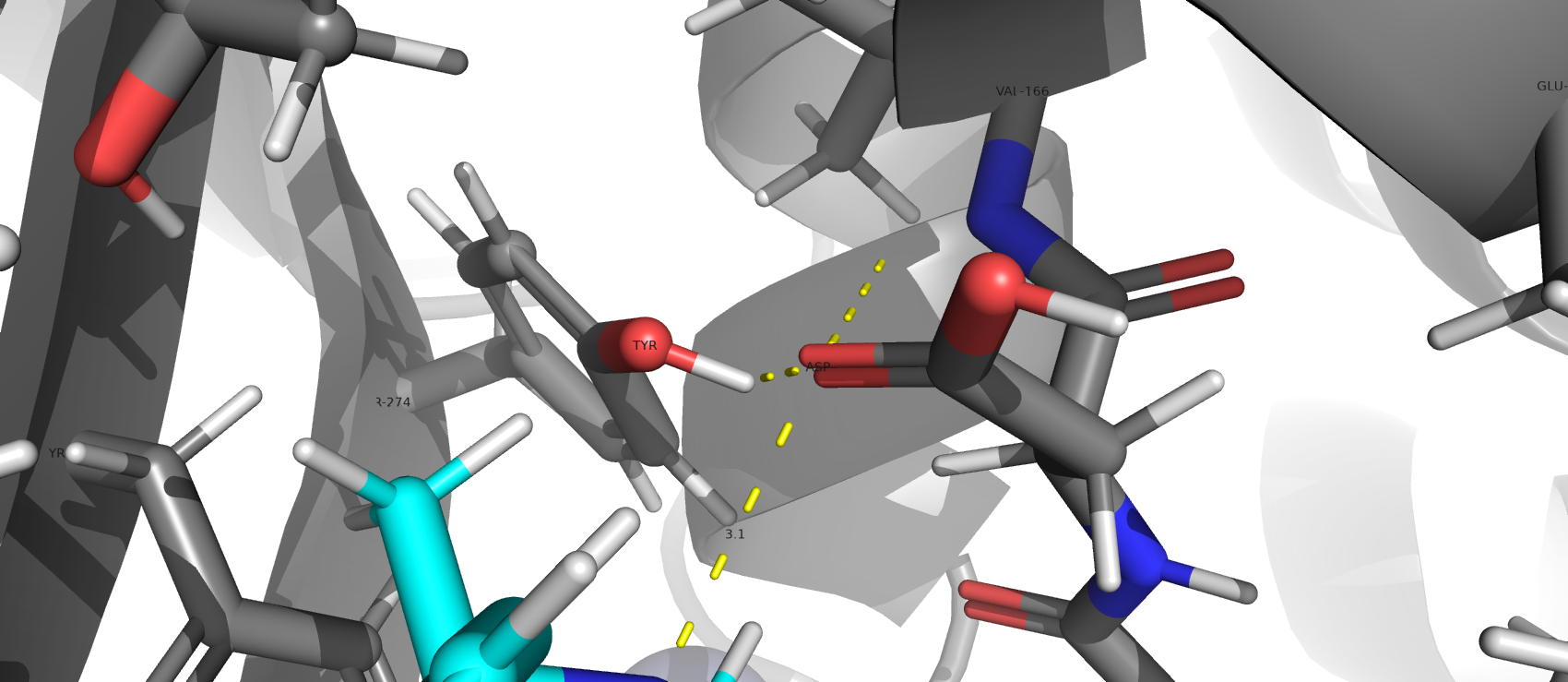
аминокислотный остаток является каталитически активным, ссылась на "классическую триаду" пептидазного клана CA, к которму относится SARS-CoV PLpro [1]. Рядом расположен ион цинка. Взаимодействия
в каталитическом центре: Asp-165 и Tyr-274. Расстояние между ингибитором и каталитическим центром составляет 3.1 А.
Т. к. количество информации об активном центре в аннотациии весьма скудно, на
этом анализ каталитического центра заканчивается.

Источники: