
Общая характеристика структуры 1YAD
Идентификатор белка PDB:
1YAD
Название белка:
Регуляторный белок TENI (regulatory protein TENI)
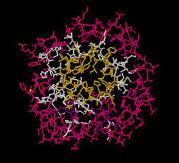
В исследуемом белке 4 цепи, которые представлены на Рис.1.
| Цепи показаны с помощью команды cartoons, которая представляет нитчатую структуру белка. Для различения цепи покрашены в разные цвета: Цепь А отмечена желтым цветом; Цепь В отмечена оранжевым цветом; Цепь С отмечена коралловым цветом; Цепь D отмечена красным цветом. |
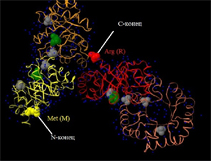 |
Благодаря такому соотношению цветом можно судить о начале и конце белка. Порядок цепей связан с переходом палитры цветов от желтого (N-конец) к красному (С-конец).
Каждая цепь белка начинается Met (метионином) на N-конце и заканчивается Arg (аргенином) на С-конце. Они выделены с помощью команды cpk и окрашены цветом цепи, в которой они находятся.
В PDB-файле с исследуемым белком также присутствуют молекулы, отличные от белка и воды. Молекулы воды отмечены синим цветом. Согласно информации в файле (просмотр в Far Manager) это сульфатные остатки (SO4)-2 (выделены серым цветом) и органические молекулы трис-гидроксиметил-метил-аммония (TRIS-HYDROXYMETHYL-METHYL-AMMONIUM) с формулой (С4H12NO3)+1, которые в файле обозначены как 144 и выделены на представленном рисунке зеленым цветом.
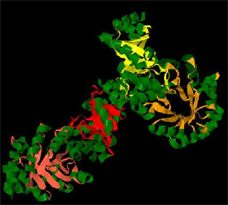 |
На Рис.2 наглядно представлены a-спирали (отмечены зеленым цветом) и ß-листы (отмечены цветами цепей, к которым они относятся) и отражена вторичная структура белка. |
Анализ структуры а-спиралей и ß-листов цепи D структуры 1YAD
| Рассмотрим вторичную структуру исследуемого белка, состоящего из a-спиралей и ß-листов (Рис.2). Для этого рассмотрим цепь D (Рис.3) | 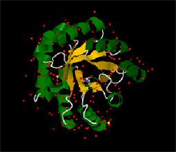 |
β-листы
 |
Как видно из Рис.5 β-листы образуют так называемый «бочонок». Если внимательно посмотреть на Рис.3, на котором представлена полная цепь, то можно заметить, что в центре пространства, ограниченного рассматриваемым $beta;-листом, расположены органические молекулы трис-гидроксиметил-метил-аммония. |  |
Это позволяет предположить, что исследуемый белок обладает избирательно-пропускной активностью.
β-тяжи расположены параллельно, т.е. цепи ориентированы в одном направлении, что иллюстрирует Рис.4.
α-спирали
Выбранная для анализа a-спираль начинается с ser (серин) с номером 103 и заканчивается asp (аспаргином) с порядковым номером 114.
С помощью команды JMol получаем получаем геометрические характеристики, а именно:
 |
|
| Рассматриваемый остаток n в нашем случае Gln (глутамин) с порядковым номером 109. Его азот образует водородную связь с кислородом предшествующего остатка Glu (глутаминовая кислота) с порядковым номером 105. То есть водородная связь образуется, минуя 4 остатка. Кислород рассматриваемого , остатка образует связь с азотом последующего остатка, который также в исследуемом белке является Glu (глутаминовая кислота), но с порядковым номером 113. То есть водородная связь образуется, минуя также 4 остатка. | 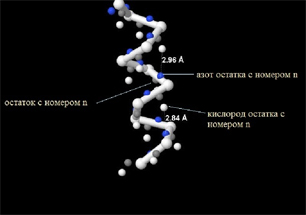 |
Внутримолекулярные взаимодействия боковых групп белка в цепи D структуры 1YAD
Рассмотрим внутримолекулярные взаимодействия боковых групп белка в одной цепи исследуемого бека. Для этого рассмотрим наличие и расположение дисульфидных и солевых мостиков в цепи D.
 |
Дисульфидные мостики – это ковалентные связи между цистеиновыми остатками. Они находятся в различных местах цепи белка. Связываясь, они скрепляют белок. В рассматриваемом белке нет цистеиновых остатков, следовательно, нет дисульфидных мостиков. Для поиска цистеиновых остатков в программе JMol выбраем цепь D командой restrict *D (Рис.8). Далее производим поиск цистеиновых остатков (команда: select cys). Программа выводит в окне консоля: «0 атомов выбрано» . Это значит, что цистеинвых остатков нет. Ясно, что дисульфидных мостиков тоже нет. |
Солевые мостики - электростатические взаимодействия, реализующиеся в белках между положительно и отрицательно заряженными группами белка.
Образовывать солевые мостики могут аминокислоты:
- имеющие отрицательно заряженные радикалы: глутаминовая кислота (Glu) и аспаргиновая кислота (Asp);
- имеющие положительно заряженные радикалы: аргинин (Arg) и лизин (Lys).
Следовательно, есть 4 теоретических варианта солевых мостиков. Проанализируем все четыре варианта для рассматриваемой цепи исследуемого белка.
Рассмотрим расположение Glu, Asp, Arg и Lys в цепи D (Рис.9). Каждая аминокислота отмечена определенным цветом:
|
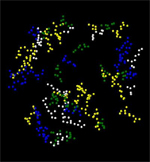 |
Для наглядности сама цепь не представлена, а представлено взаимное расположение аминокислот, которые изображены объемными сферам (команда: cpk).
Для наглядности сама цепь не представлена, а представлено взаимное расположение аминокислот, которые изображены объемными сферам (команда: cpk).
-
Солевые мостики между Glu и Arg
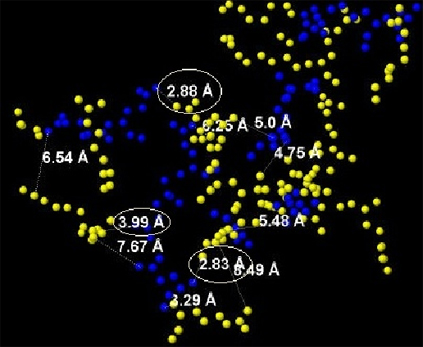 На Рис. 10 показаны измерения, проведенные с помощью программы JMol. Согласно этим измерениям в белке существуют солевые мостики между аминокислотами Glu и Arg. Длина этих связей приведена на Рис.10 и заключены в овал, чтобы отличить их от измерения расстояний между Glu и Agr, не являющихся солевыми мостиками.
На Рис. 10 показаны измерения, проведенные с помощью программы JMol. Согласно этим измерениям в белке существуют солевые мостики между аминокислотами Glu и Arg. Длина этих связей приведена на Рис.10 и заключены в овал, чтобы отличить их от измерения расстояний между Glu и Agr, не являющихся солевыми мостиками.
-
Солевые мостики между Glu и Lys
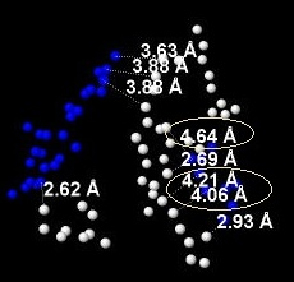
Между Glu и Lys также присутствуют солевые мостики, представленные на Рис. 11. На данном рисунке (в отличие от предыдущего) в овал заключены расстояния, не являющиеся солевыми мостиками. Такое различие основано на соображении удобства представления информации, так как данный вариант солевых мостиков встречается в большем количестве, чем предыдущий, описанный в пункте 1.
-
Солевые мостики между Asp и Lys
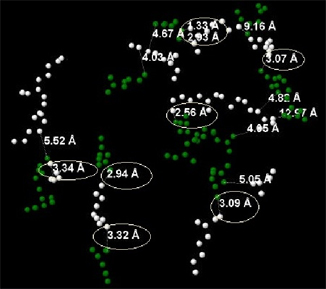 Между Asp и Lys присутствуют солевые мостики. На Рис. 11 они выделены овалом.
Между Asp и Lys присутствуют солевые мостики. На Рис. 11 они выделены овалом.
-
Солевые мостики между Asp и Arg
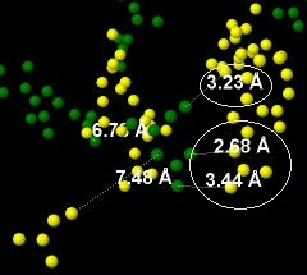 Между аминокислотами Asp и Arg существуют солевые мостики, которые представлены на Рис.13 и отмечены овалом.
Между аминокислотами Asp и Arg существуют солевые мостики, которые представлены на Рис.13 и отмечены овалом.
Отдельный солевой мостик
 |
На этом рисунке представлен отдельный солевой мостик, который образуется между аминокислотами Arg и Asp. Его длина составляет 2,74 Ǻ. |