
Лиганды в структуре 1YAD
Лиганд - (от лат. ligare — связывать) — атом, ион или молекула, связанные с неким центром (акцептором).
Для поиска лигандов в структуре белка, представленной в PDB-файле, надо воспользоваться программой Far Manager, с помощью которой можно прочитать код белка. В этом коде молекулы, не являющиеся частью белка, обозначены как HETATM (вода входит в их число). Кроме того, в фале представлены данные о количестве каждого из лигандовв белке , приводится расшифровка их кодового обозначения, количественный и качественный состав, полное название по ЮПАК и координаты расположения.
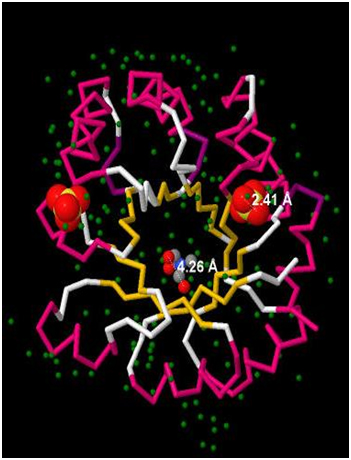 |
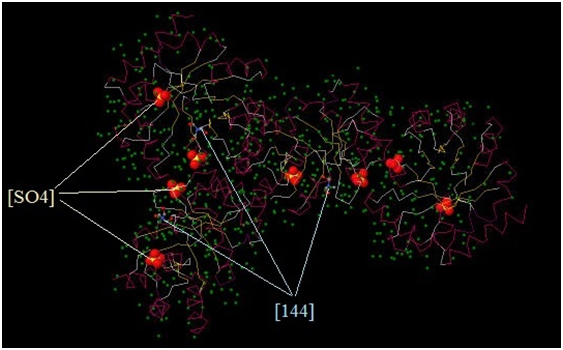
[SO4]-2 – сульфат-ионы. На Рис. 1 и Рис.2 выделены командой cpk (программа JMol). В PDB-файле указано, что их в белке 8 (Рис.1.), что они отрицательно заряжены (заряд: 2-) и состоят из 1 атома серы (на рисунках отмечена желтым цветом) и 4 атомов кислорода (на рисунке отмечены красным). С помощью программы JMol получаем размеры, а именно длину, этого лиганда: 2,41 Ǻ (Рис.2) [144] - трис-гидроксиметил-метил-аммоний. Соединение имеет формулу: (С4H12NO3)+1 |
В PDB-файле указано, что их в белке 3 (Рис.1.), что они положительно заряжены. Это соединение отмечено на Рис.1 и для более детального изображения представлено на Рис.2 в центре. Атомы этого соединения покрашены в соответствие с их природой: кислород – красным, азот – синим, углерод – серым.
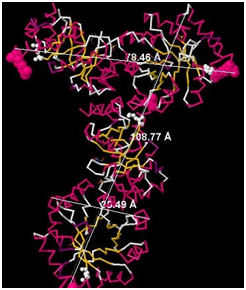 |
С помощью программы JMol получаем размеры, а именно длину, этого лиганда: 4,26 Ǻ (Рис.2) На Рис. 1 и Рис.2 размеры лиганда не пропорциональны размерам белка. Это сделано для наглядности изображения лигандов. Чтобы оценить размер лигандов относительно всего белка, надо указать размер белка. На Рис.3 представлены измерения размеров исследуемого белка. Белок имеет продольную форму с относительно узким расширением на одном конце и относительно широким на другом. В связи с этим измеряем следующие параметры: длина – 108,77 Ǻ; ширина относительно узкого расширения – 35, 49 Ǻ; ширина относительно широкого расширения – 78,46 Ǻ. С учетом расчетов размеров лигандов (см. выше) оказалось, что длина одного сульфат-иона составляет 2,21% длины всего белка, а одного иона [144] – 3,91%. |
Заметим, что b-листы всех цепей образуют форму бочонка. Структура явно представляет собой канал. Именно в центре этого «бочонка» расположены ионы [144] органического азотсодержащего соединения. Значит, можно предположить, что белок обладает избирательной пропускной способность.
Так как исследуемой белок является регуляторным, то, возможно, он регулирует поступление или прохождение определенных веществ. Например, он может специфически связываться с помощью лиганда [144] с веществом, которое не должно проходить сквозь него. Связыванием с рассматриваем лигандом белок будет останавливать нежелательное вещество.
Также возможно, что рассматриваемый лиганд может активировать вещество (вещества), для которого (-ых) он является регулятором. И тогда его функция будет заключаться в отборе, например, «правильных» белков (не мутированных). Следовательно, активированный «правильный» белок будет выполнять свою функцию в организме, а мутированный останется неактивным и после утилизируется.
Возможен еще один случай, когда лиганд связывается с пропускаемым им веществом только при определенных условиях. В таком случае возможны два варианта:
- Вещество не связывается с лигандом при нормальных для существования биохимических реакций организма условиях. Тогда пропускаемое вещество проходит сквозь белок и выполняет свою функцию. При изменении условий протекания реакций вещество ингибируется белком, следовательно, не выполняет своих функций (предположим, что речь идет о веществе, которое при изменении условий протекания реакций, мешает биосинтезу организма).
- Вещество активируется белком (в частности, лигандом), связываясь с ним, при нормальных для существования биохимических реакций организма условиях. Тогда оно выполняет свои функции. При изменении условий не активируется и не выполняет своих фунцкий (предположим, что рассматриваемое вещество аналогично веществу из 1).
- Вещество не связывается с лигандом при нормальных для существования биохимических реакций организма условиях и не стремится пройти сквозь белок. При изменении условий вещество начинается связываться с лигандом белка, активируется, выполняя свои функции (предположим, что вещество служит для устранения изменений условий).
- Вещество не связывается с лигандом при нормальных условиях, но стремится к этому. Но связывания не происходит из-за неподходящей конформации белка. При изменении условий, конформация белка меняется, происходит связывание, вещество функционирует.
- Вещество связывается с лигандом при нормальных условиях из-за чего не может пройти через белок. При изменении условий конформация белка изменяется, и вещество начинает проходить.
Что касается сульфат-ионов, то следует заметить, что они расположены вблизи органического иона [144]. Основываясь на этом, можно предположить, что возможная функция ионов [SO4]-2 – присоединение каких-либо веществ или атомов (например, атомы металлов), что влечет за собой изменение конформации белка (например, в случаях, подобных выше рассмотренным).
Анализ области контакта белка из структуры PDB 1YAD и лиганда [144]
Контакт белка и лиганда рассмотрим на примере связи иона [144] аминокислотами белковой цепи в цепи А.
Еще раз обратим внимание на то, что [144] - трис-гидроксиметил-метил-аммоний. Формула: (С4H12NO3)+1.
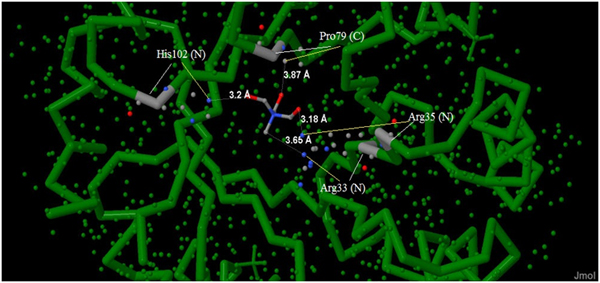
Представлен на Рис.2 и на Рис.4 в центре. Используемые в описании атомы в соответствие с их природой: кислород – красным, азот – синим, углерод – серым. На Рис.4 цепь А выделена для удобства зеленым цветом. Каждая аминокислота подписана трехбуквенным обозначением. Белые линии, идущие от названий, указывают на аминокислоту, соответствующую названию. Рядом с аминокислотами в скобкам обозначены атомы, которые принедлежат этой аминокислоте и с которые служат для связи с лигандом. К таким атомам ведут желтые линии.
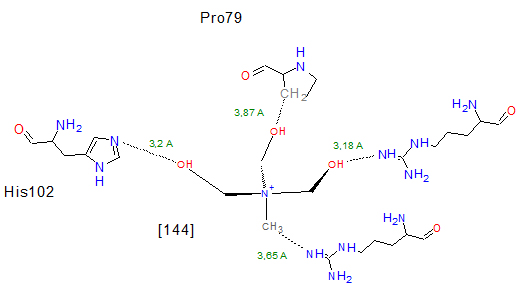
Рассматриваемый контакт (Рис.4) образован атомами [144]300 и атомами аминокислотных остатков Arg33, Agr35, His102, Pro79 следующим образом
| Аминокислотные остатки, участвующие в контакте | Атомы аминокислотных остатков | Атомы лиганда | Лиганд [144]300 |
| Arg33 | NH1 (азот из радикала NH, которая связана с основной цепью аминокислоты двойной связью) | C1 (углерод, находящийся на первой позиции от начала цепи лиганда) | |
| Arg35 | NH1(азот из радикала NH, которая связана с основной цепью аминокислоты двойной связью) | O2 (кислород, находящийся на второй позиции от начала цепи лиганда) | |
| His102 | NE2 (азот из циклической части, находящийся в положении В) | O3 (кислород, находящийся на третей позиции от начала цепи лиганда) | |
| Pro79 | CB (углерод из циклической части, находящийся в положении В) | O4 (кислород, находящийся на четвертой позиции от начала цепи лиганда) |
Следует отметить, что лиганд не образует связей с присутствующими поблизости молекулами воды.
Все данные, приведенные в этой таблице, показаны на Рис. 4 и на Рис.5 Кроме того на этих же рисунках измерены длины (в Ǻ) рассматриваемых связей (на Рис. 5 отмечены зеленым цветом).
Рис.4 был получен в программе JMolон отражает пространственное расположение связей и молекул в трехмерном пространстве.
Рис.5 – это схема, отражающая химические формулы лиганда и аминокислот, с ним связанных.
Как видно из выше представленной схемы между лигандом и аминокислотными остатками белка образуются ковалентные связи.
Рис.2 и Рис.4, отражающие основную информацию о лиганде можно получить с помощью этого cкрипта.
Проект генно-инженерного эксперимента с белком из структуры 1YAD
При замене одной аминокислоты на другую могут измениться свойства белка. Причем, измениться может не одно свойство, а сразу несколько. Например, белок перестанет связываться с лигандом и изменится его конформация, что приведет к потере функции и изменению положения в пространстве, где он находится, что в свою очередь тоже может повлечь нарушения, к примеру, в ходе цикла каких-либо химических превращениях.
В исследуемом белке лиганд связан с белком посредством ковалентных связей между ним и аминокислотными остатками.
В результате точечной мутации, которая приведет к замене связывающихся с лигандом аминокислот, может произойти следующее:
- В1. Белок потеряет способность связываться с лигандом [144].
Это произойдет в том случае, если аминокислоте нечем будет образовывать связь с лигандом. Например, если вместо любой из аминокислот Arg33, Agr35, His102, Pro79 поставить Gly, то в этой позиции не будет связи с лигандом (потому что Gly нечем образовать эту связь). - 2. Белок сохранит способность связываться с лигандом [144].
Группы -ОН лиганда могут образовывать ковалентные связи. поэтому аминокислоты Agr35, His102, Pro79 можно заменить на любую аминокислоту, которая имеет свободную –NH, -OH, -СHn группы (например, Lys, Gln, Ser и т.д.), и тогда белок будет связываться с лигандом. - Вещество не связывается с лигандом при нормальных для существования биохимических реакций организма условиях и не стремится пройти сквозь белок. При изменении условий вещество начинается связываться с лигандом белка, активируется, выполняя свои функции (предположим, что вещество служит для устранения изменений условий).
Однако, отдельного анализа и рассмотрения требует конформация белка при замене аминокислот, так как это может влиять на его свойства. Здесь это не рассматривается (только анализ связывания с лигандом!)