
1. Составление репрезентативной выборки гомологов вашего белка TENI_BACSU с помощью BLAST
Этот процесс можно условно разделить на два этапа: подбор и создание записи с подходящими гомологами среди прокариот и эукариот, и удаление из записи наименее подходящих последовательностей.
Использование BLAST помогает составить выборку гомологов белка для составления множественного выравнивания. Для этого следует провести несколько поисков, изменяя параметры.
Таблица 1
| Поиск | Ограничения по максонам | Порог e-value | Максимальное количество хитов |
| Прокариоты | Exclude: Eucarya, Firmicutes | 5 | 20000 |
| Прокариоты | По каждой из групп | 3 | 5000 |
| Эукариоты | Только Eukaryota | 1 | 100 |
Для каждого поиска использовался алгоритм blastp (protein-protein BLAST); проводились поиски в базе данных Reference proteins (refseq_protein).
Поиски были проведены с разными параметрами. Получено много результатов среди прокариотических и эукариотических организмов, на основе которых составлена запись в fasta-формате гомологов (их идентификаторы и организмы, в которых они обнаружены представлены в Таблице 2).
Для наглядного представления систематического положения рассмотренных в Таблице 2, с помощью BLAST было получены филогенетические деревья каждого из филумов.В скобках указано число, которое показывает, сколько гомологов содержит данная систематическая группа.
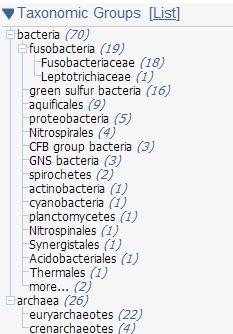
Рис.1. Филогенетическое дерево для бактерий из выборки |
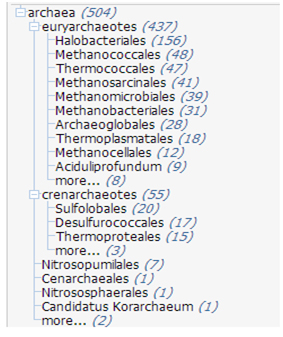
Рис.2. Филогенетическое дерево для архей из выборки |
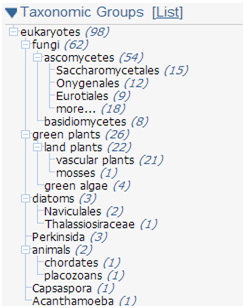
Рис.3. Филогенетическое дерево для эукариотов из выборки |
Поиск гомологов в эукариотических организмах проводился по всем стандартным параметрам алгоритма, кроме e-value. Для удобства использовался e-value=1. Некоторые из найденных последовательностей были включены в выборку (см. Таблицу 2).
BLAST позволяет определить, где кодируется белок (ядро, митохондрии или пластиды). Из представленных в выборке белков 9 являются ядерными, а три - митохондриальными.
2. Построение множественного выравнивания последовательностей
С помощью программы MUSCLE сервиса Европейского Биоинформатического Института EBI было построено множественное выравнивание последовательностей выборки.
На входе программы подавался файл в fasta-формате. Формат выходных данных (Pearson/FASTA) был задан по умолчанию.
С помощью JalView выравнивание было визуализировано.
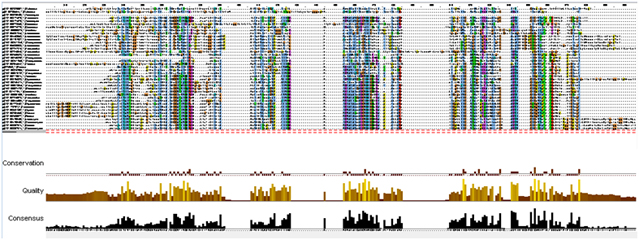
Рис.4. Множественное выравнивание последовательности белка TENI_BASCU и последовательностей из выборки (для увеличения кликнуть на рисунок)
3. Анализ множественного выравнивания с помощью JalView
С помощью браузера JalView белок TENI_BACSU был ассоциирован с его 3D- структурой., что позволило добавить новые три строки аннотации:
- SECONDARY: информация об участках вторичной структуры (бета-тяжи и альфа-спирали);
- LIGANDS отражает участки, участвующие в связывании лигандов;
- BLOCKS: отмечены остатки (в строке BLOCKS стоит буква "B"), формирующие блоки (хорошо выравниваемые консервативные участки)
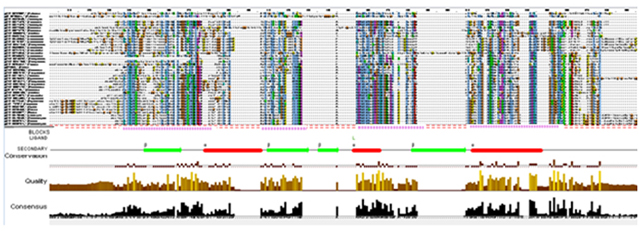
Рис.5. Множественное выравнивание с аннотациями последовательности белка TENI_BASCU и последовательностей из выборки (для увеличения кликнуть на рисунок)
С помощью JalView можно ассоциировать рассматриваемый белок TENI_BASCU с его 3D-структурой. Это помогает рассмотреть участки консервативности и их расположением в белке.
Ранее (Описание области контакта белка и лиганда в структуре 1YAD) было установлено, что за связывание с лигандом отвечают Arg33, Arg35, Pro79, His102. Лигандом является трис-гидроксиметил-метил-аммоний. В PDB-файле он обозначается [144].
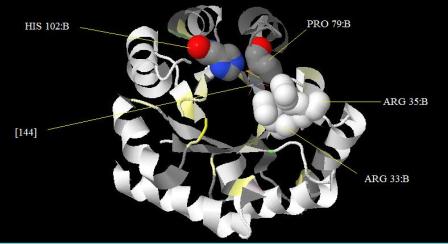
Рис.6.Расположение аминокислот, связывающих лиганд([144]-обозначение лигпдна трис-гидроксиметил-метил-аммония)
Основываясь на новых аннотациях можно сказать, что белок консервативен. Во всех гомологичных последовательностях есть несколько идентичных блоков.
Однако,аминокислотные остатки, которые участвуют в связывании лиганда абсолютно не консервативны. При их замене на аминокислоты со сходными свойствами бокового радикала, функция связывания лиганда не утратится.