
- Есть в базе данных PDB;
- PDB-код известен серверу EDS, то есть имеются экспериментальные данные;
- У белка есть структурные гомологи (проверка с помощью PDBeFold, подходящие под требования:
- 0.8 < RMSD < 3
- 50 % < Nalign< 90% (для белка TenI: 111 < Nalign < 199)
Для работы был выбран белок TenI (3QH2) из Bacillus subtilis (Рис.1). Он является тиозоловой таутомеразой.
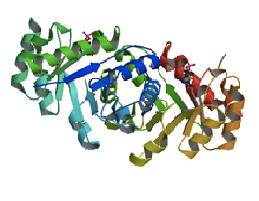
Разрешение: 2.23 Å
Длина белка: 221 а.о.
Данный белок удовлетворяет необходимым параметрам:
Таблица 2
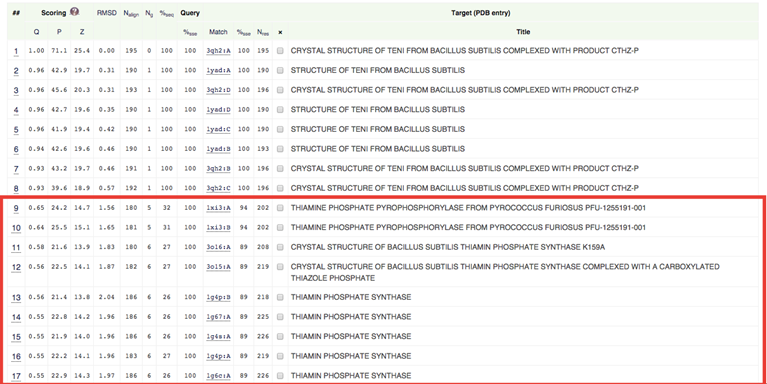
Подходящие под заданные критерии гомологи выделены красной рамкой (их более 5).
Для визуализации ЭП была скачана карта электронной плотности белка TenI и использовалась программа PyMOL.
При визуализации используются не физические единицы измерения (заряд/ Å3), а статистические — превышение сигнала над шумом (Z). Для вычисления Z рассчитывается среднее значение ЭП по ячейке кристалла M и среднее квадратичное отклонение σ. Для каждой точки вычисляется Z = (R – M)/σ. Здесь R — значение ЭП в данной точке пространства (x,y,z) в физических единицах, Z — значение ЭП "в сигмах" в той же точке.
Для более качественной оценки модели пространственной структуры нужно рассматривать несколько уровней срезки на определенном расстоянии от выбранного множества (параметр carve). В данном случае были построены изображения ЭП при 1σ, 1.5σ, 2σ, 2.5σ, 3σ при carve = 2Å (Рис. 2).
 |
 |
 |
1σ | 1.5σ | 2σ |
 |
 |
| 2.5σ | 3σ |
Анализируя Рис. 2, можно утверждать, что при увеличении уровня срезки, некоторые атомы пептидного остова перестают покрываться ЭП. Это концевые атомы. Однако большая часть белка покрывается картой ЭП. Можно говорить о хорошем разрешении для того, чтобы проследить пептидную цепь.
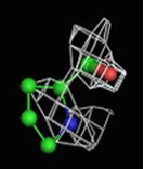
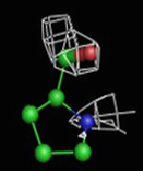
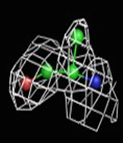
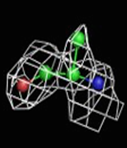
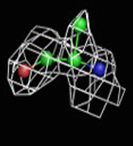
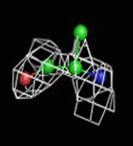
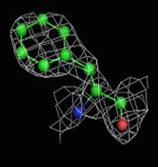
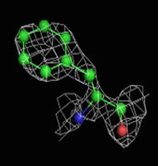
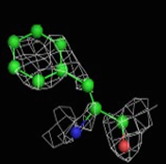
Были построены изображения ЭП вокруг пролина Pro12 (Рис. 3), аланина Ala17 (Рис. 4), фенилаланин Phe29 (Рис. 5).
 |
 |
 |
 |
 |
1σ | 1.5σ | 2σ | 2.5σ | 3σ |
 |
 |
 |
 |
 |
1σ | 1.5σ | 2σ | 2.5σ | 3σ |
 |
 |
 |
 |
1.5σ | 2σ | 2.5σ | 3σ |
При увеличении уровня срезки видны те области, в которых присутствует наибольшее скопление электронов. При небольших значениях σ (1-1.5) все атомы аминокислотных остатков покрываются ЭП. А вот при больших значения σ (2.5-3) уже не наблюдается четкого соответствия карте ЭП. Следовательно, мы можем говорить о недостаточно хорошем разрешении структуры и о недостаточности такого разрешения для обнаружения отдельных атомов.