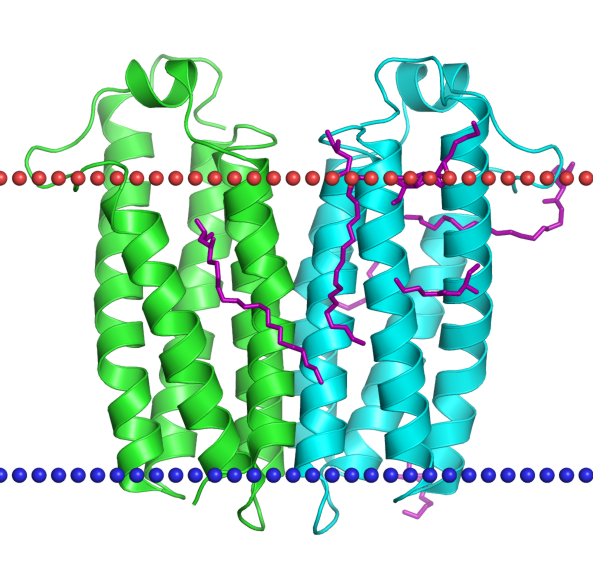
Изучалась структура трансмембранного белка 4UC2 - белка, ответственного за транспорт холестерина в митохондрии.
Изображение 1 базы данных OPM

Изображение 2 из базы данных PDB
Репрезентативная выборка была создана с помощью базы UniRef50. Были взяты 200 находок, e-value лучшей - 1.8E-114, худшей - 2.3E-18.
По данной ссылке можно найти результат поиска. http://www.ebi.ac.uk/Tools/services/rest/ncbiblast/result/ncbiblast-I20160528-140319-0316-12054744-oy/visual-svg
Полученные белки вместе с исходным белком были выровнены с помощью Muscle. Выравнивание можно скачать здесь 200_align_muscle_2_added_clean.fasta.
Выравнивание было открыто в jalview, и были удалены слишком короткие и плохо выровненные последовательности. Jalview проект можно скачать здесь project_3.jvp.
Была выбрана раскраска по гидрофобности с порогом в 10% (по какой-то странной причине Jalview не сохраняет раскраску, поэтому в проекте порог не выставлен).
Для исходного белка была загружена 3D структура, и были найдены трансмембранные спирали.
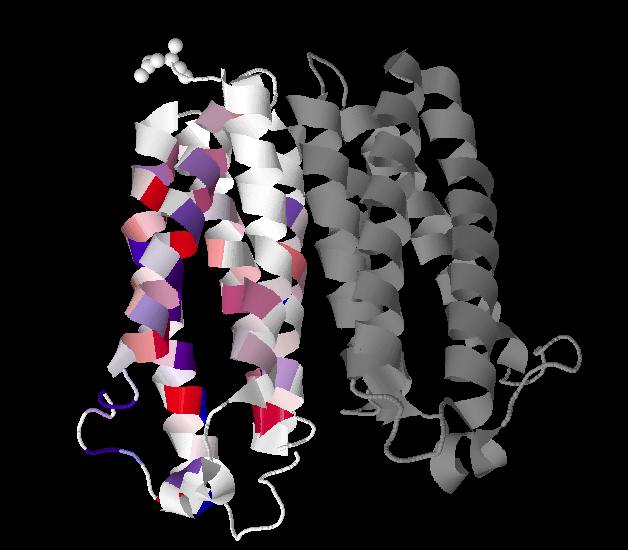
Рис 1 Изображение белка с расцветкой по гидрофобности и часть, ориентированная в n-сторону мембраны сверху, а ориентированная в p-сторону - снизу.
В строке аннотации TM_REAL были помечены остатки, отвечающие этим спиралям.
Далее было необходимо сравнить трансмембранные участки по структуре с предсказанными по TMHMM сервису для одного из гомологов.
В качестве гомолога был выбран UniRef50_V4ISL9/1-167. Сервиc TMHMM выдал предсказание расположения белка в мембране, и указал координаты трансмембранных участков, которые были отмечены в строке TM_PREDICTED.
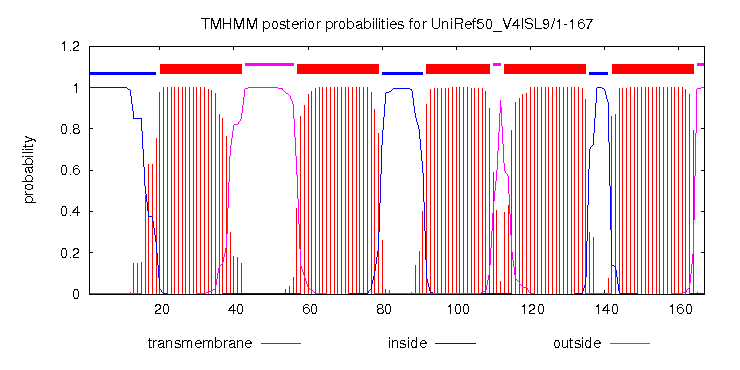
Рис 2 Результат работы программы TMHMM
Предсказанные и реальные трансмембранные участки совпадают везде, кроме первой спирали (в начале выравнивания).
Общее число трансмембранных спиралей (5 штук) предсказано верно, длины спиралей по структуре и по TMHMM различаются.
Трансмембранные участки достаточно консервативны и обогащены гидрофобными аминокислотами. Участки между спиралями обладают меньшей консервативностью в них чаще встречаются гидрофильные остатки.
В трансмембранных участках чаще всего встречаются лейцин, триптофан, валин, аланин, изредка встречаются гидрофильные остатки. Наверное, они находятся в активном центре фермента.