|
|
В этом практикуме надо было получить изображение электронной плотности для белка. Я использовала бифункциональный белок PyrR, который регулирует
экспрессию "pyr" генов в организме многих бактерий, в том числе и Bacillus Subtilis. (источники:
UniProt и
статья DOI:10.1128/JB.187.5.1773-1782.2005).
PDB код белка: 1A4X (информация о белке на сайте PDB:
1A4X, на сайте EMBL:
1A4X).
Сначала были скачаны файлы
со структурой (PDB-file, 1a4x.ent) и с экспериментально полученной картой
электронной плотности (EDS map, 1a4x.ccp4).
Статья, опубликованная по результатами расшифровки: DOI: S0969-2126(98)00036-7.
Разешение структуры 2.3Å.
Изображение электронной плотности вокруг остова полипептидной цепи.
Исследуемый белок состоит из двух субъединиц. На рисунке 1 представлены обе цепи белка, раскрашенные в разные цвета: зелёная цепь а и синяя цепь b.
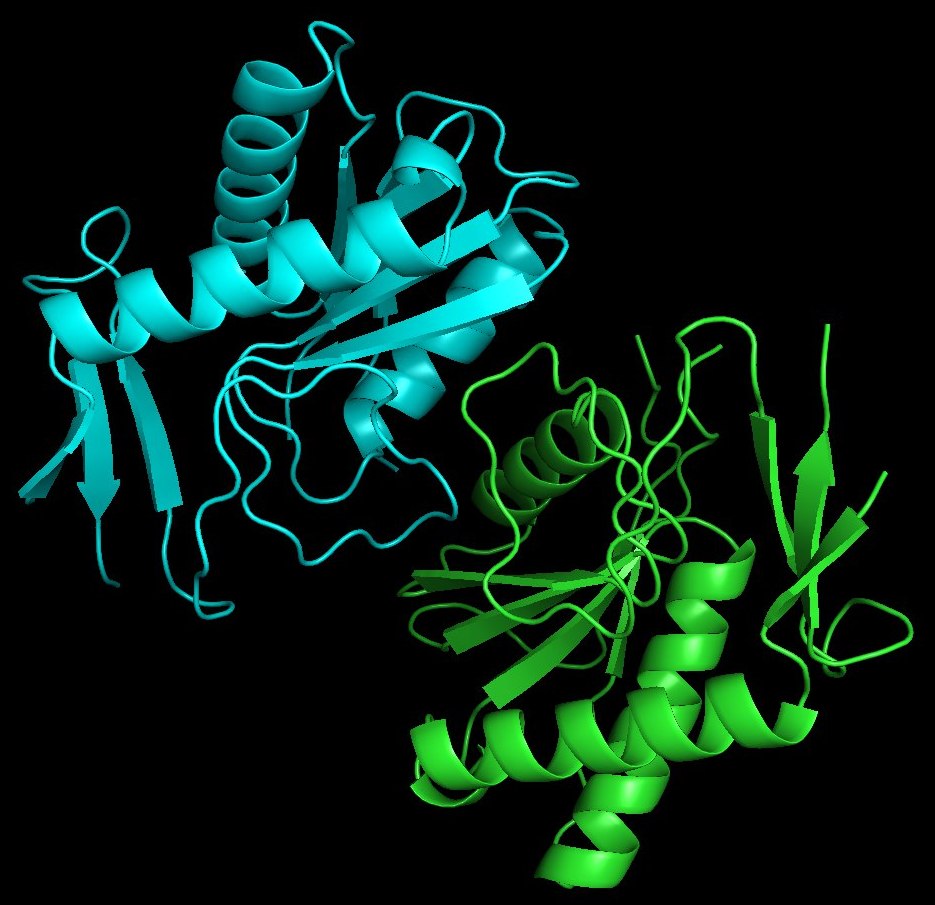
Рисунок 1. Структура цепей булка PyrR.
На рисунках ниже показано изображение электронной плотности (ЭП) вокруг полипептидной цепи
исследуемого белка при разных значениях отсечки в среднеквадратичных отклонениях.
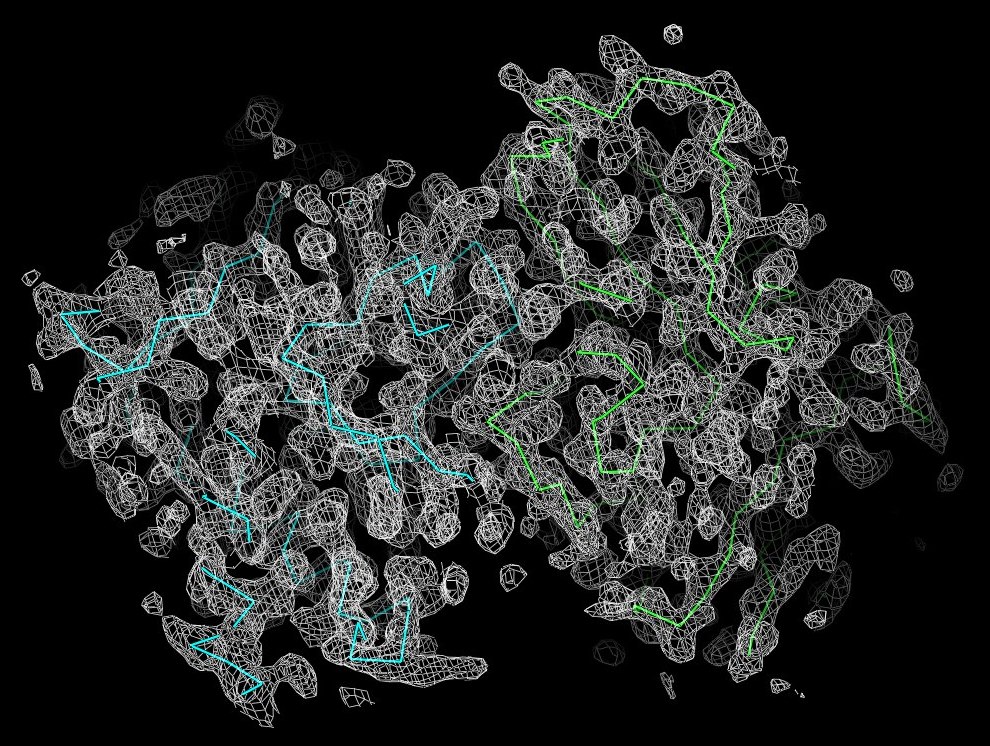
Рисунок 2. Изображение ЭП вокруг полипептидной цепи выбранного белка, 1 сигма.
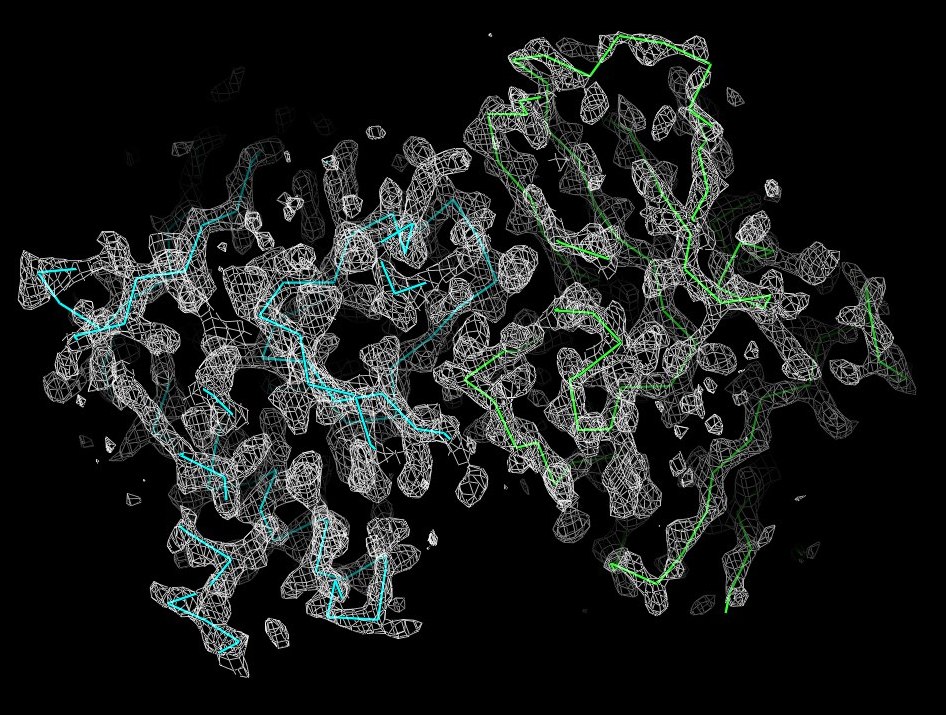
Рисунок 3. Изображение ЭП вокруг полипептидной цепи выбранного белка, 2 сигма.
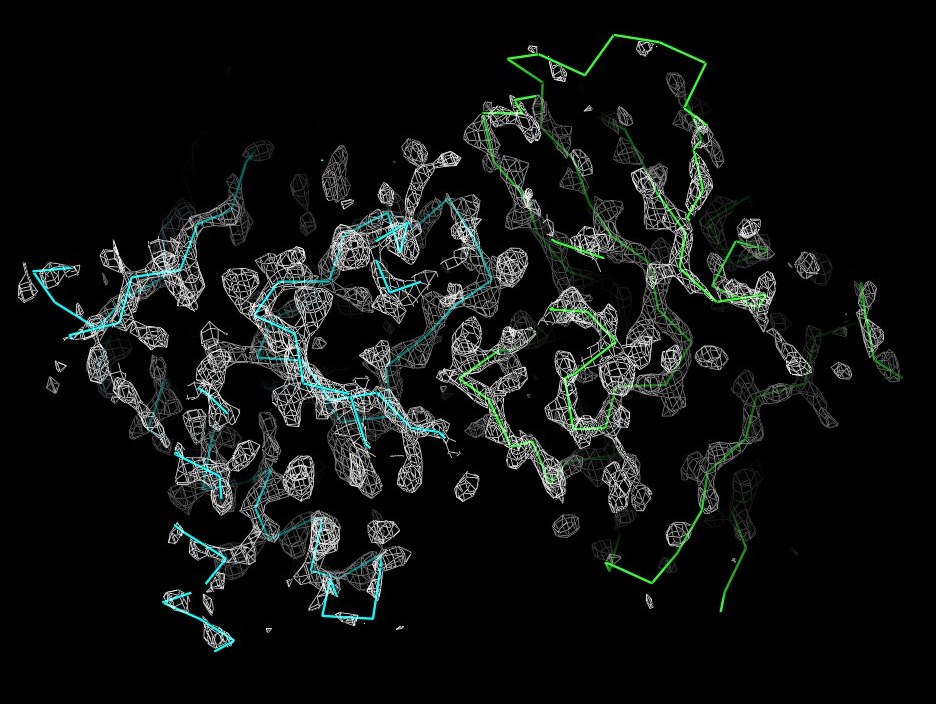
Рисунок 4. Изображение ЭП вокруг полипептидной цепи выбранного белка, 3 сигма.
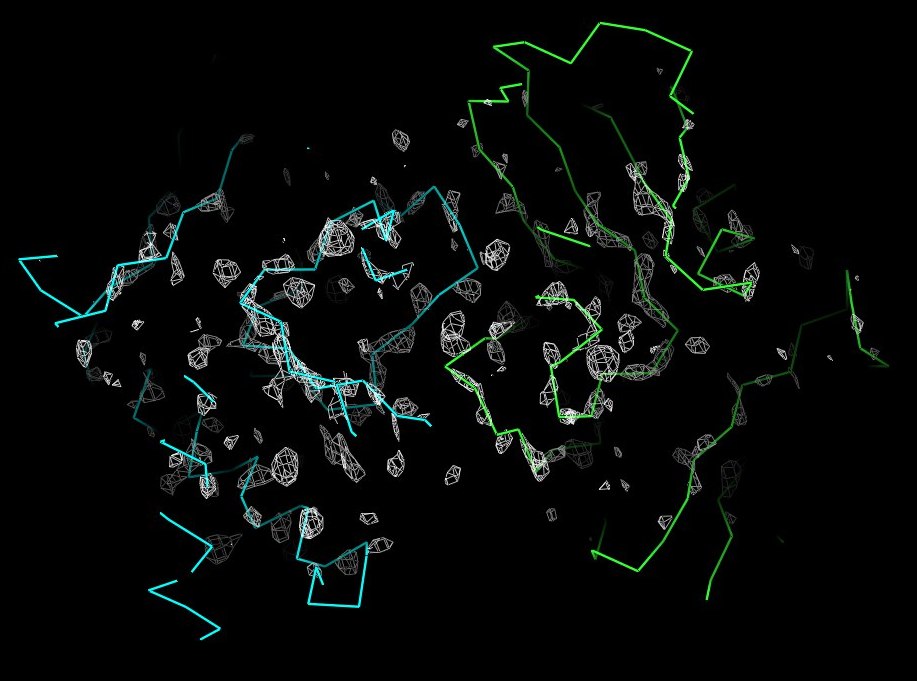
Рисунок 5. Изображение ЭП вокруг полипептидной цепи выбранного белка, 4 сигма.

Рисунок 6. Изображение ЭП вокруг полипептидной цепи выбранного белка, 5 сигма.
На рисунках 2-6 видно, что уже при значении уровня подрезки в 2 и более полипептидная цепь уже не очень хорошо описывается отображаемой плотностью.
Изображение электронной плотности (ЭП) вокруг трех различных аминокислотных остатков.
Для выполнения этого задания были выбраны следующие аминокислотные остатки: Arg42 (синий), Tyr45(жёлтый), Ala47(зелёный) на цепи а.
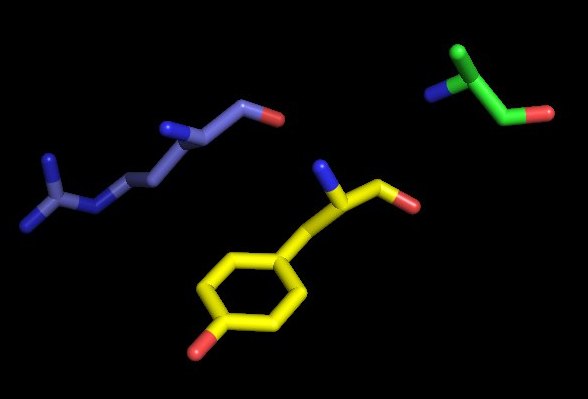
Рисунок 7. Структура выбранных аминокислотных остатков белка PyrR.
На рисунках ниже показано изображение электронной плотности вокруг полипептидной цепи
исследуемого белка при разных значениях отсечки в среднеквадратичных отклонениях.
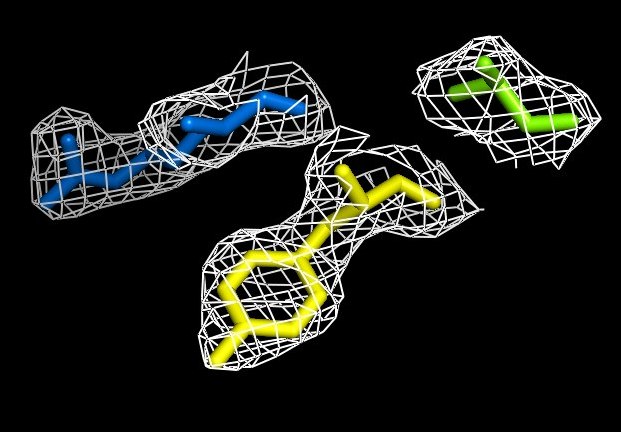
Рисунок 8. Изображение ЭП вокруг выбранных аминокислотных остатков, 1 сигма.
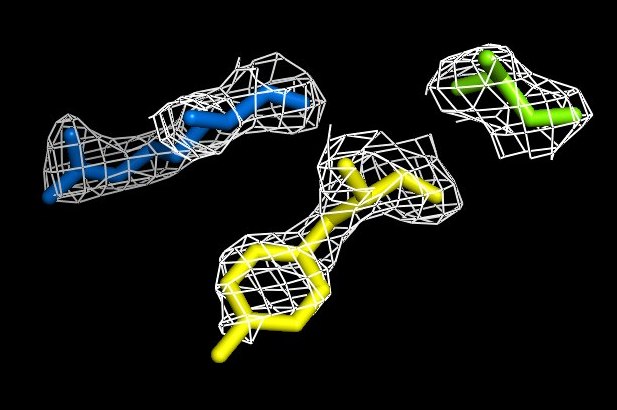
Рисунок 9. Изображение ЭП вокруг выбранных аминокислотных остатков, 2 сигма.
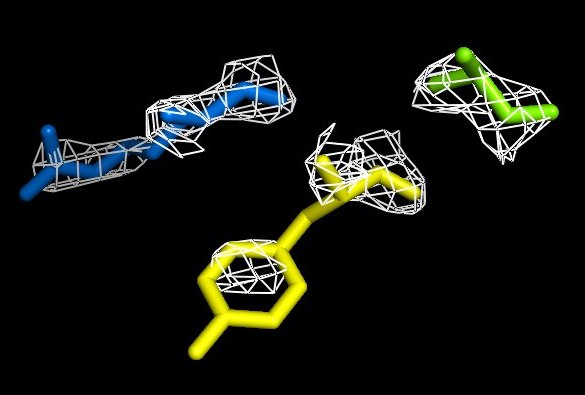
Рисунок 10. Изображение ЭП вокруг выбранных аминокислотных остатков, 3 сигма.
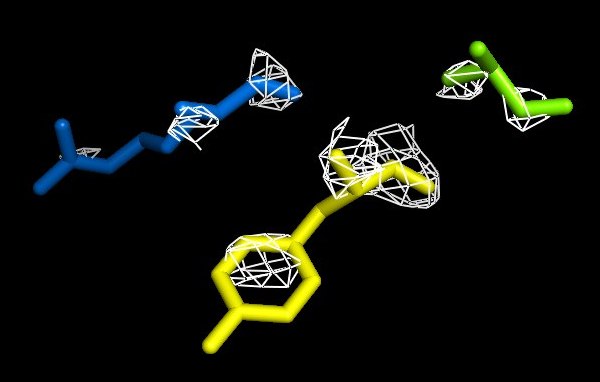
Рисунок 11. Изображение ЭП вокруг выбранных аминокислотных остатков, 4 сигма.
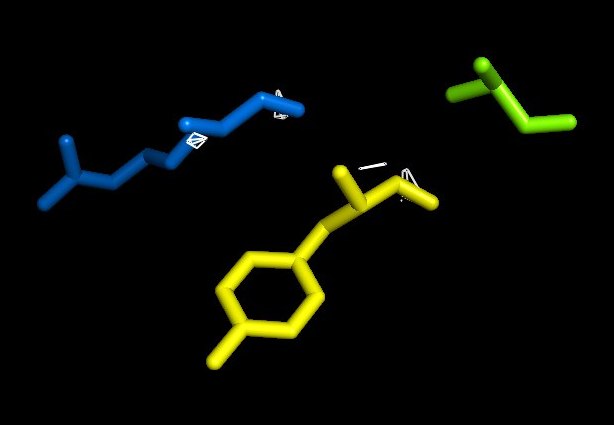
Рисунок 12. Изображение ЭП вокруг выбранных аминокислотных остатков, 5 сигма.
Изучив изобажения 8-12, становится ясным, положение атомов и тип аминокислоты можно довольно точно определить по электронной плотности.
При увеличении уровня подрезки видно, что электронная плотность уходит в первую очередь с С атомов радикалов, но остаётся
на остовных атомах и ароматическом кольце тирозина. Мне кажется интересным то, что при уровне орезки 4, электронная плотность
всё ещё видна не только для всех остовных N-атомов (у который избыток электронной плотности), но и С-атомов (рисунок 13).
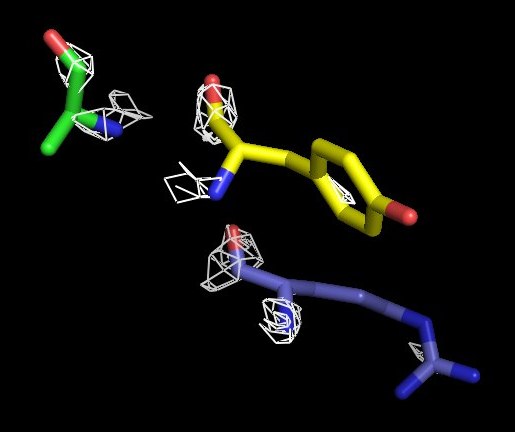
Рисунок 13. Изображение ЭП вокруг выбранных аминокислотных остатков под другим ракурсом, 4 сигма.
|













