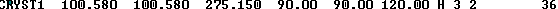|
|
В PDB-файле для структуры белка PurR указаны параметры
элементарной ячейки кристалла в поле CRYST1:
Рисунок 1. Поле CRYST1 в PDB-файле белка 1a4x.
Длины направляющих векторов ячейки (a, b ,c) - 100.580, 100.580, 275.150.
Углы между направляющими векторами ячейки - 90, 90, 120. Получается, что система координат в ячейке
представляет собой "скошенный" под 120 ° параллелепипед.
Кристаллографическая группа (обозначение типа симметрии кристалла) - Н 3 2.
Количество молекул в элементраной ячейке - 36.
Структура кристалла PurR, восстановленная из элементарной ячейкис помощью функции:
symexp sym, 1a4x, all, 5 (с изображением структур на расстоянии 5Å).
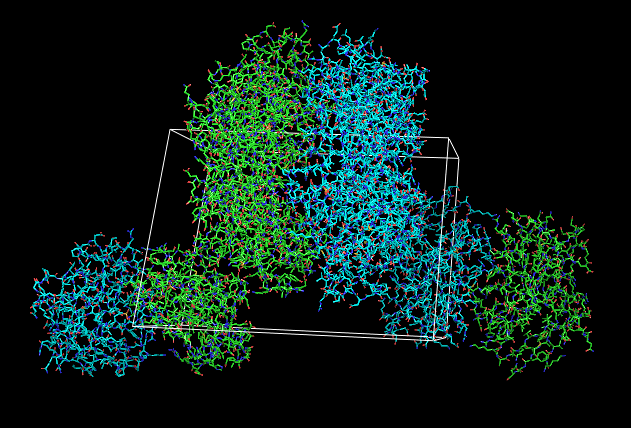
Рисунок 2. Структура кристалла PurR с изображением единиц на расстоянии 5Å.
Зелёным показана цепь А, а синим - В. Показана граница элементарной ячейки.
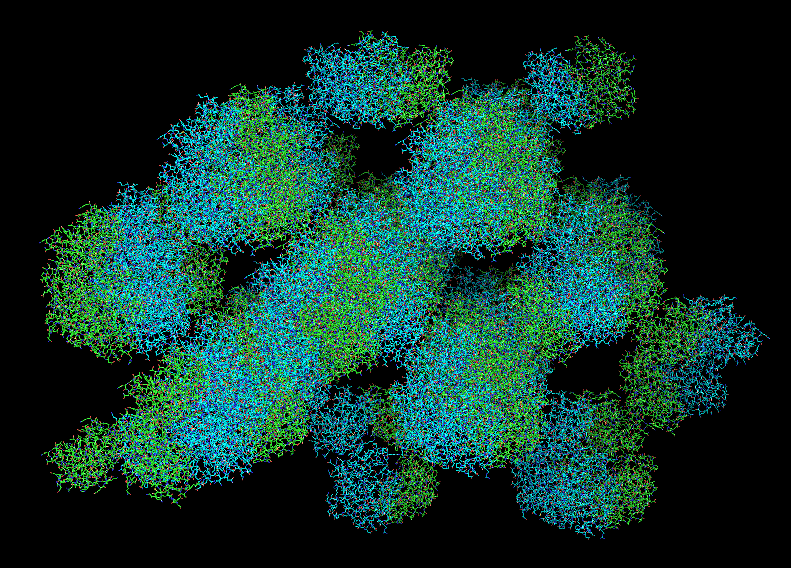
Рисунок 3. Структура кристалла PurR с изображением единиц на расстоянии 20Å.
Зелёным показана цепь А, а синим - В.
Вообще, белок PurR является гомодимером, и в состав асимметрической ячейки входят 2 мономеров (как раз 1 димер).
Получается, что взаимодействия между белками разных элементраных ячеек или просто между ассиметрическими единицами
не буду отражать природные взаимодействия этих белков при олигомеризации. (Я не нашла информации о том,
что этот белок может образовывать какие-либо олигомеры).
Посмотрим для интереса на контакты между белком одной элементарной ячейки (состоящего из двух субъединиц)
и белками в соседних ячейках. Такие контакты наблюдались в шести местах: по три для каждой субъединицы, причём
каждая субъединица контактировала с аналогичными.
Сначала, для сравнения взаимодействия каждой из пар субъединиц я отобрала аминокислотные остатки, лежащие в окрестности 3.5Å
с помощью команды around. Далее нашла водородные связи следующим образом: правое меню > action > find >
polar contacts > within selection. Результаты для двух таких взаимодействий приведены на рисунках ниже:
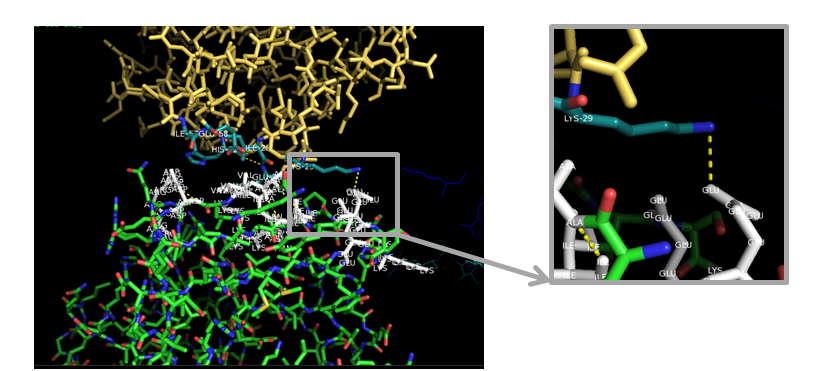
Рисунок 4. Контакт цепи А одной элементарной ячейки (цепь А показана жёлтым, тёмно-зелёным - краевые остатки)
со структурой из соседней ячейки (показана салатовым, белым - краевые остатки). Водородная связь показана жёлтым пунктиром.
Была обнаружена только одна водородная связь:
между концевым атомом N лизина и атомом О на глутаминовой кислоте (интуитивно это понятно: наблюдается взаимодействие
расположенных дальше от остова, ближе к концу радикала, атомов, т е таких, которым удобней взаимодействовать).
v Контакт цепи А одной элементарной ячейки (цепь В показана синим, тёмно-зелёным - краевые остатки)
со структурой из соседней ячейки (показана голубым, белым - краевые остатки). Водородная связь показана жёлтым пунктиром.
Была обнаружена только одна водородная связь:
между атомом азота аспарагина и остовным атомом кислорода лизина. Интересно, что этот аминокислотный остаток
лизина является краевым в последовательности полипептида.
Для данного белка интересней было посмотреть на контакты между двумя субъединицами внутри одной элементарной
ячейки.
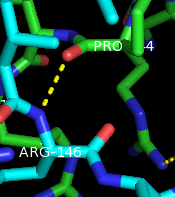
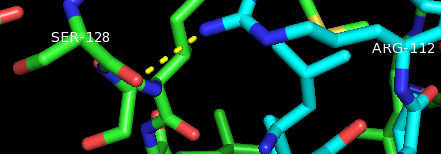
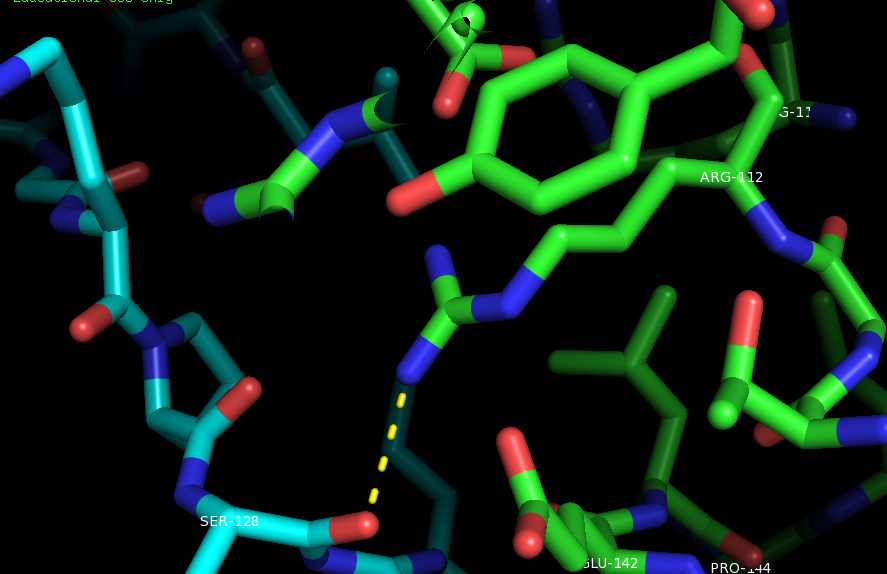
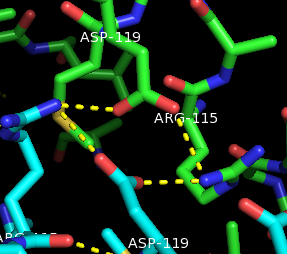
Ниже приведены некоторые аминокислотные остатки, образующие водородные связи: Arg141, Pro144, Arg146,
Arg112, Arg115, Asp119, Asp148, Ser128. Интересно, что в молекуле гомодимера водородные связи образуют
симметричные остатки каждой из субъединиц:
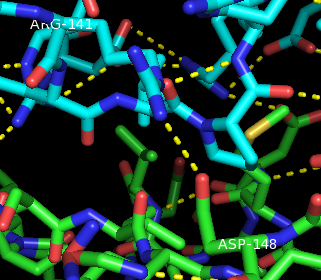 
Рисунки 6,7.Полярные контакты между субъединицами PurR при димеризации. Цепь А показана зелёным, цепь В - синим.
Аминокислоты (Arg141 и Asp148) подписаны белым, а водородные связи отмечены жёлтым пунктиром.
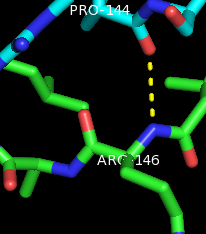 
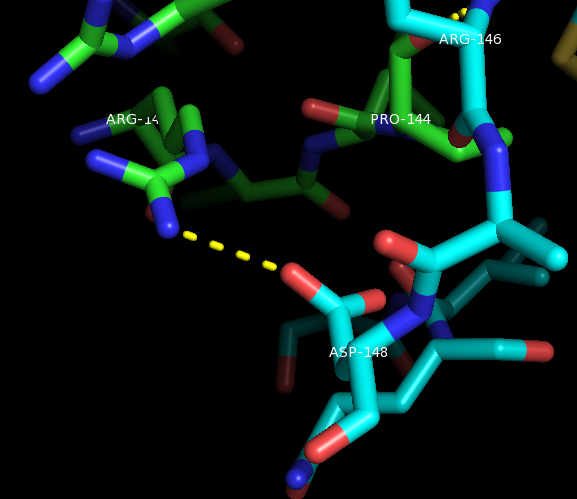
Рисунки 7,8.Полярные контакты между субъединицами PurR при димеризации. Цепь А показана зелёным, цепь В - синим.
Аминокислоты (Pro144 и Arg146) подписаны белым, а водородные связи отмечены жёлтым пунктиром.
Рисунки 8,9.Полярные контакты между субъединицами PurR при димеризации. Цепь А показана зелёным, цепь В - синим.
Аминокислоты (Arg112 и Ser128) подписаны белым, а водородные связи отмечены жёлтым пунктиром.
Рисунки 10.Полярные контакты между субъединицами PurR при димеризации. Цепь А показана зелёным, цепь В - синим.
Аминокислоты (Arg115 и Asp119) подписаны белым, а водородные связи отмечены жёлтым пунктиром.
Я ещё не встречала такого "четверного" связывания. Оно кажется сомнительным.
В этой статье рассказывается о
мозаичных связованиях в рецепторе интерлейкина 4 (IL-4) и приводится похожий случай: здесь в связовании участвуют,
например, Lys, Tyr, Glu, Tyr.
Объяснение странного расположения белковых цепей в структуре ДНК-белкового комплекса.
Была выбрана структура 1mnm
(конец альфа-спирали, уходящий вдаль).
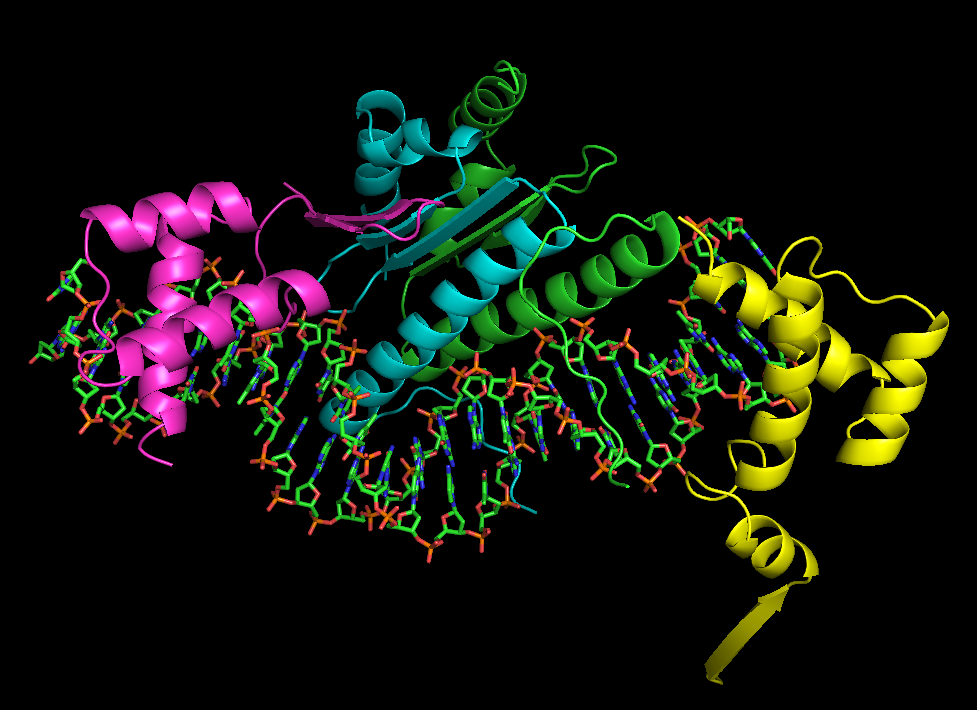
Рисунок 11. Структура ДНК-белкового комплекса 1MNM. Белковая часть отмечена
с помощью cartoons, ДНК - sticks.
Это странное положение может быть объяснено таким определением элементарной ячейки.
Но при изображении соседних ячеек все особенности исчезают: бета-слой принимает принимает более "устойчивое" положение
в окружении других субъединиц. (Рисунки 12,13).
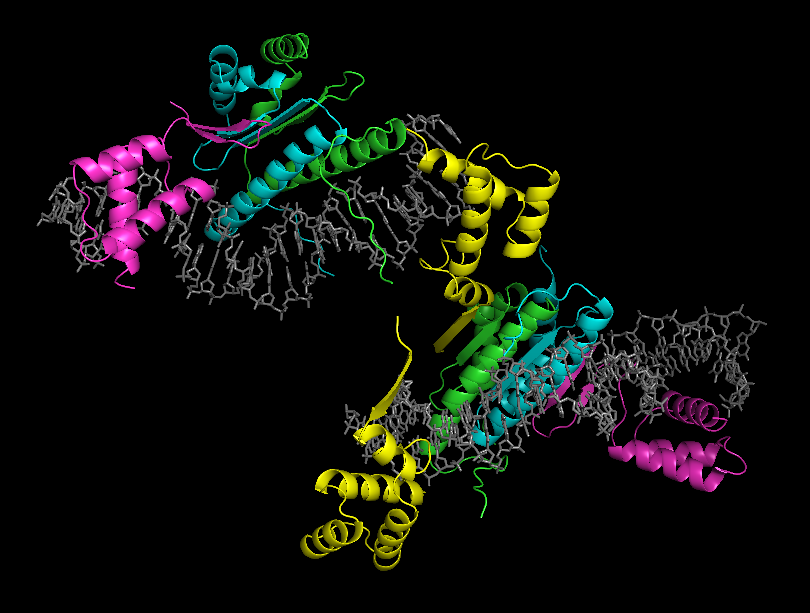
Рисунок 12. Структура ДНК-белкового комплекса 1MNM.
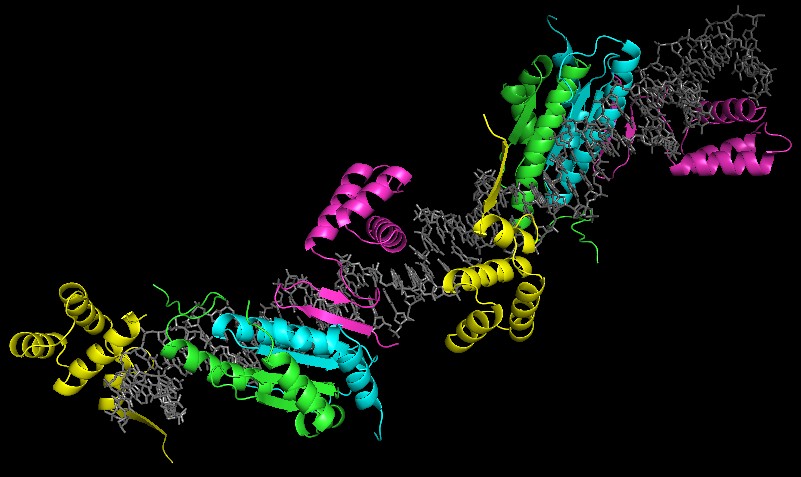
Рисунок 13. Структура ДНК-белкового комплекса 1MNM.
Приведение примеров PDB-файлов, асимметрическая единицы которых не совпадает с биологической единицей.
Биологическая единица - это то сочетание цепей белка, в котором, как предполагают ученые,
этот белок выполняет свои функции в живой природе.
А асимметричная единица - это минимальная часть молекулы, к которой можно
применить преобразования симметрии такие, что кристалл переходит сам в себя.
Примеры белков, у которых эти единицы не совпадают:
 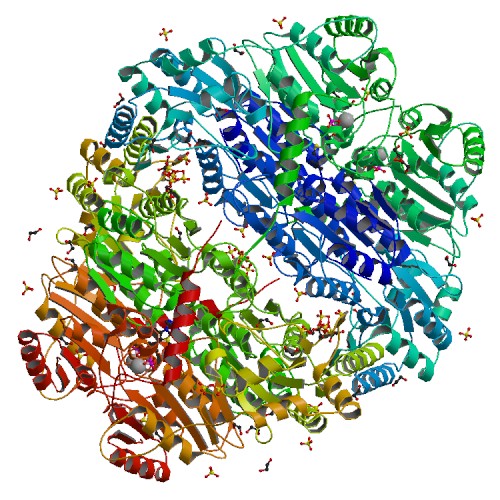
Рисунок 14.Белок с PDB-кодом 5TMA. Слева асимметрическая единица, справа - биологическая.
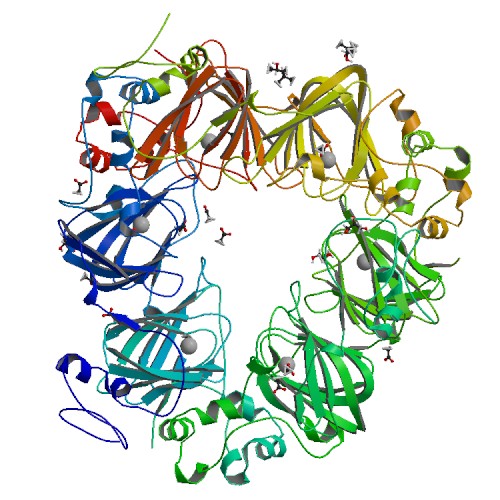 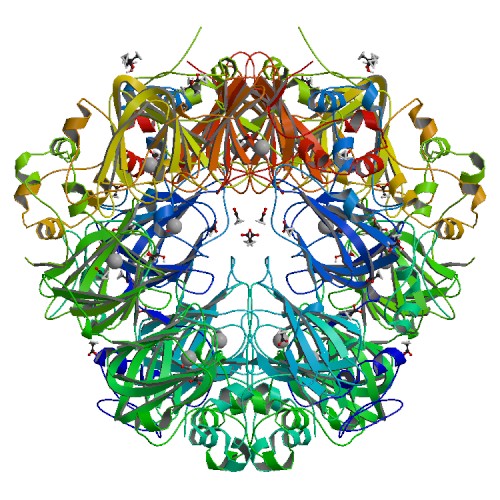
Рисунок 15.Белок с PDB-кодом 5VG3. Слева асимметрическая единица, справа - биологическая.
|