
Практикум 4
Анализ ЯМР файла
|
|
|
Я сравнивала структуры растительного белка (аллергена), полученные методами ЯМР
(1B6F и
PCA 1BV1).
В ЯМР-структуре содержится 23 модели. Разрешение РСА-модели - 2 Å.
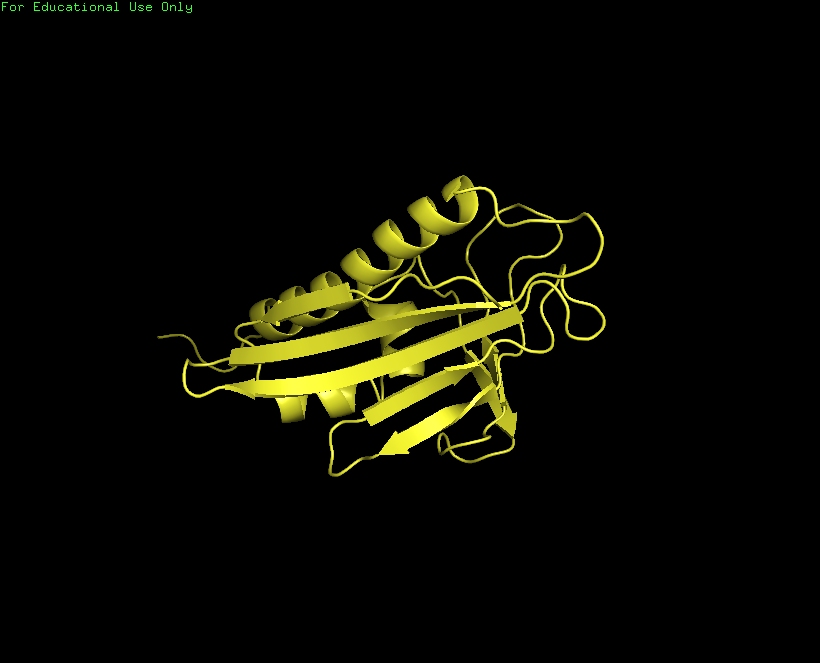 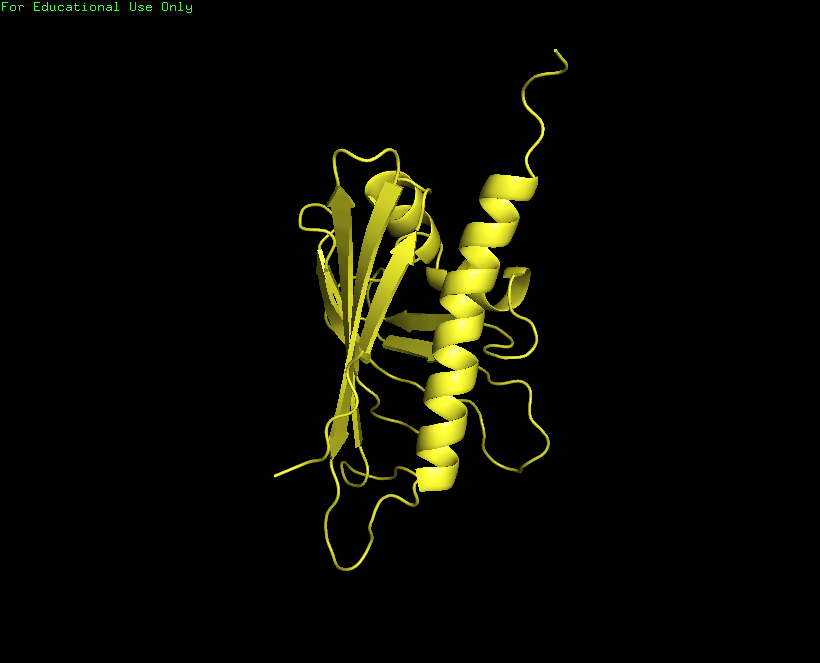
Рисунок 1.Структура белка, расшифрованная методом
ЯМР - 1B6F.
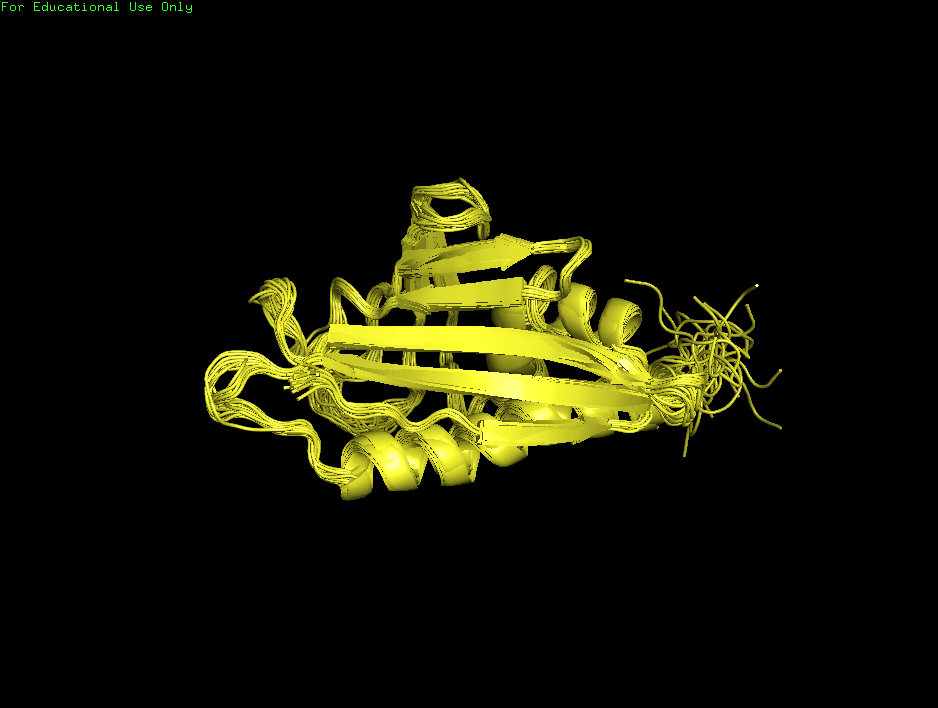 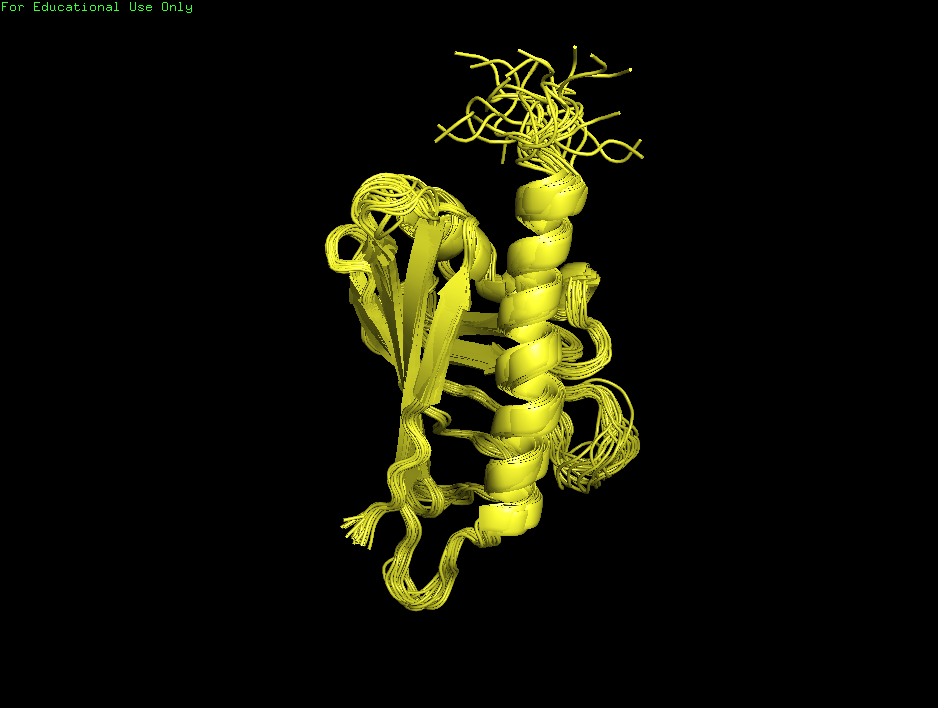
Рисунок 2.Структура белка, расшифрованная методом
ЯМР - 1B6F. Изображены всё 23 модели с помощью команды: split_states NMR.
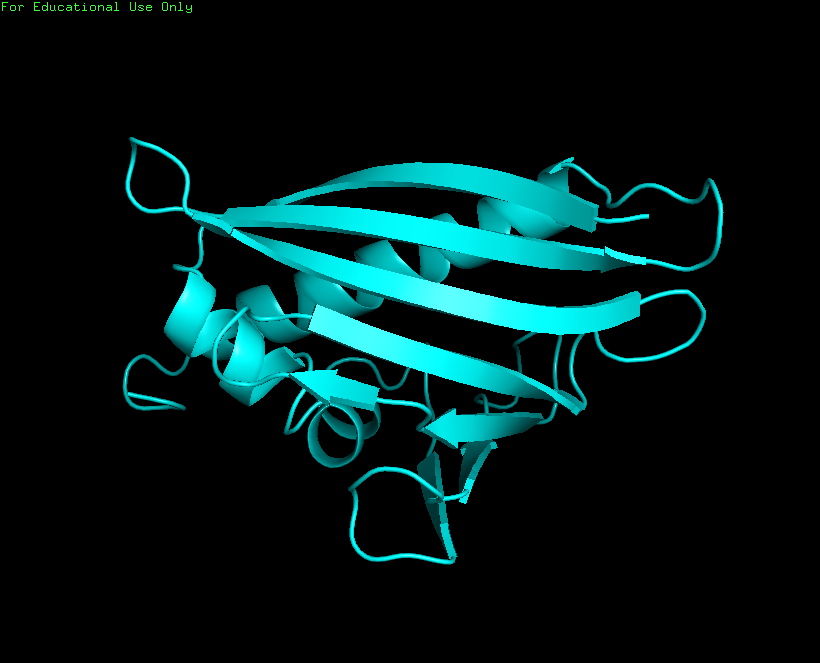 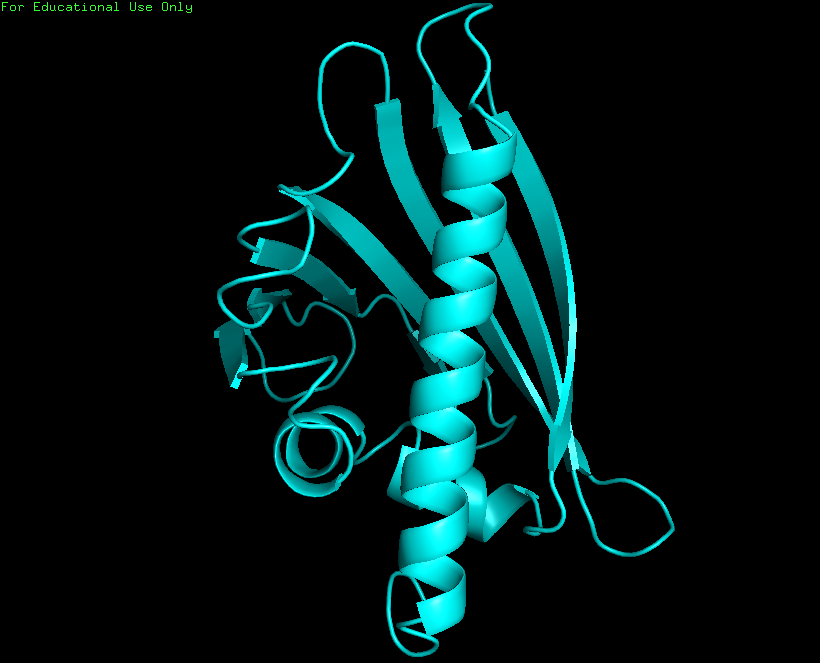
Рисунок 3.Структура белка, расшифрованная методом
PCA - 1BV1.
Затем, исследовалось несколько аминокислотных остатков, между которыми образуются водородные связи:
| между остовными атомами внутри глобулы белка (Ala135 и Met139)
| водородную связь боковых цепей в ядре белка (Lys32 и Asn28)
| водородную связь в петлях, выходящих на поверхность глобулы (Ala34 и Ala37)
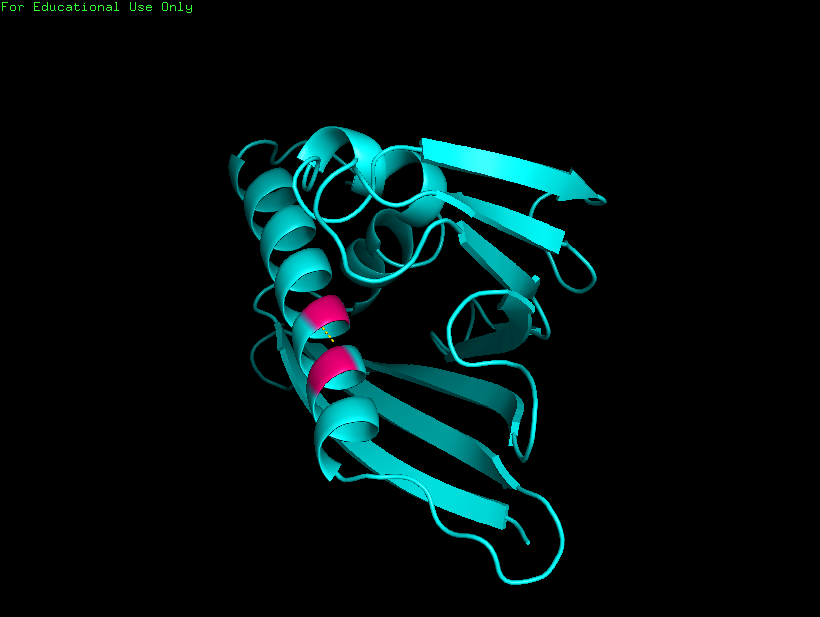 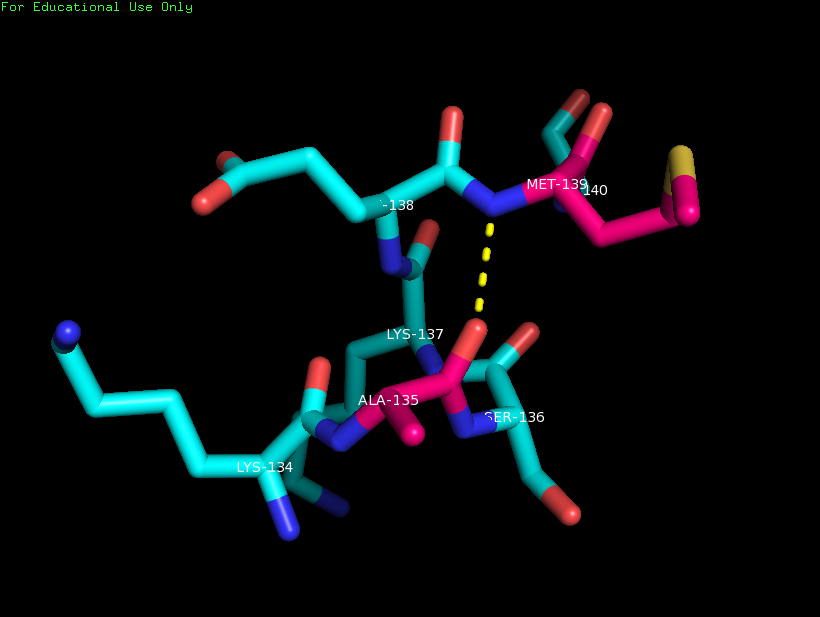
Рисунок 4.
Водородные связи между остовными остатками: Ala135 и Met139 внутри глобулы белка.
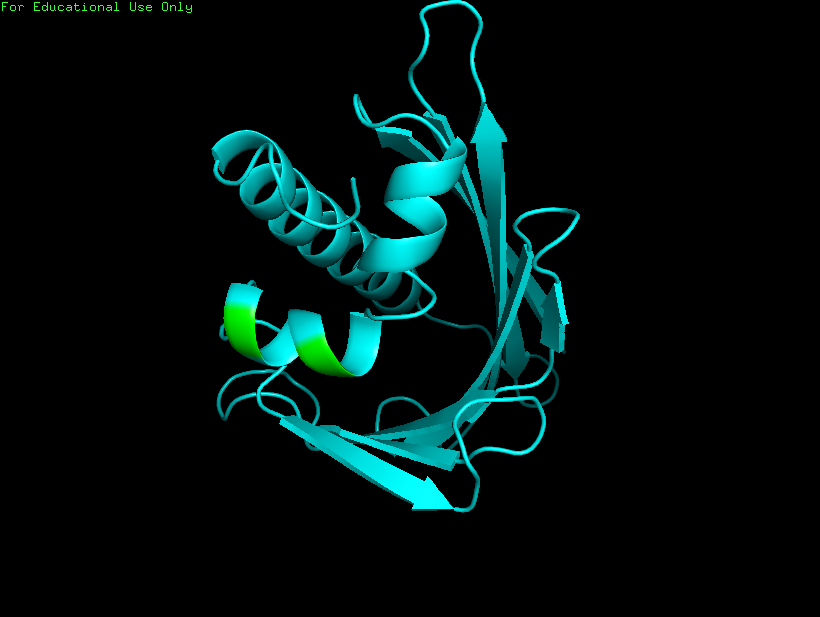 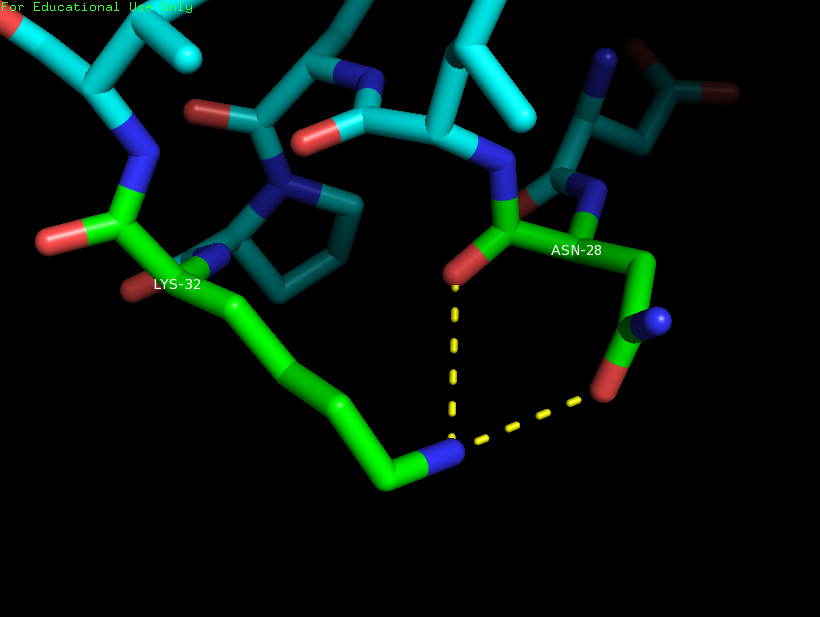
Рисунок 5.
Водородные связи между остатками: Lys32 и Asn28, расположенными между боковыми цепями
аминокислот внутри глобулы белка.
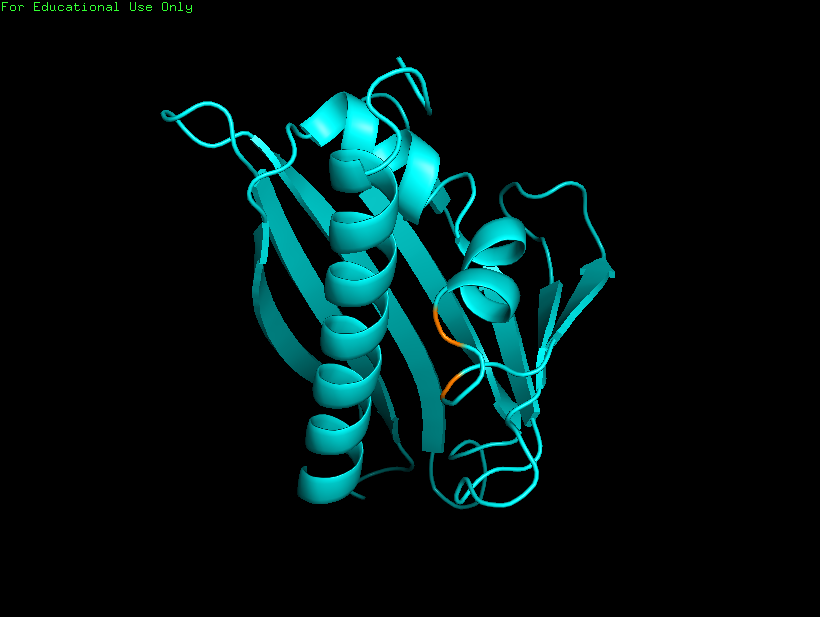 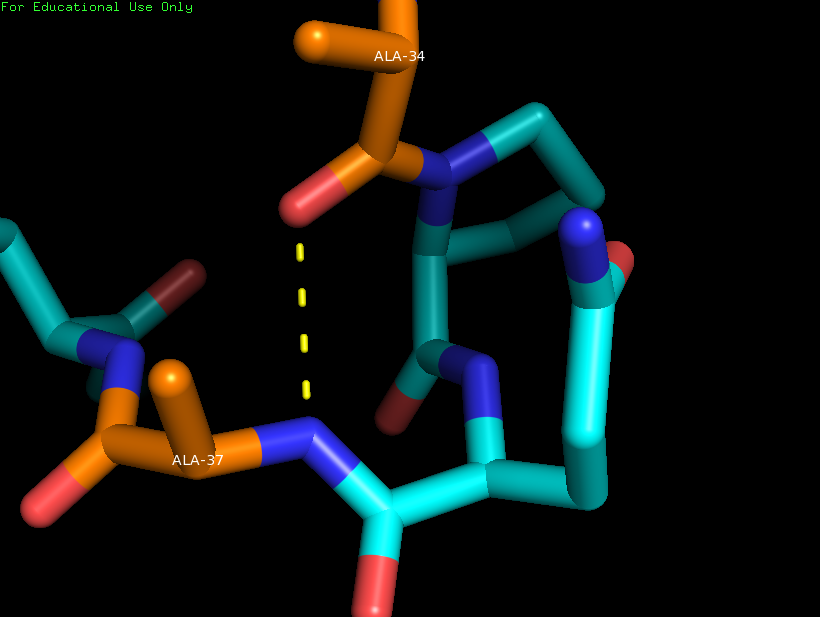
Рисунок 6.
Водородные связи между остовными атомами в петле между Ala34 и Ala37.
Далее были посчитаны расстояния между приведенными выше дононарами и акцепторами водородной связи
в каждой из 23 моделей структуры ЯМР и были получены средние значения. Для поиска длин водородной связи
каждой модели применялась команда:
distance hbonds, /1B6F_0001/A/A/ASN`78/N, /1B6F_0001/A/A/ASP`75/OD1, 3.5, mode = 2 (на примере одной из них в модели 1B6F_0001).
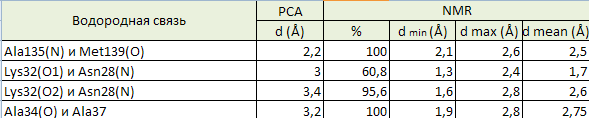
Наиболее стабильными оказались водородные связи между атомами в остове белка внутри глобулы (Ala135(N) и Met139(O)), что понятно,
и водородные связи в петлях, выходящих на поверхность глобулы (Ala34(O) и Ala37(N)), что интересно. Видимо, это связяно с тем,
что эта петля окружжена структурированными участками, которые сдерживают её движение.
|
|
|
© Мария Медведева 2017
|













