Альтернативные положения, B-фактор, кристалл
В течение данного практикума я работала с белком металло-бета-лактомазой VIM1 (PDB ID: 7AFY). Этот белок относится к классу гидролаз.
Задание 1. Альтернативные конформации.
Поскольку для рентгеноструктурного анализа белок кристаллизуют, некоторые молекулы белка могут сворачиваться немного по-разному и отдельные аминоксилотные остатки могут находиться в разных положениях. Например, один и тот же аминокислотный остаток в части молекул может взаимодействовать с одним остатком, а в другой части молекул быть в другом положении и взаимодействовать с другим остатком или остатками. Если одного из вариантов сильно больше, чем других, то в расшифровке представлен только он, но если соотношения примерно одинаковые, можно увидеть альтернативные конформации.
Для атомов, имеющих несколько возможных положений, в pdb файле указывается населенность. На уровне кристалла этот параметр можно понять как доля ячеек, в которых данный атом расположен именно так.
В данном задании я рассматривала 75 ARG цепи А. В PDB для этого остатка прописано два положения, для каждого положения населенность равна 0,50.
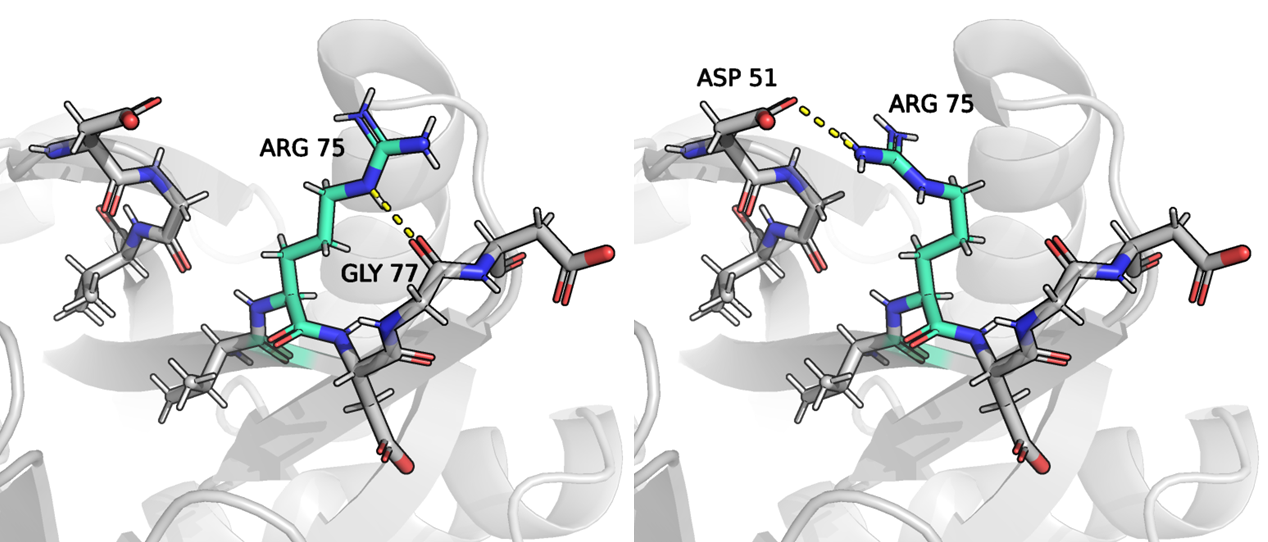
Рисунок 1.
На рисунке 1 отображены два разных положения 75 ARG. Слева данный остаток аргинина связан с остовом, в частности с аминокислотным остатком 77 GLY. Справа же аргинин соединен водородной связью с остатком аспарагиновой кислоты, что примечательно, этот остаток принадлежит другой петле. Левый альт-лок мне кажется более стабильным, так как справа аргинин достаточно неестественно выгнут и структура мне кажется напряженной. При этом слева аргинин находится в комфортном положении, кроме того, он стабилизирован водородной связью. Населенность обоих положений одинакова, но я предполагаю, что это может быть вызвано условиями эксперимента (кристалл) и что в нативном состоянии преобладает правый альт-лок.
Задание 2. В-фактор.
Существует еще один параметр в задаче интерпретации электронной плотности - В-фактор. Он позволяет дополнительно "раздуть" колокол электронной плотности от определенного атома. Поскольку мы точно не знаем расположение некоторых атомов, от них возникает "размытие" электронной плотности.
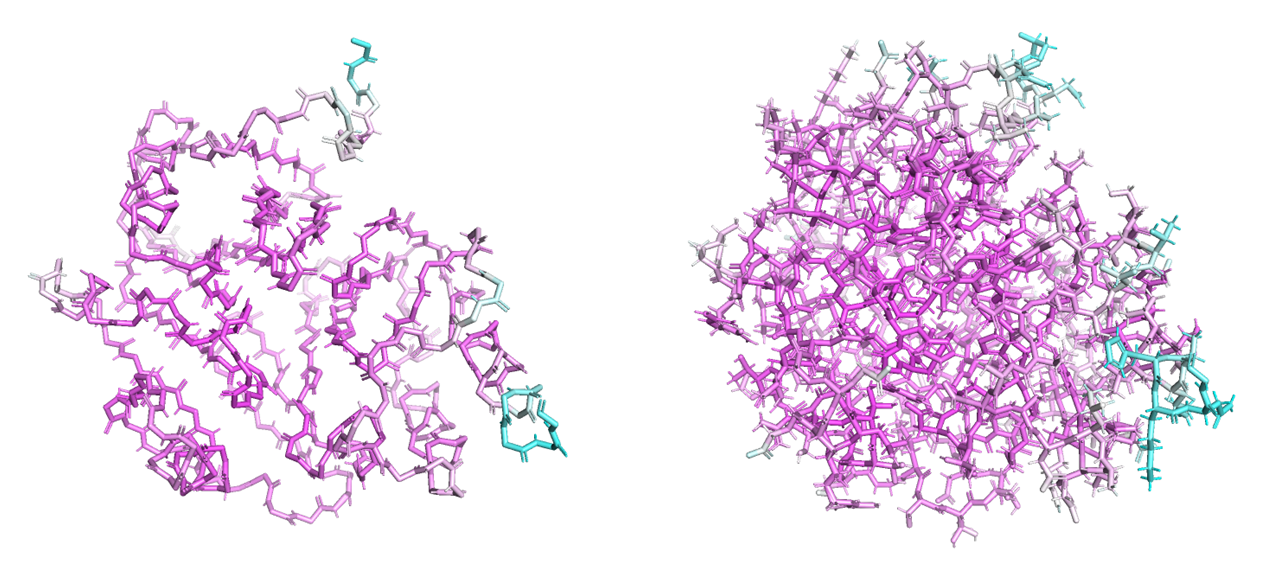
Рисунок 2.
На рисунке 2 справа изображен остов, а слева весь белок металло-бета-лактомаза VIM1, покрашенный по В-фактору. Атомы с низким В-фактором сиреневые, а с высоким - голубые. По картинкам хорошо видно, что у атомов на N-конце и C-конце В-фактор очень высокий. Также, видно, что некоторые торчащие из молекулы кусочки тоже имеют относительно большой В-фактор. Однако, в осносном молекула сиреневая, это означает, что у большинства атомов В-фактор низкий. Судя по всему, В-фатор отражает то, насколько мы не уверены, что атом расположен именно в этом определенном месте. То есть, чем ниже В-фактор, тем больше уверенность, что атом на своем месте и наоборот, чем выше В-фактор, тем больше у нас сомнений.
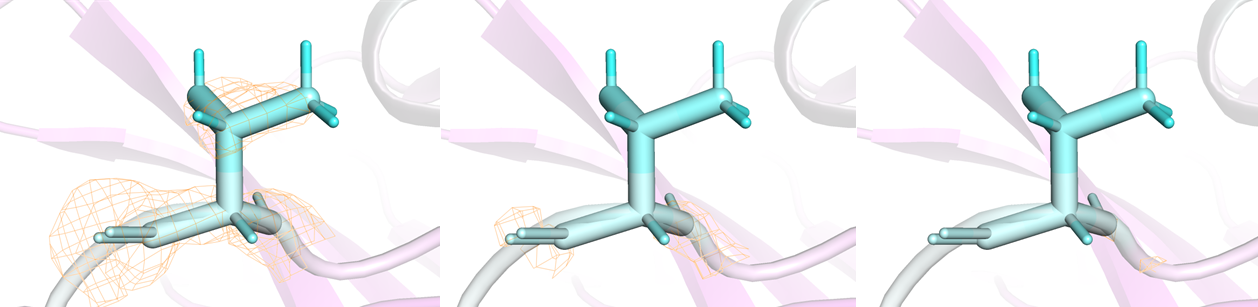
Рисунок 3.
На рисунке 3 изображен 206 остаток треонина. Он тоже покрашен по В-фактору, аналогично рисунку 2. Кроме того, на рисунке 3 можно увидеть электронную плотность (оранжевый цвет) на уровнях подрезки 1, 2 и 3 слева направо, соответственно. Видно, что только на уровне подрезки 1 остаток покрыт электронной плотностью. На уровне подрезки 2 и 3 видно поркытие электронной плотностью только остова, и то на уровне подрезки 3 это практически не заметно. Таким образом, можно сделать вывод, что чем выше В-фактор, тем хуже покрытие электронной плотностью.
Задание 3. Кристалл.
Рентгеноструктурный анализ проводится на кристалах белка и в этом задании нужно было восстановить этот кристалл по данным с PDB.
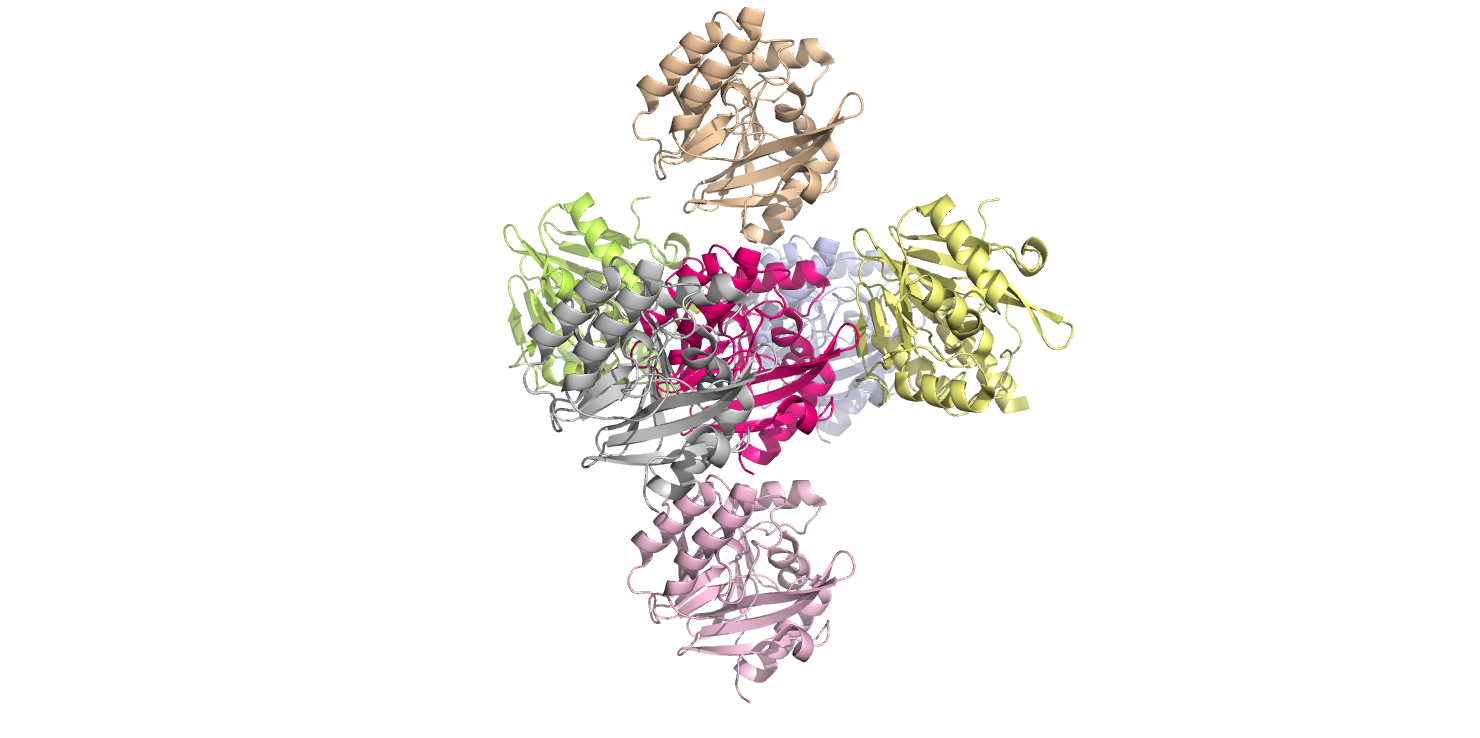
Рисунок 4.
На рисунке 4 избражено несколько молекул белка. Розовая молекула в середине - это исходная молекула. Все молекулы вокруг это сренегированные соседи. Исходная молекула контактирует с 6 соседями. Серая и голубая (перпендикулрные плоскости экрана молекулы), а так же розовая и оранжевая (вертикально расположенные молекулы) сдвинуты относительно исходной молекулы без поворота. Другие две молекулы (желтая и зеленая) раположены кверх ногами, относительно исходной молекулы. Получается, молекулы взаимодействуют между собой тремя разными способами.