Связывание лигандов. Карманы связывания. Индуцированное соответствие
Задание 1. Изменения
Часто белок при связывании с лигандом претерпевает изменения в структуре. В данном задании мне было дано два файла: со свободной структурой и со связанной с лигандом структурой. Наиболее интересные изменения в белке при связывании с лигандом по идее происходят в кармане связывания.
В данном белке карман связывания не сильно изменился после связывания с лигандом. Большинство остатков сместилось незначительно, буквально на 0.5 Å. Некоторые остатки вообще практически не сдвинулись с места. И совсем небольшая доля остатков заметно поменяли расположение в пространстве.
На рисунке 1 показаны обе структуры, наложенные друг на друга и отображенные в виде cartoon (слева) и sticks (справа). Светло голубым отображена свободная структура, а светло розовым - связанная с лигандом структура.
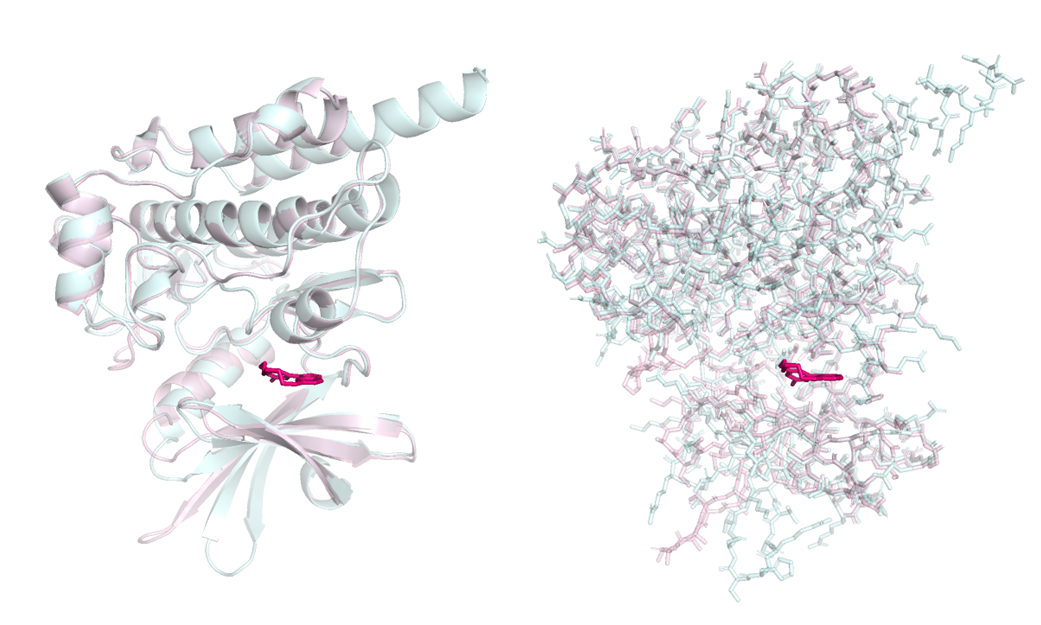
Рисунок 1.
Из изображений белка целиком видно, что свободная и связанная структуры не очень сильно различаются. Еще я решила продемонстрировать общий план кармана связывания немного покрупнее. Его можно увидеть на рисунке 2.
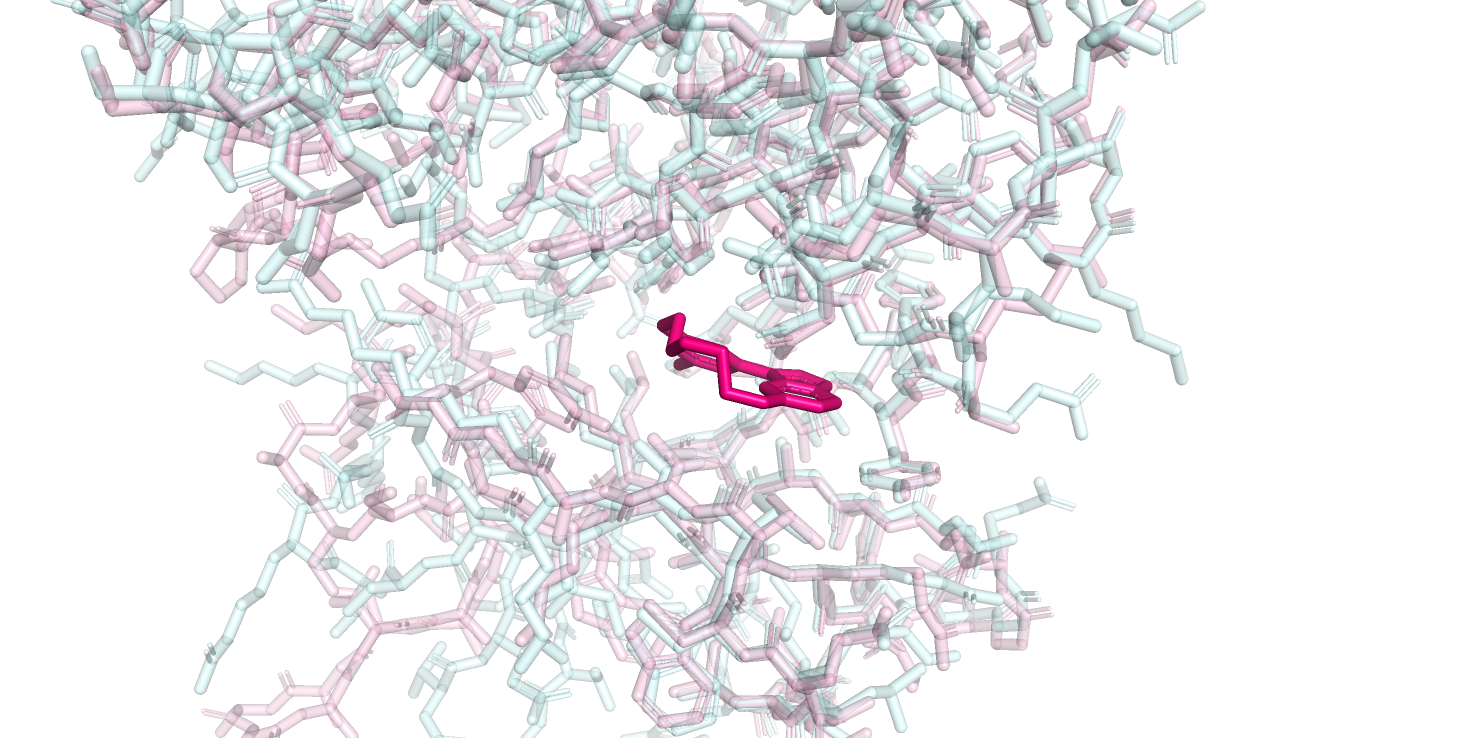
Рисунок 2.
Я понимаю, рисунок 2 не особо наглядный, но даже на нем уже видно, что положения многих остатков свободной и связанной структур в кармане связывания совпадают либо практически совпадают друг с другом.
Далее я более детально рассмотрела некоторые изменения в структурах.
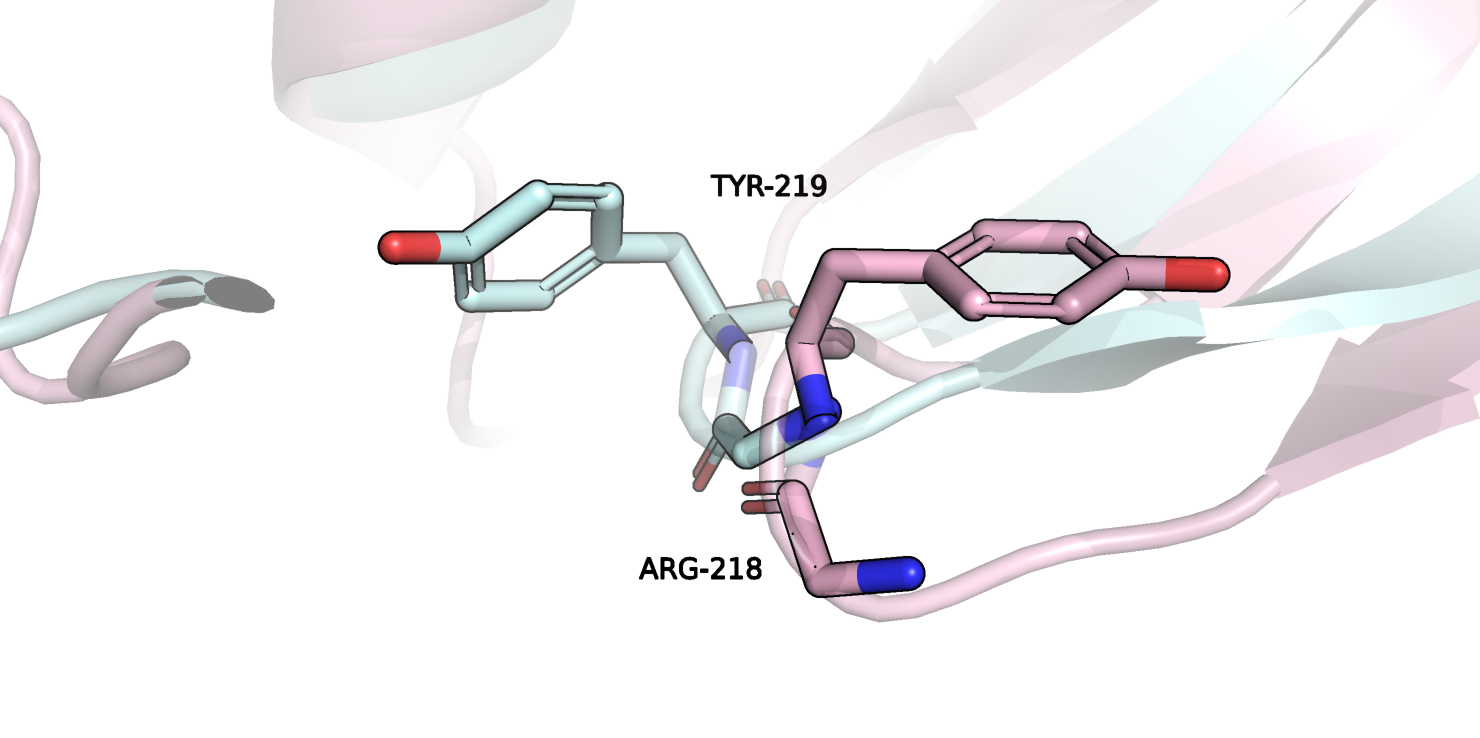
Рисунок 3.
На рисунке 3 изображены два положения остатка тирозина 219 и остов остатка аргинина 218 (голубой - свободная структура, розовый - связанная). В связанном состоянии он сильно повернулся относительно свободного состояния. Возможно, это произошло за счет гидрофобного эффекта, стабилизирующего лиганд. Похожие изменения произошли еще с несколькими остатками.
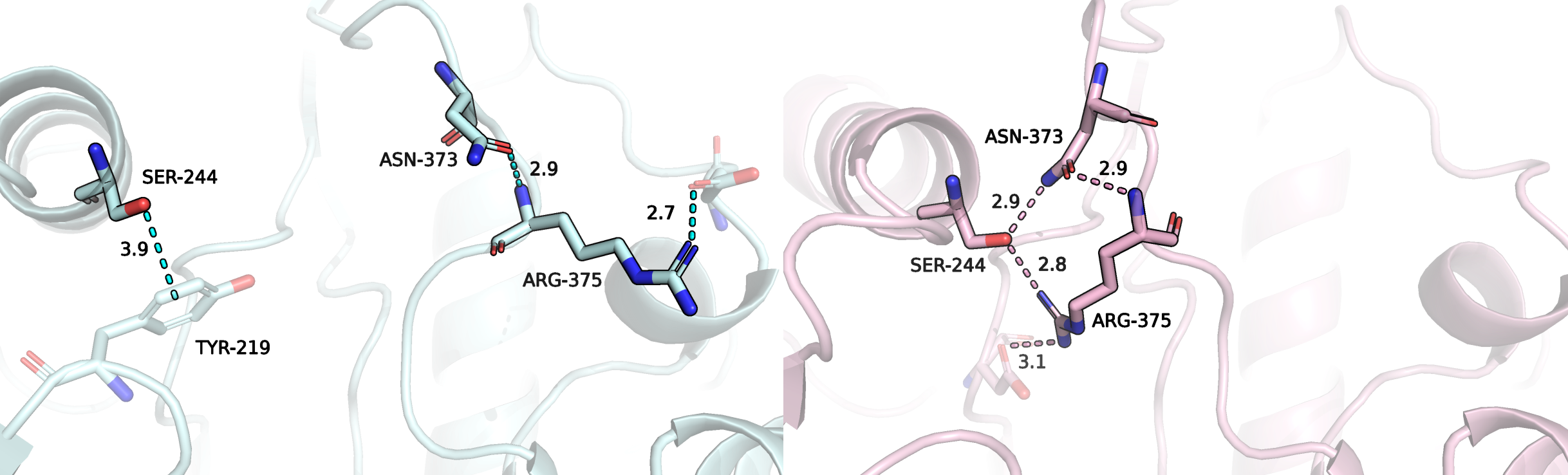
Рисунок 4.
На рисунке 4 изображены три остатка, положения которых сильно отличаются в свободном и связанном положениях. Это остатки серина 244, аспартата 373 и аргинина 375. На рисунке также изображены взаимодействия, стабилизирующие положения остатков. На рисунке 5 все эти остатки изображены в связанной (розовый) и свободной (голубой) структурах, наложенных друг на друга.
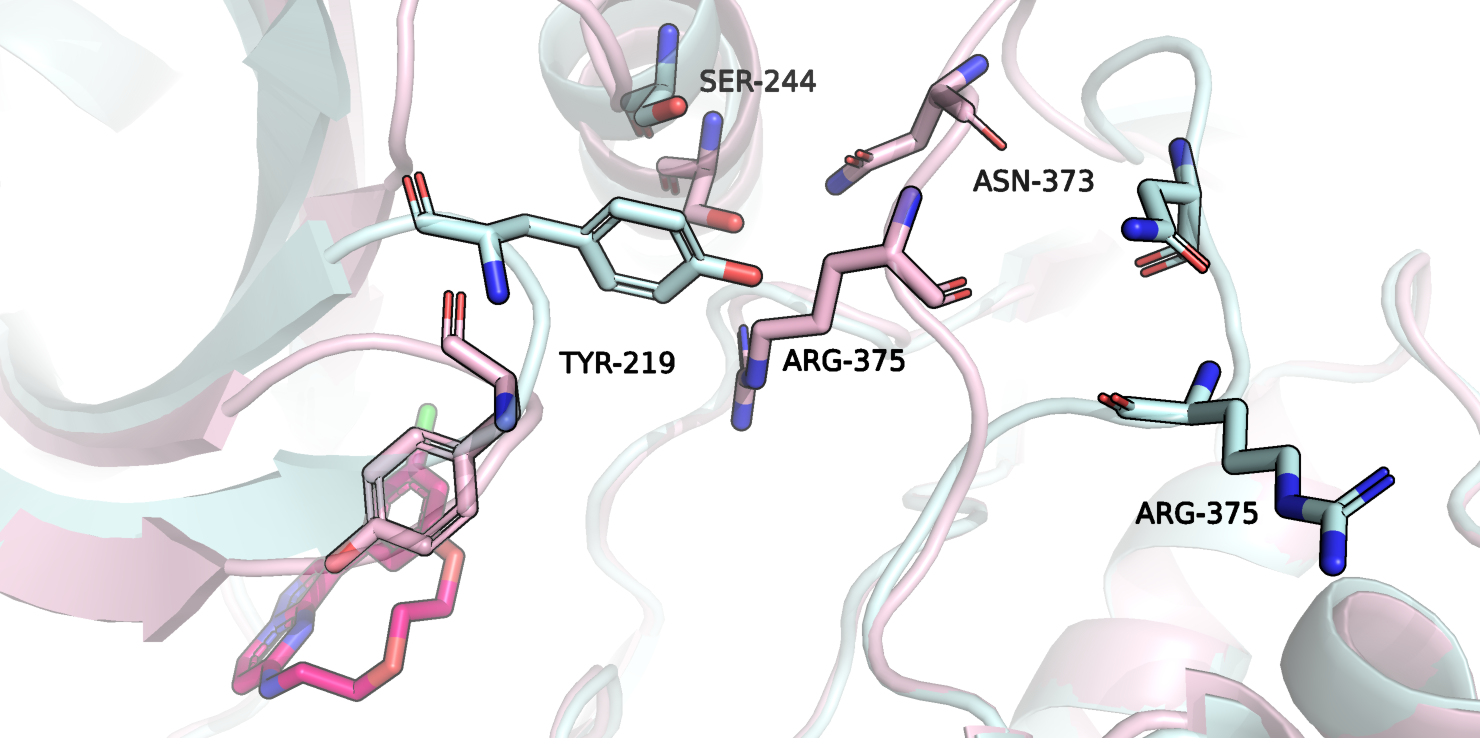
Рисунок 5.
Из рисунка выше видно, что остатки сдвигаются в направлении лиганда. Тирозин 219 сдвигается к лиганду под действием гидрофобного эффекта. Видимо, чтобы заполнить образовавшуюся полость вслед сдвигаются и другие остатки.
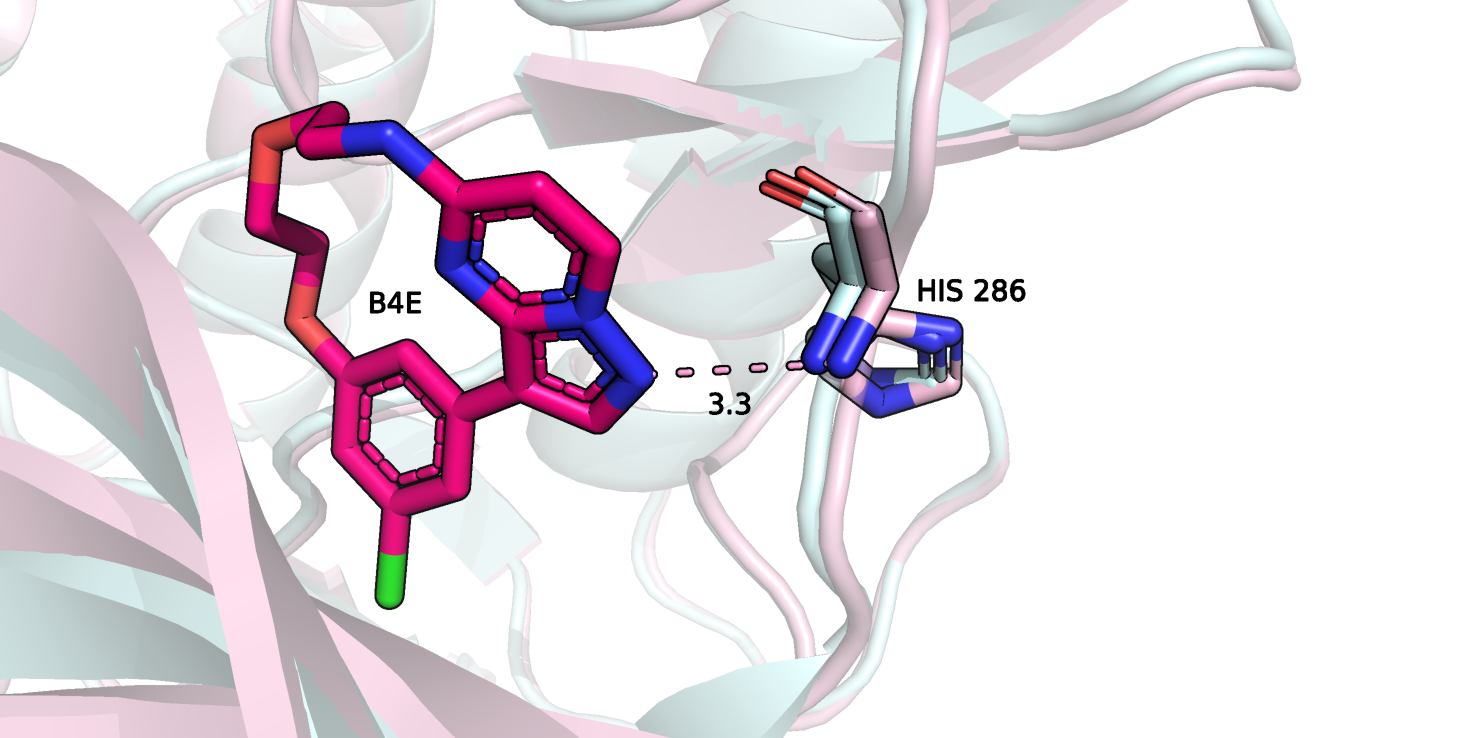
Рисунок 6.
На рисунке 6 я отобразила единственную водородную связь с лигандом, которую я нашла. Любопытно, что остаток, образующий связь, можно сказать, остался неподвижным. Эту водородную связь лиганд образовал с остовом гистидина 286.
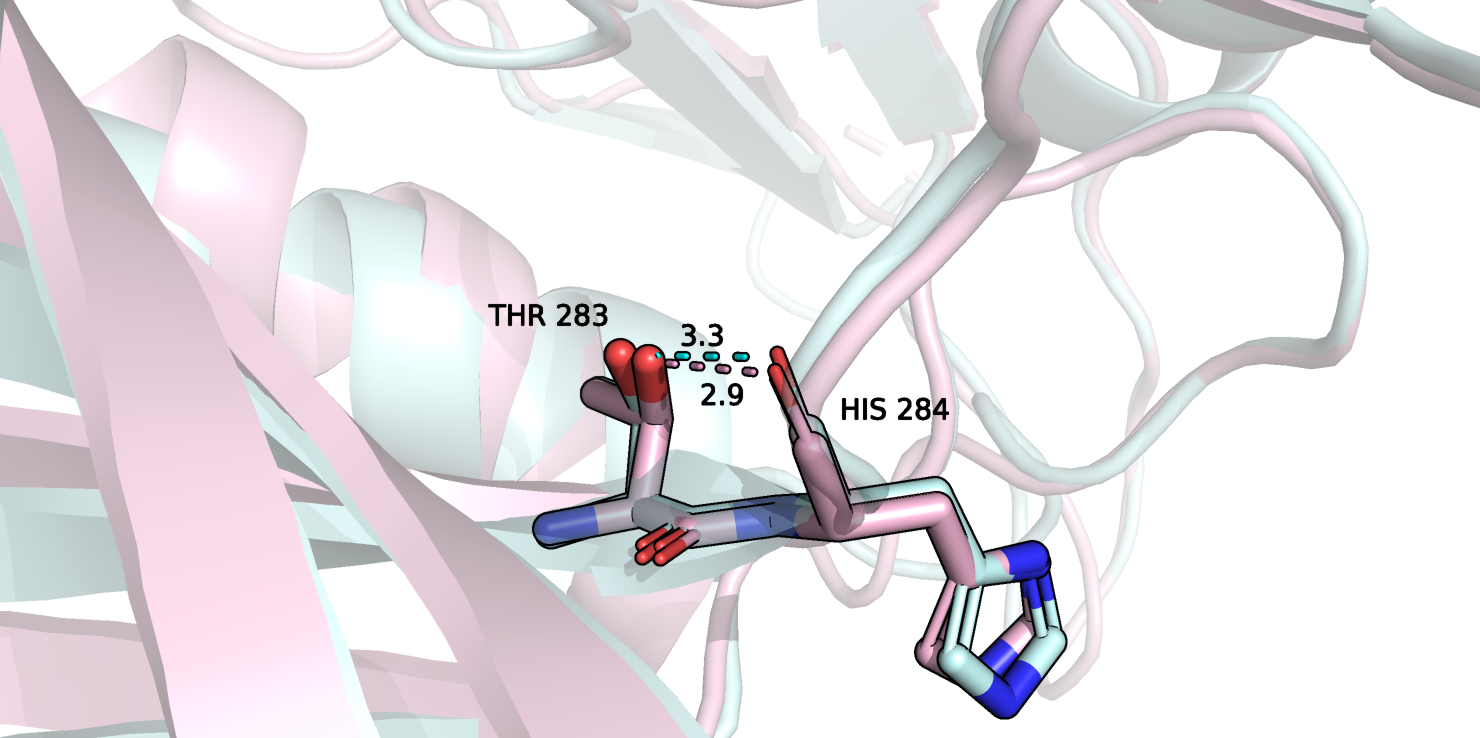
Рисунок 7.
На рисунке 7 изображена пара остатков: треонин и гистидин, в обеих структурах (цветовая гамма сохраняется). Как видно, в связанной структуре расстояние между атомами сократилось на 0.4 Å, что сделало связь стабильнее.
К сожалению, я больше не нашла новых связей или усиления существующих связей. Однако, я нашла несколько случаев ослабления связей в связанной структуре по сравнению со свободной. Один из случаев я отобразила на рисунке 8.
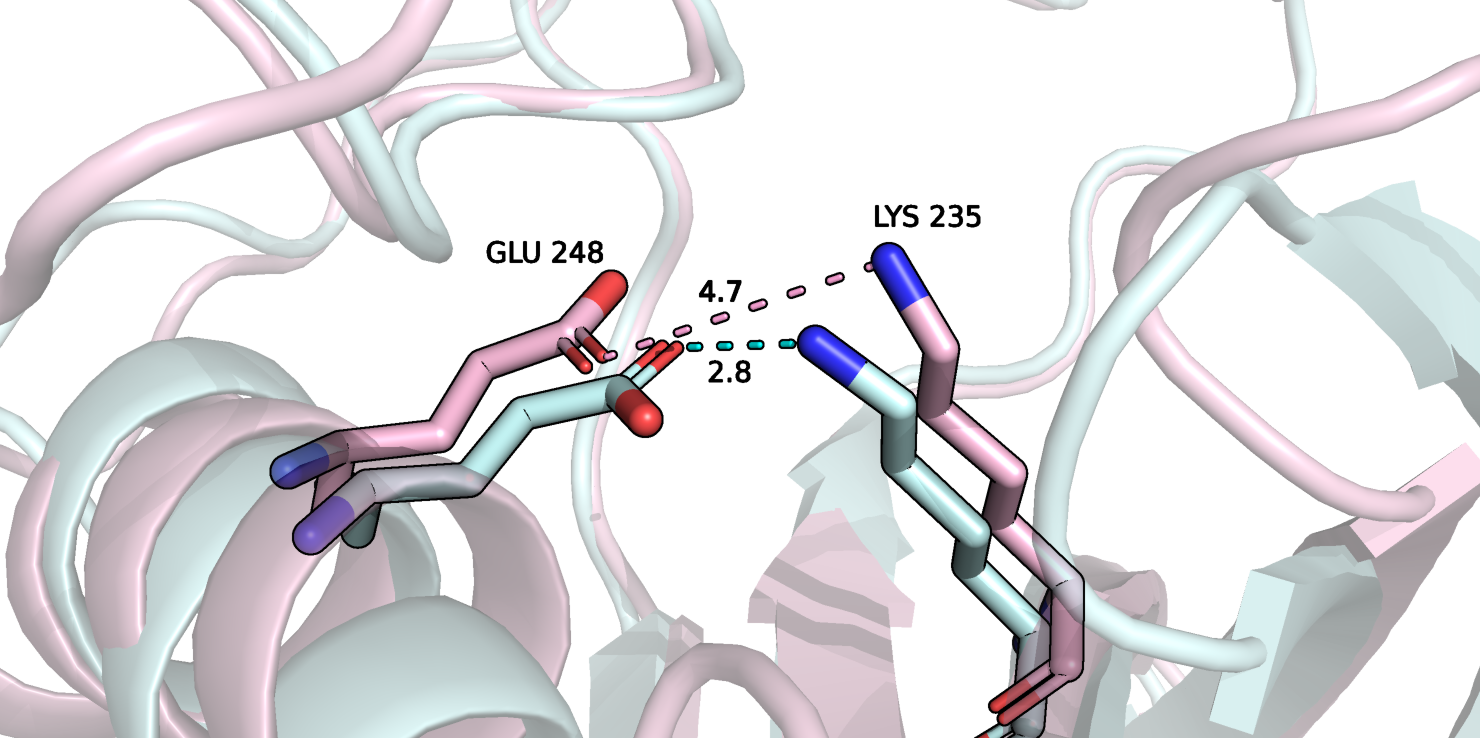
Рисунок 8.
На рисунке 8 очень наглядно видно, что в свободной структуре была водородная связь между глутаминовой кислотой и лизином, однако, после присоединения лиганда остатки отдаляются друг от друга и связь "рвется". Этот случай не единственный. Я нашла кроме него ещё минимум три таких случая, просто не стала приводить для них картинки.
После детального рассмотрения карманов связывания я воспользовалась сервисом POCASA, чтобы автоматически выделить полости в структурах.
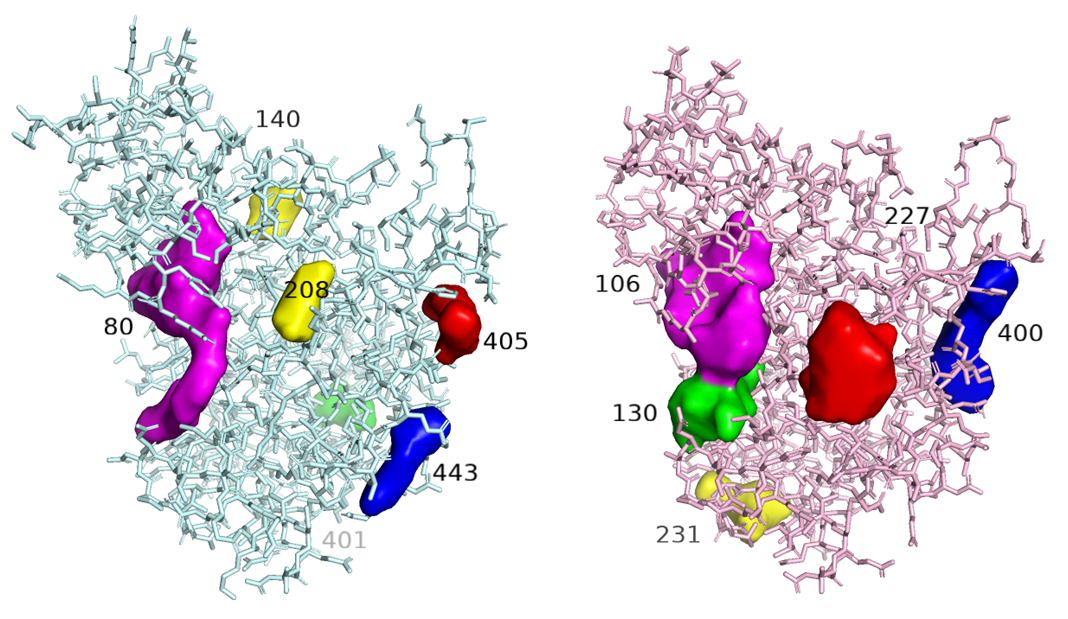
Рисунок 9.
На рисунке 9 изображены свободная и связанная структуры белка и топ 5 автоматически найденных в них полостей. Полости раскрашены по уменьшению размера: фиолетовый, красный, синий, зеленый и желтый (от наибольшего размера к наименьшему). На мой взгляд, выдача выглядит достаточно правдоподобной, по крайней мере для топа 3 каждой структуры. Что любопытно, в связанной молекуле полости оказались больше, чем в свободной. Что касается полости под связывание лиганда, то это самая большая, фиолетовая полость, которая, к слову, в связанной структуре тоже больше, чем в свободной. Более наглядно я отобразила белок, полость и лиганд на рисунке 10.
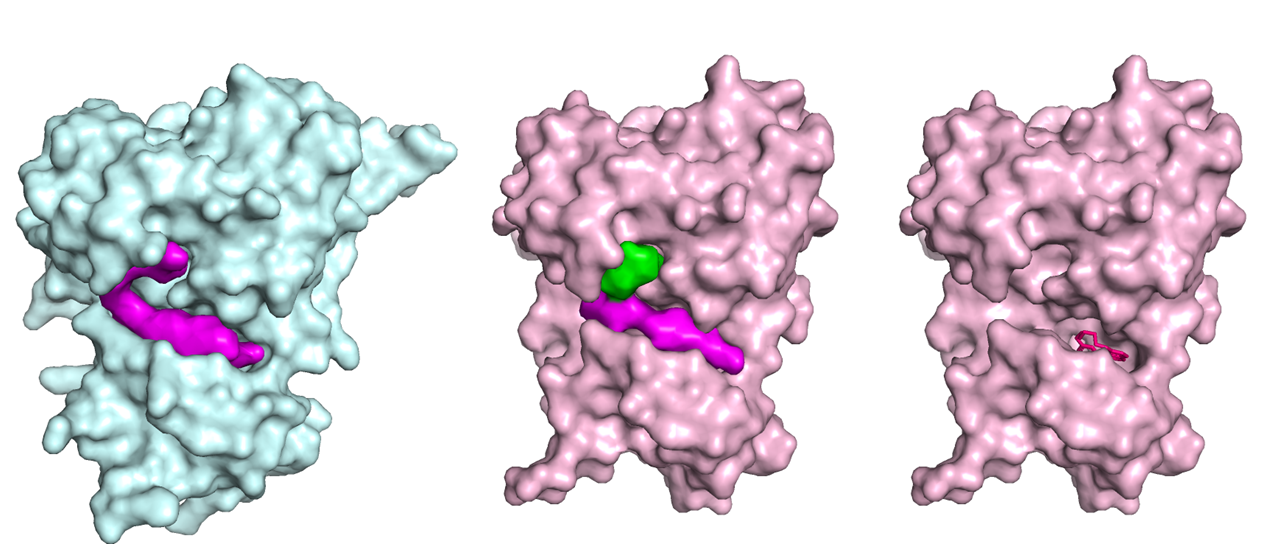
Рисунок 10.
Посмотрев в сравнении на полости свободной и связанной формы, я склонилась к идее, что полость под лиганд в связанной форме была разделена программой на две почему-то. При том, что эта полость практически полностью повторяет по форме полость в свободной структуре.
В целом, можно сделать вывод, что никакого "стягивания" при связывании белка с лигандом не происходит. А даже наоборот, "карман" увеличивается в размерах, рушатся многие водородные связи и некоторые остатки оказываются расположенными более хаотично. Я немного не ожидала таких результатов, однако, могу предположить, что это связано с достаточной гидрофобностью лиганда и тем, что лиганд вместо того чтобы "стягивать" белок новыми связями, немного расталкивает атомы своей гидрофобикой.
Задание 2. Протонирование, подготовка к докингу
Для определения положения лиганда в кармане связывания белка используется докинг. В задании 2 и 3 я использовала докинг, чтобы сымитировать ранние стадии связывания лиганда с карманом связывания. Поэтому, я взяла структуру белка для свободной формы и лиганд из связанной формы.
Для успешного докинга нужны протонированные белок и лиганд. Чтобы получить протонированный белок, я воспользовалась сервисом PDB2PQR. А для протонирования лиганда я воспользовалась программой SPORES на кодомо.
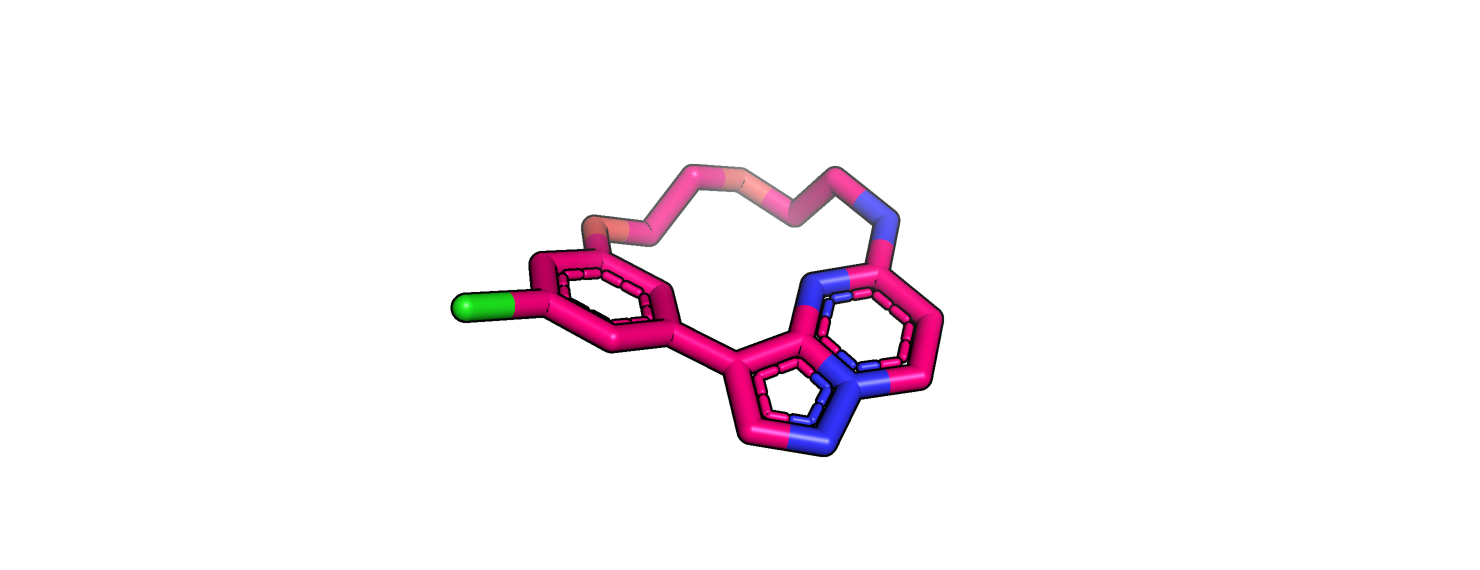
Рисунок 11.
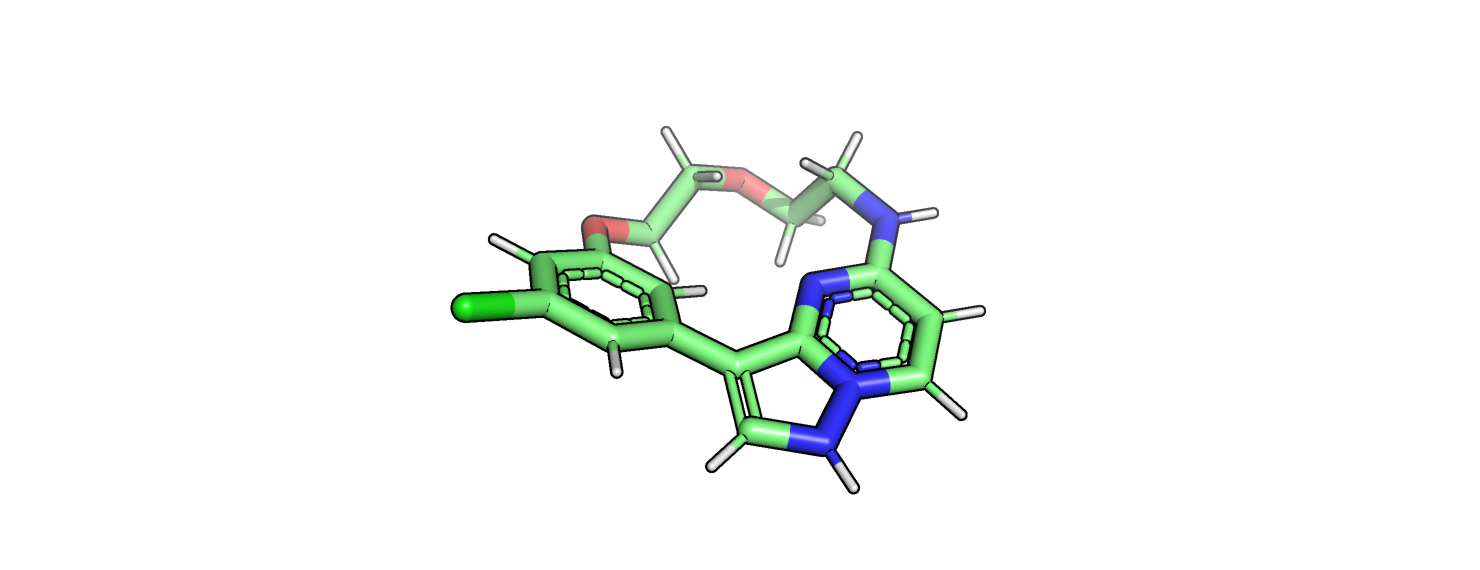
Рисунок 12.
На рисунках 11 и 12 изображен лиганд. На рисунке 11 он без водородов, а на рисунке 12 он уже с водородами, после процедуры протонирования. На мой взгляд протоны расставлены верно. Никакого диссонанса не возникает.
Задание 3. Докинг
После протонирования можно приступать уже непосредственно к докингу. Для докинга я использовала веб-версию Autodock Vina - Webina.
В результате докинга я получила 9 "поз" лиганда. Одна лучшая поза практически совпадает с положением лиганда в связанной форме, остальные позы очень сильно отличаются. Чтобы получить визуализацию взаимодействий полученной позы со свободной формой белка я воспользовалась сервисом PoseView. К сожалению, он не нашел никаких взаимодействий между свободной формой и лучшей позой. Однако я решила сама посмотреть на данный лиганд в структуре белка.
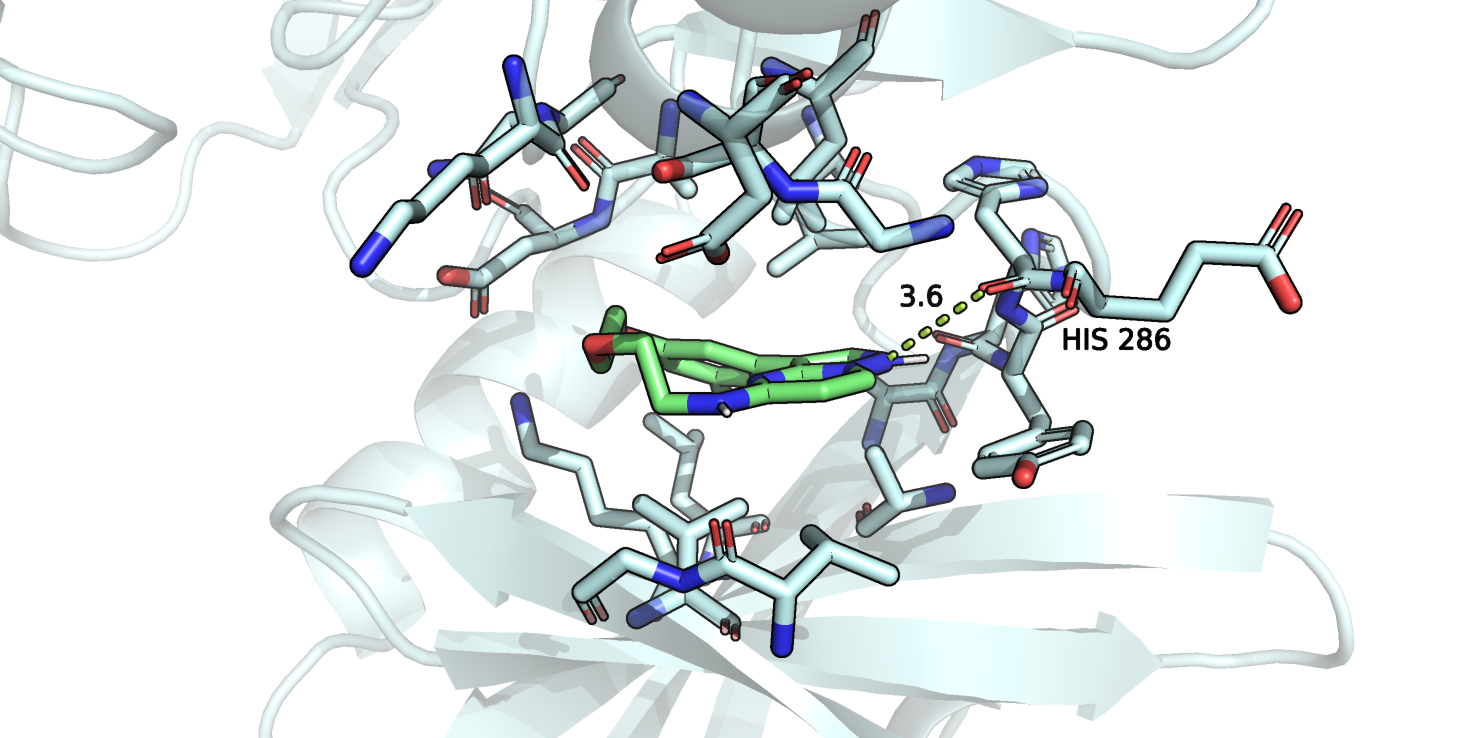
Рисунок 13.
На рисунке 13 я отобразила лучшую позу лиганда в свободной структуре белка. И я заметила ту же водородную связь, которую я находила в первом задании. Да, длина связи по верхней границе, но, возможно, она начинает формироваться уже на этом этапе, а потом атомы сближаются немного сильнее и связь создается окончательно.
.После провала с поиском связей с лучшей позой, я поискала связи с "истинным" положением лиганда тоже с помощью сервиса PoseView. Для данного варианта лиганда связи нашлись. Визуализация связей отображена на рисунке 14.
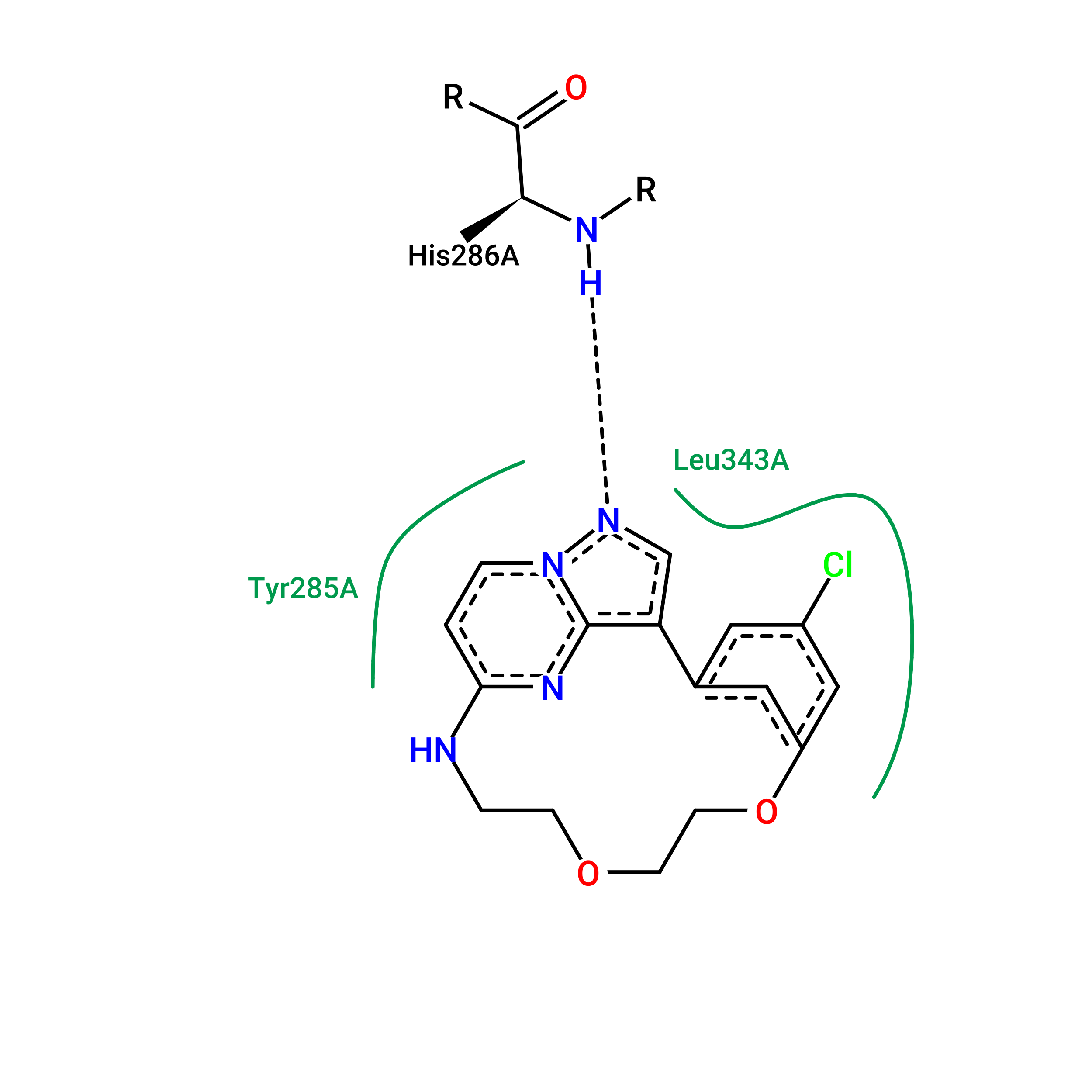
Рисунок 14.
На визуализации связей с "истинным" положением лиганда наблюдается та же водородная связь, что и в других положениях белка и лиганда. Поскольку это единственная, которую я нашла, размышления на тему первоначальных "якорей" считаю бессмысленным. Для моей пары очень маловероятен эффект индуцированного соответствия, так как еще с самого начала было заметно, что даже остатки внутри кармана почти или вообще не изменяют свои положения при связывании с лигандом. Белок почти не подстраивается под лиганд, а лиганд, судя по всему, почти не подстраивается под белок.
.