Взаимодействия. Субстратная специфичность
Задание 1. PoseView
В данном задании мы сгенерировали для протеазы из первого практикума (PDB: 5rew) 2Д диаграмму взаимодействий с помощью Poseview на сайте Proteins.Plus (Рис. 1). В первом практикуме я нашла следующие взаимодействия (Рис. 2).
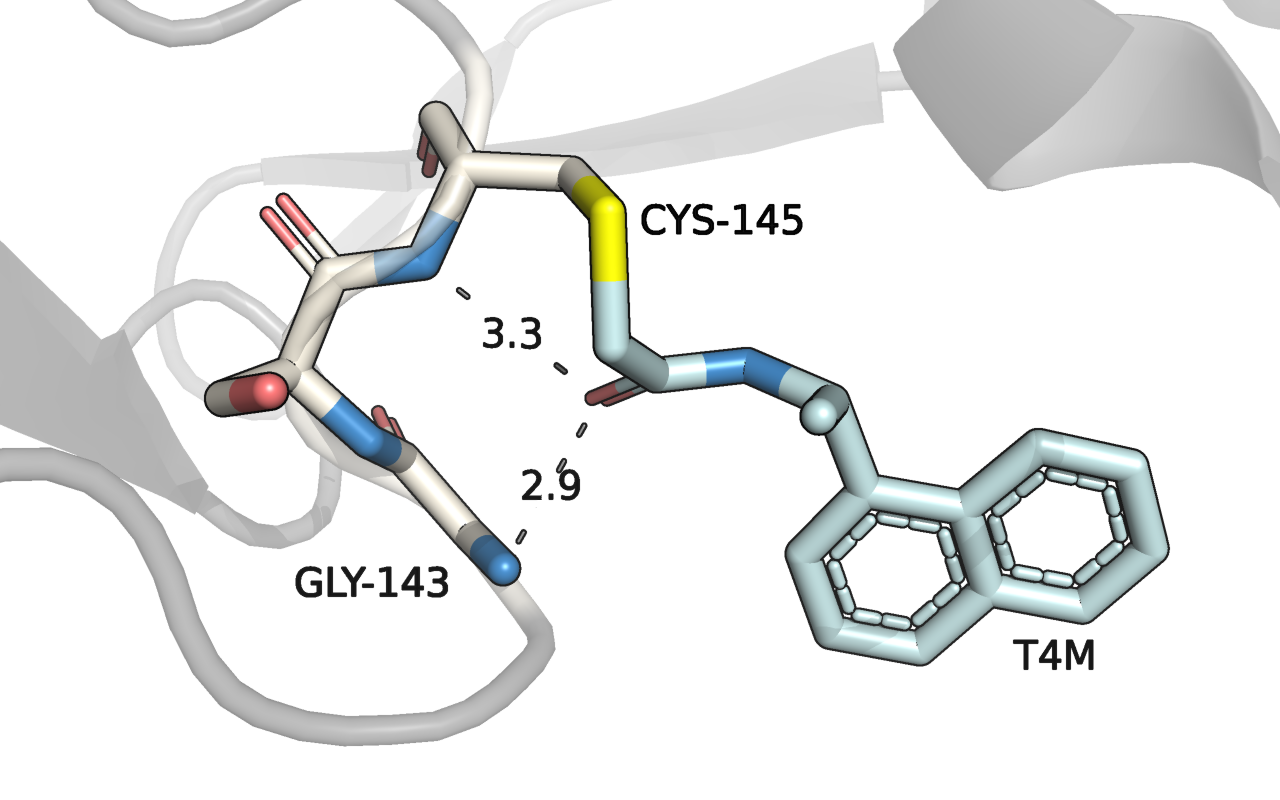
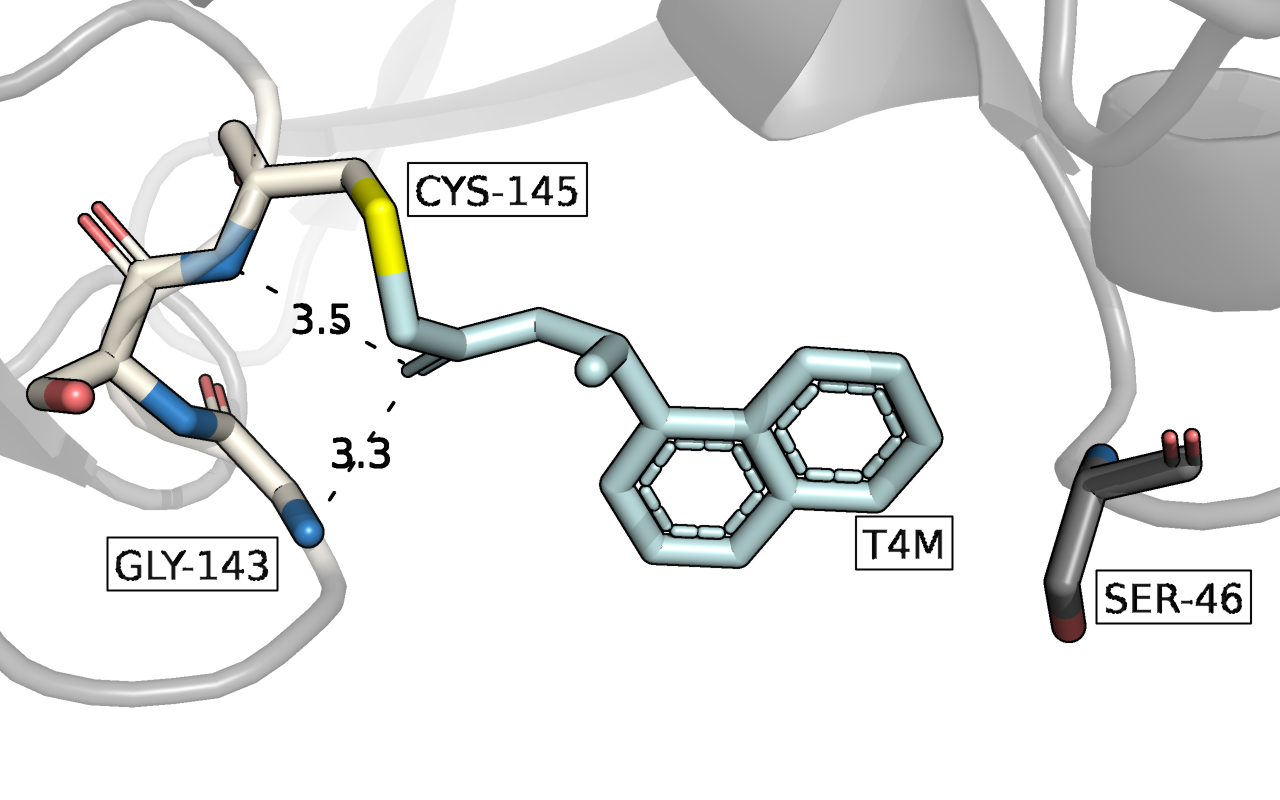
Совпало только одно взаимодействие, которое мы нашли - водородная связь с Gly-143. Программа не нашла взаимодействие с остовным атомом водорода у азота Cys-135, которое я показала. Это возможно связано с довольно большим расстоянием и неоптимальным углом. Сейчас я считаю, что это очень сомнительная водородная связь, которая вряд ли могла бы существовать одновременно с водородной связью с Gly-143, поэтому не показывала бы её. Программа показала гидрофобные взаимодействия с Ser-46 (Рис. 3), но, на мой взгляд, этот серин всё-таки экспонирован в раствор, поэтому здесь не стоит говорить ни о каких гидрофобных взаимодействиях. Возможно, программа показывает гидрофобные аминокислоты, расположенные на определённом расстоянии от лиганда, как взаимодействующие, поэтому мы получили такой результат.
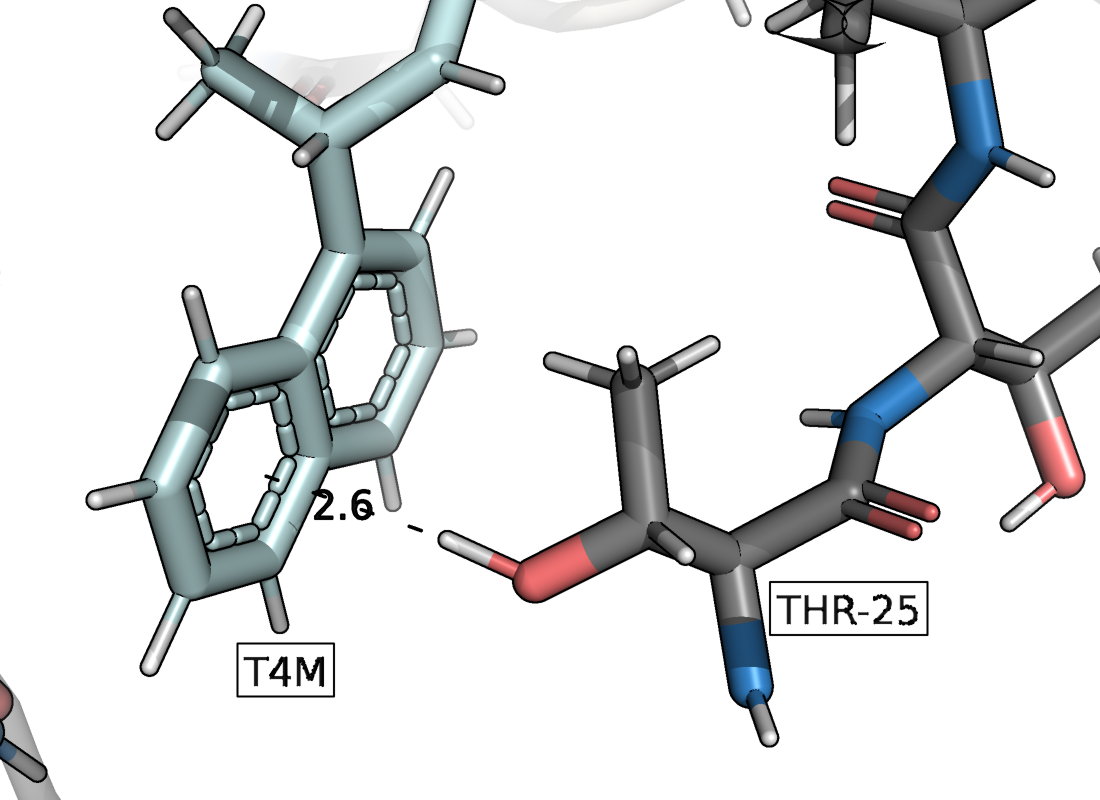
Сейчас у меня расширилось понимание природы водородной связи, главное, я лучше поняла, как её искать, какая геометрия оптимальна, как не может располагаться связь. Я бы делала это задание так: нашла бы окружение лиганда на расстоянии 5 Å, а после смотрела бы, какие аминокислотные остатки могут вступать во взаимодействие. В лиганде есть два кольца, поэтому предположила бы наличие стекинга, но его нет. Зато по-видимому тут есть пи-водородная связь с Thr-25 (Рис. 4).
Ещё неплохо бы проверить литературные источники. Возможно, что про некоторые остатки уже есть что-то интересное в статьях.
Задание 2. PyMol mutagenesis
Перед нами комплекс антитела с пептидным антигеном. Одну позицию антигена заменили на глицин. Используя возможности инструментария Wizard > Mutate будем пытаться выяснить, каким был исходный остаток на этой позиции.
Эпизод первый: скрытый аминокислотый остаток
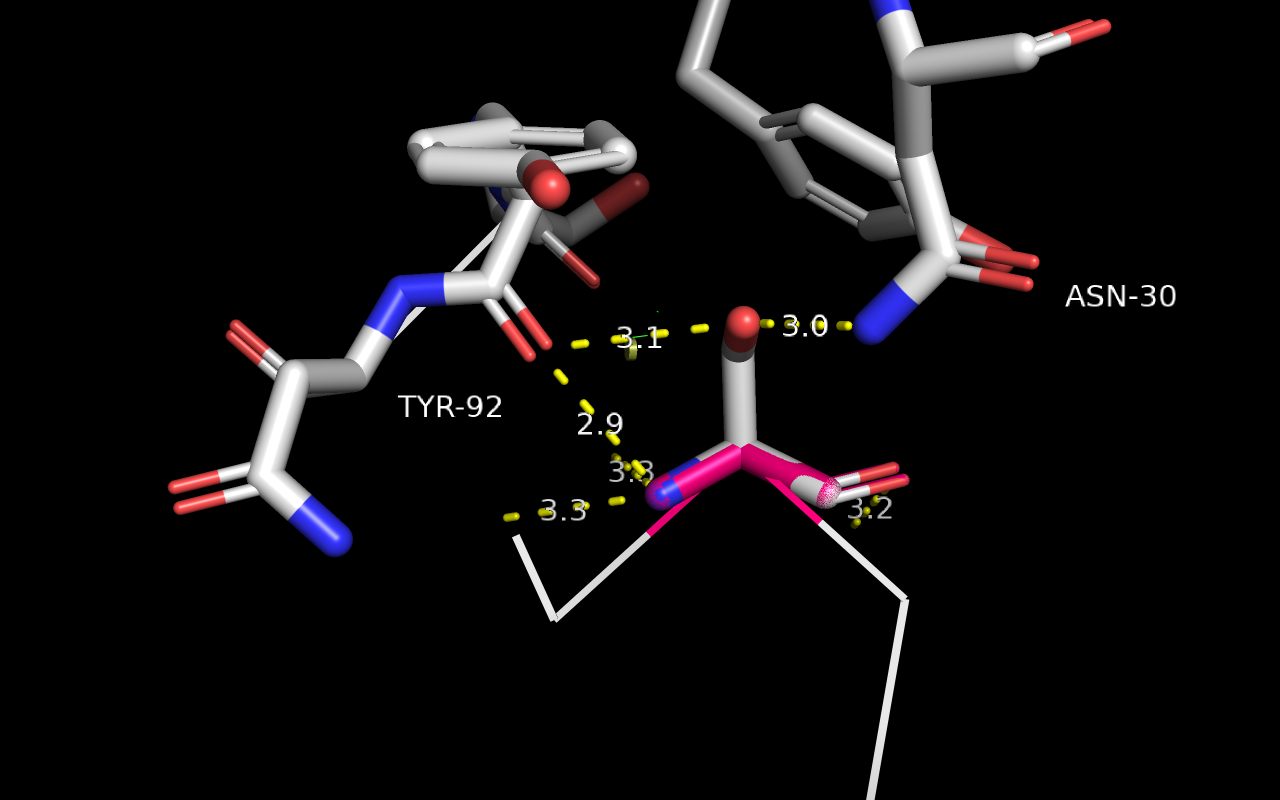
В данном задании рассматривался файл 0041, цепь I, остаток 603. Назовём его остаток "X". Далее рассмотрим окружение на расстоянии 5 Å. Мы видим небольшой карман (Рис. 5). Значит, что скорее всего тут лежит какой-то небольшой остаток, поэтому все большие ароматические остатки - Tyr, Phe, Trp исключаем из рассмотрения, а также исключаем His и Pro. Что есть в окружении остатка "X"? Три тирозина, триптофан - ароматические, гидрофобные, и аспарагин, серин, треонин - полярные. Предположу, что этот остаток "Х" полярный и небольшой (Ser, Thr). Дальше будем действовать методом исключения.
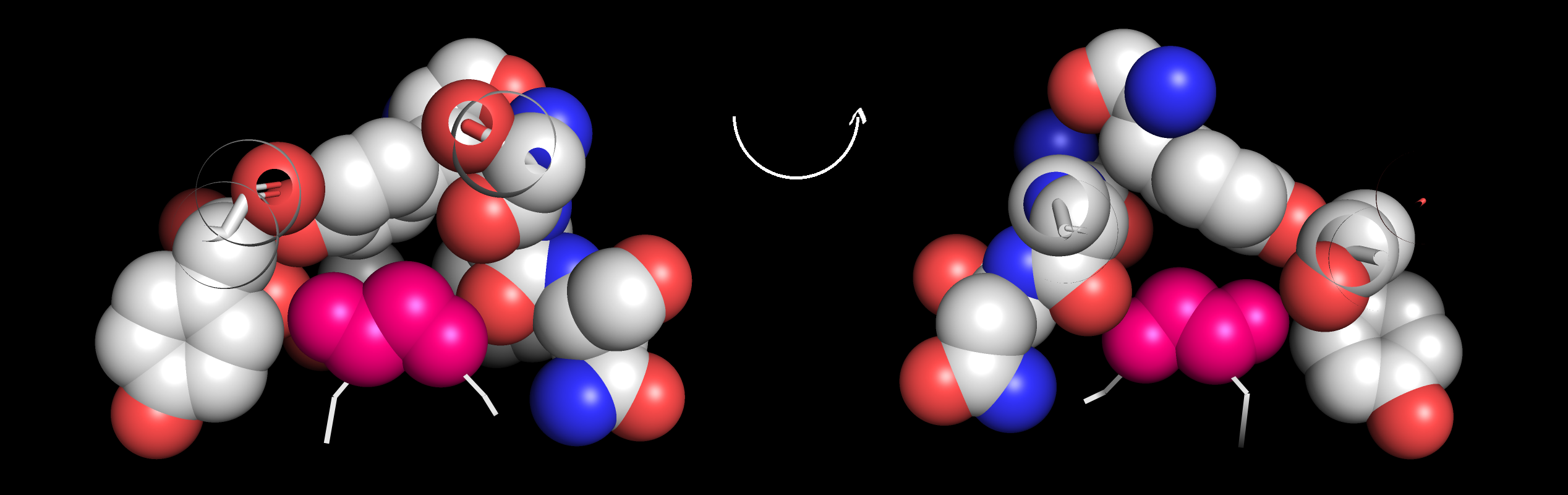
Продолжаем отбрасывать неподходящие аминокислотные остатки. Исключаем Met, Lys и Arg, потому что они длинные и скорее всего не впишутся в карман. При проверке разных ротамеров этих остатков так и вышло - не вписались, большой strain и сильные перекрывания. Показано на рис. 6 на примере аргинина.
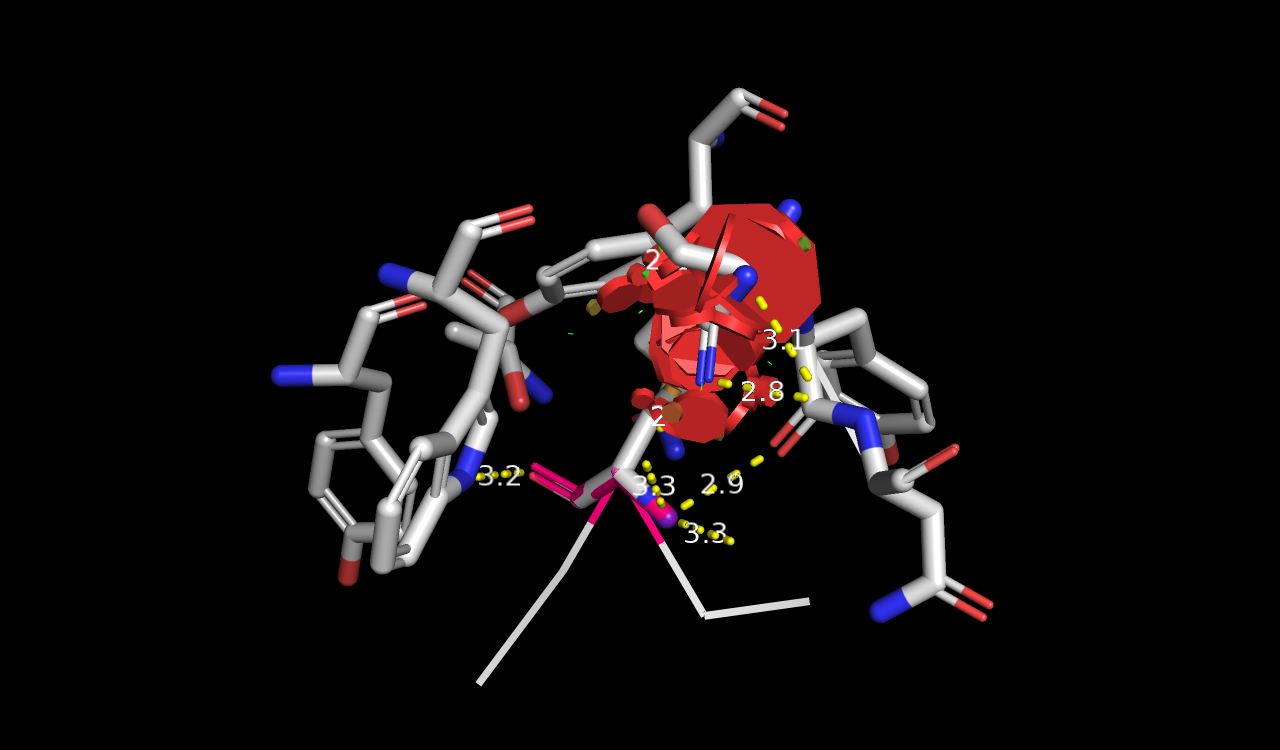
Окружение остатка довольно полярное, но есть гидрофобные аминокислоты. Я больше склоняюсь к тому, что тут какой-то полярный остаток, но на гидрофобные аминокислотные остатки мы всё же посмотрим. У нас остались Ala, Val, Ile, Leu. Помним, что "гидрофобность" - довольно условная штука, например, лизин может быть гидрофобным, потому что в составе бокового радикала имеет небольшую углеродную цепочку. Для вышеперечисленных остатков получили большой strain. Также считаю, что есть вариант получше, поэтому эти остатки не подходят.
Glu и Gln оказались слишком большими и тоже не подошли, большой strain. Остались Asp, Asn, Ser, Thr, Cys. Asp - отрицательно заряженная. Не думаю, что ей будет хорошо в столь гидрофобном окружении. Давайте посмотрим на остальные остатки (Табл. 1). В таблице приведены наиболее оптимальные по мнению автора ротамеры.
| Аминокислотный остаток | Strain | % встречаемости ротамера |
| Asn | 27.54 | 11.6 |
| Ser | 20.13 | 83.1 |
| Thr | 41.15 | 93.7 |
| Cys | 21.12 | 35.0 |
Наиболее оптимальными по взаимодейсвиям являются остатки Thr и Ser. Cys может быть только донором водородной связи, а сера - плохой акцептор. Исключаем Cys. Asn тоже исключаем, потому что нет оптимальных взаимодейсвий.
Остаются Ser и Thr. По взаимодействиям они почти идентичны. Единственное отличие - наличие дополнительной CH3- группы у треонина, что делает его больше. Оба остатка довольно часто встречаются, но у Thr есть перекрывание с остовным кислородом, поэтому считаю, что в данной позиции был мутирован Ser.
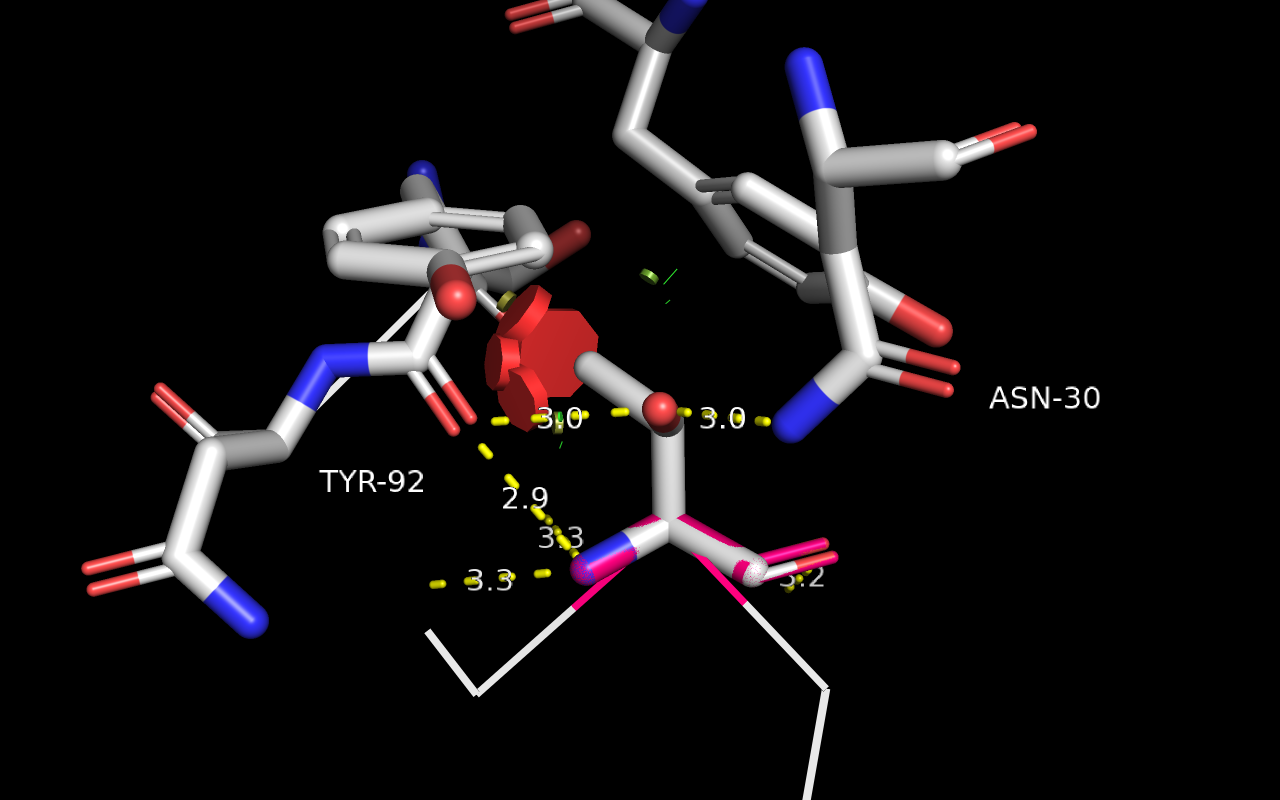
Таким образом, в данной структуре серин был заменён на глицин.
Эпизод второй: скрытый аминокислотый остаток
В данном задании рассматривался файл 0052, цепь P, остаток 6. Опыт угадывания остатка в предыдущей структуре показал, что можно не просматривать все остатки в поисках оптимального, а можно сразу посмотреть на окружение (Рис. 10) и, исходя из предположений, попытаться определить замену.
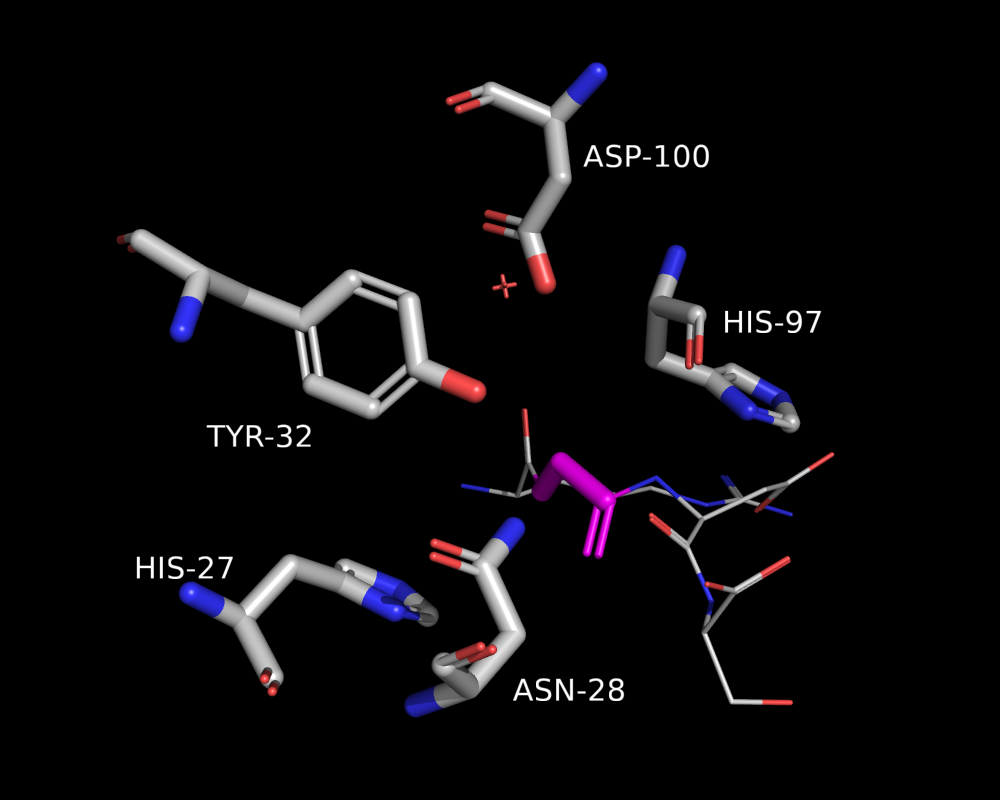
Здесь мы видим несколько гистидинов, аспарагиновую кислоту и тирозин, поэтому все гидрофобные исключаем из рассмотрения. На мой взгляд тут должно быть что-то заряженное. Наш мутированный остаток смотрит наверх, а там аспарагиновая кислота, тирозин и молекула воды. Предположу, что тут какой-то положительно заряженный остаток. У нас есть три варианта - аргинин, лизин и гистидин.
При рассмотрении ротамеров аргинина вышло так, что нам подошёл только один. Остальные сильно перекрывались с другими остатками. Этот ротамер имеет strain 17.49 и встречается с частотой 1.2% и к тому же не взаимодействовал никак с тирозином и аспарагином, с которыми я предполагаю взаимодействие (Рис. 11).
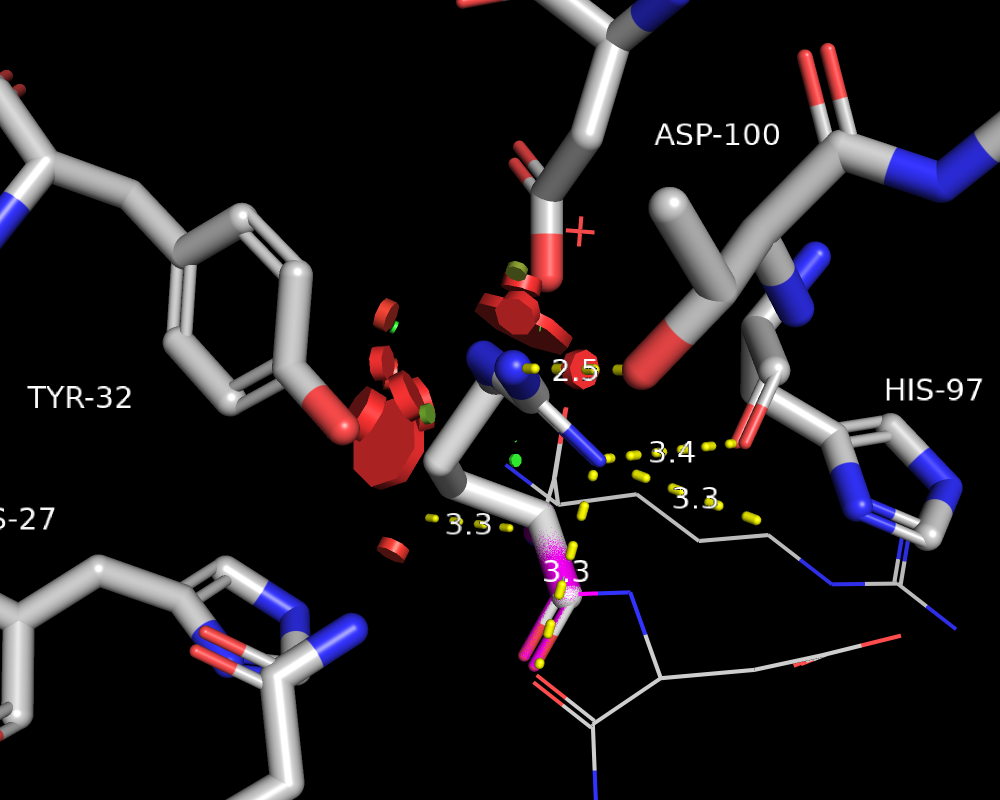
С лизином аналогичная ситуация (Рис. 12). Его strain 26.49, частота встречаемости 7,9%.
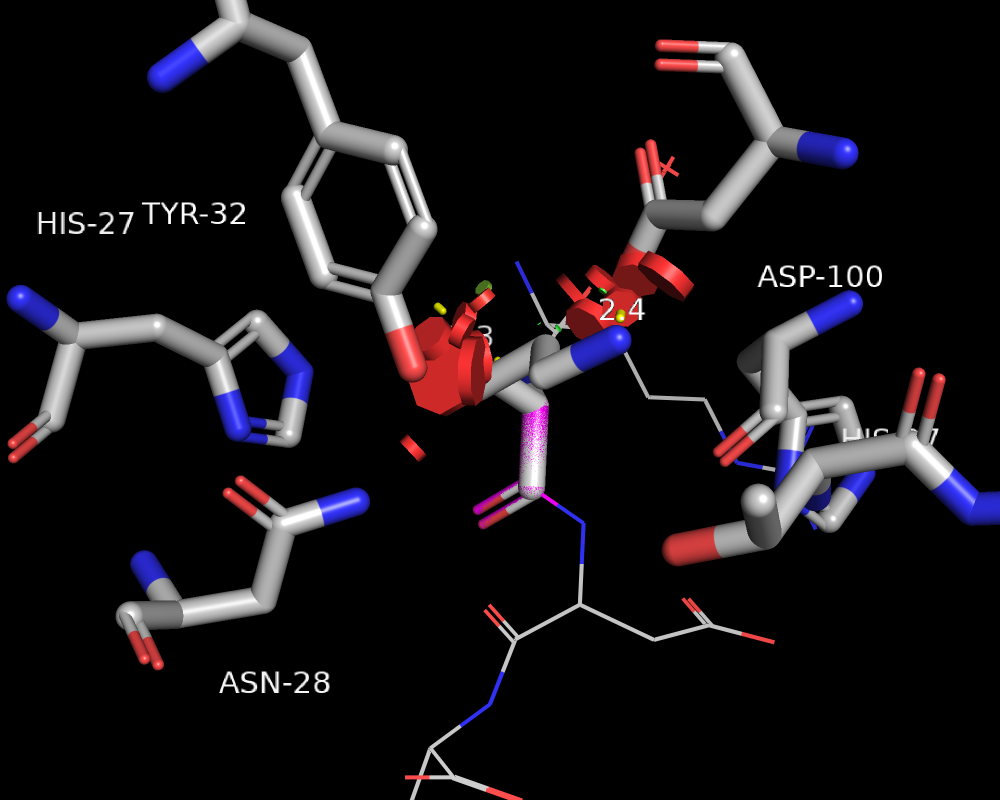
А вот этот ротамер гистидина очень даже хорошо подходит (Рис. 13). Тут есть взаимодействие положительно заряженного кольца с аспартатом, стекинг с тирозином и возможно одна водородная связь с глицином. Здесь довольно маленький strain, а ещё маленькая частота встречаемости, что заставляет нас усомниться в том, гистидин здесь или что-то другое.
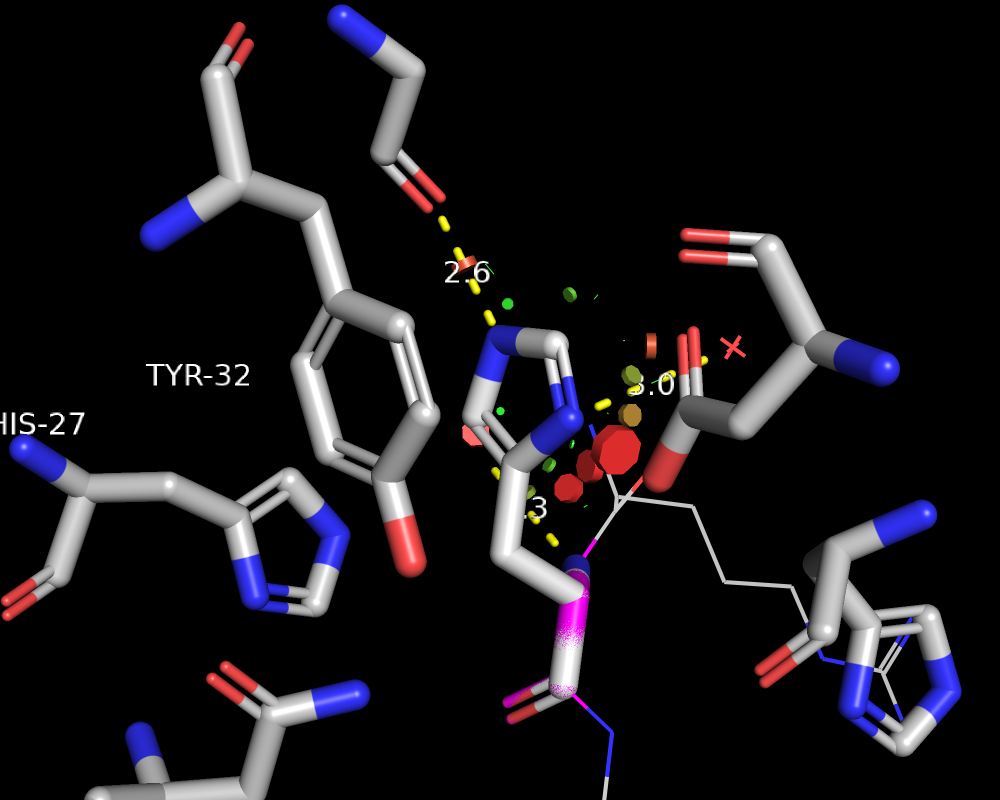
Если это гистидин, то отдельным вопросом является, в какой протонированной форме этот остаток. Предположу, что один из азотов точно протонирован, что позволяет взаимодействовать с Gly-91 посредством водородной связи. Второй скорее всего тоже протонирован, что создаёт положительный заряд и делает возможным электростатические взаимодействия с Asp-100. Заметим, что His и Asp лежат в одной плоскости, что делает такое взаимодействие наиболее оптимальным. Большой вопрос, образует ли в данном случае гистидин водородную связь с водой - я бы сказала, что нет. Считаю, что эта геометрия неоптимальна.
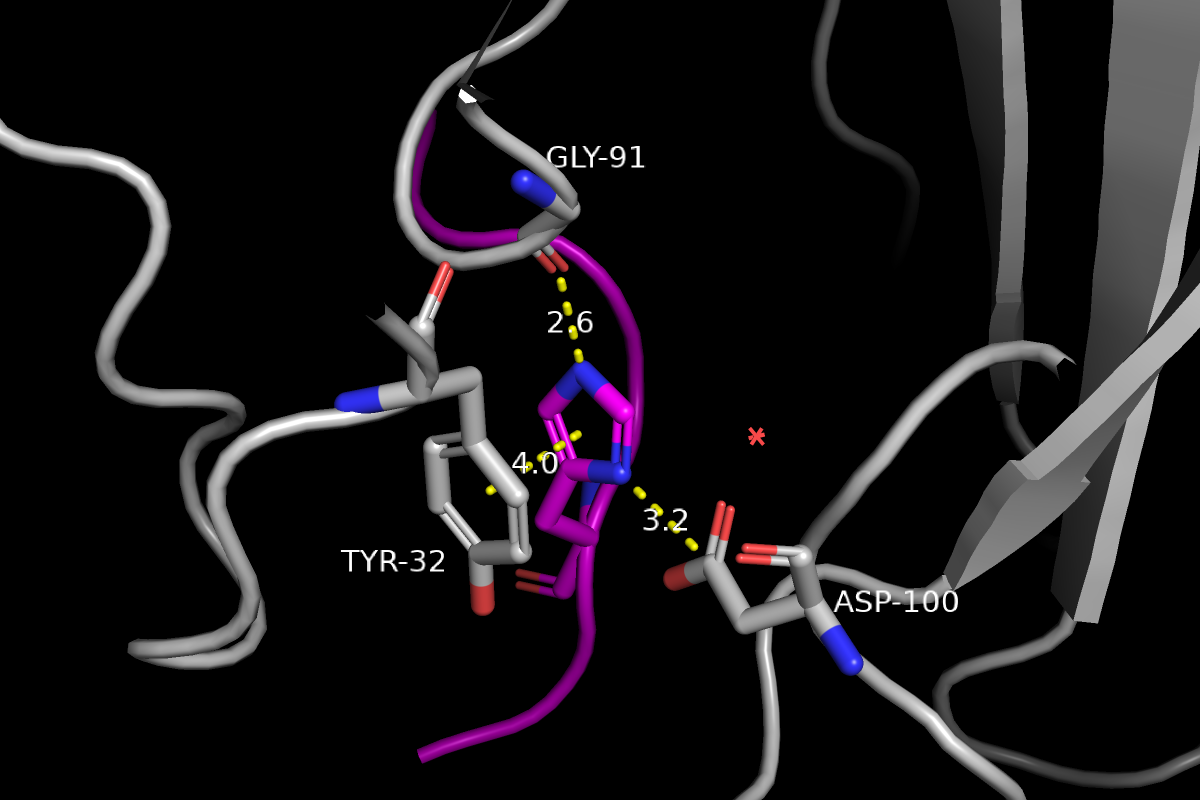
Возможно я промахнулась с аминокислотой, потому что не стала рассматривать другие, но считаю, что в данном случае наиболее вероятен гистидин.