Поверхности, карманы, pKa
Задание 1. SASA, MSA
В данном задании рассматривали белок MurA в разных конформациях открытой и закрытой. Согласно статье «открытой» считается конформация без лиганда, а после связывания субстратов белок образует гораздо более плотно упакованную «закрытую» форму.
Структура с PDB: 1EJD состоит из двух идентичных цепей. Для работы выбрана цепь А. Структура с PDB: 3SU9 состоит из одной цепи в комплексе с лигандом. Явно различается положение петли (Рис. 1). Остальные части более-менее неплохо соответвовали друг другу.
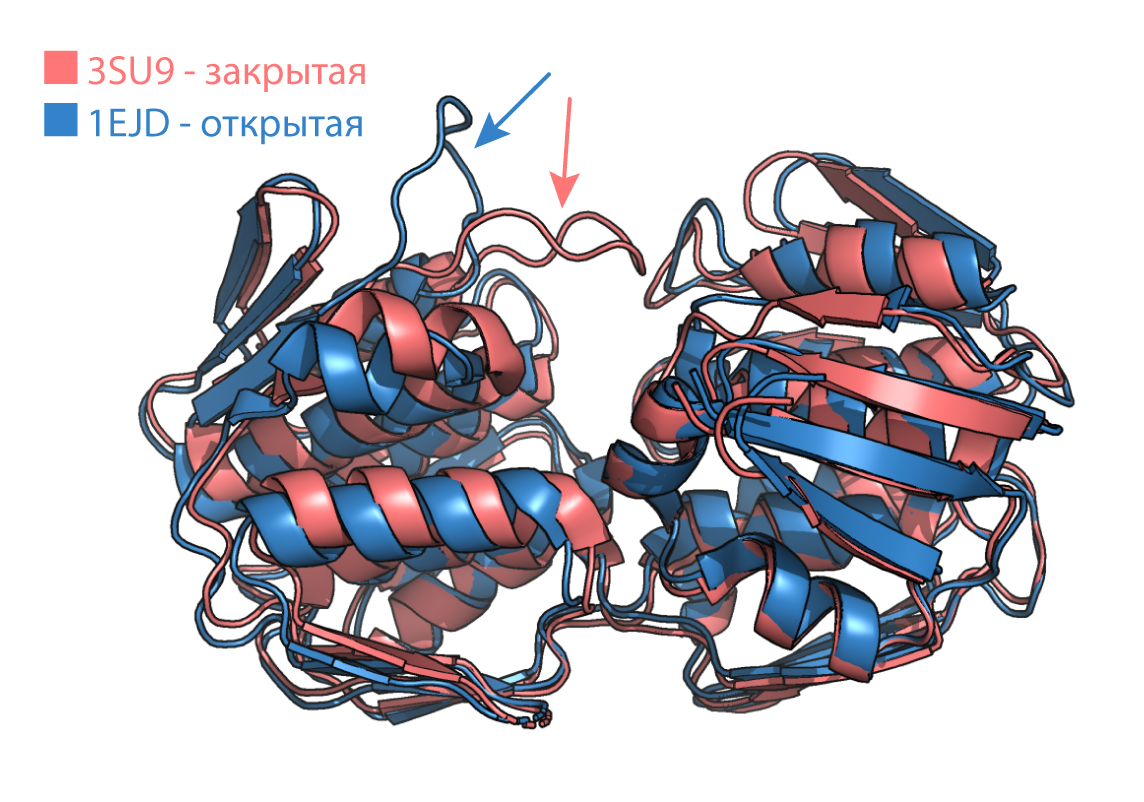
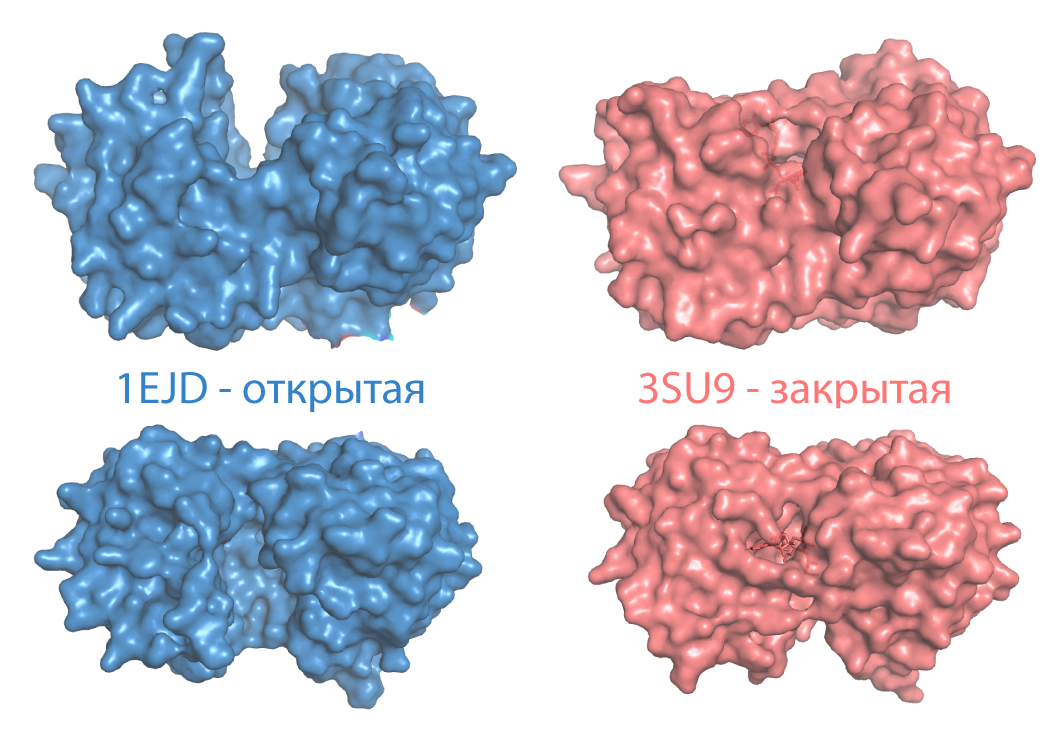
Далее для разных конформаций мы вычислили SASA - площадь поверхности, доступной растворителю и MSA - площадь молекулярной поверхности (Табл.1). Площадь поверхности открытой конформации в обоих случаях оказалась больше, чем в закрытой. Это можно объяснить тем, что в закрытой конформации белок более плотно упакован, что уменьшает площадь поверхности.
MSA > SASA, что связано с особенностями вычисления. В случае с SASA используется множество наиболее близких к атомам белка точек, в которых может находиться центр молекулы растворителя. Это "раздувает" молекулу, поэтому в таком случае некоторые "углубления", которые могли бы внести вклад в площадь поверхности "схлопываются" и не учитываются. MSA же состоит из поверхности контакта и дополнительной поверхности, что позволяет учитывать эти "углубления" и делает MSA больше, чем SASA.
| PDB | 3SU9 | 1EJD |
| Конформация | Закрытая | Открытая |
| SASA - площадь поверхности, доступной растворителю, Å2 | 30606 | 38000 |
| MSA - площадь молекулярной поверхности, Å2 | 52551 | 56408 |
SAS можно использовать, чтобы смотреть, какие аминокислотные остатки доступны для воды, а для изучения shape complementarity больше подойдёт MS. Surface в PyMOL'е показывает MS. Она же поверхность Конноли.
Задание 2. Карманы, объем
Визуально определить основной карман связывания не составило труда - помог лиганд, имеющийся в структуре с закрытой конформацией. Именно наличие этого лиганда и привело к тому, что структура стала закрытой.
При помощи сервиса fpocket мы предсказали положение и параметры карманов на поверхности молекул. Для закрытой конформации белка карман из выдачи неплохо соответвовал визуально определяемому (Рис. 3), а вот для открытой конформации такого хорошего кармана не нашлось. Было несколько более-менее подходящих, но, как мне кажется, карман должен выглядеть не так, как нарисовала программа (Рис. 4).
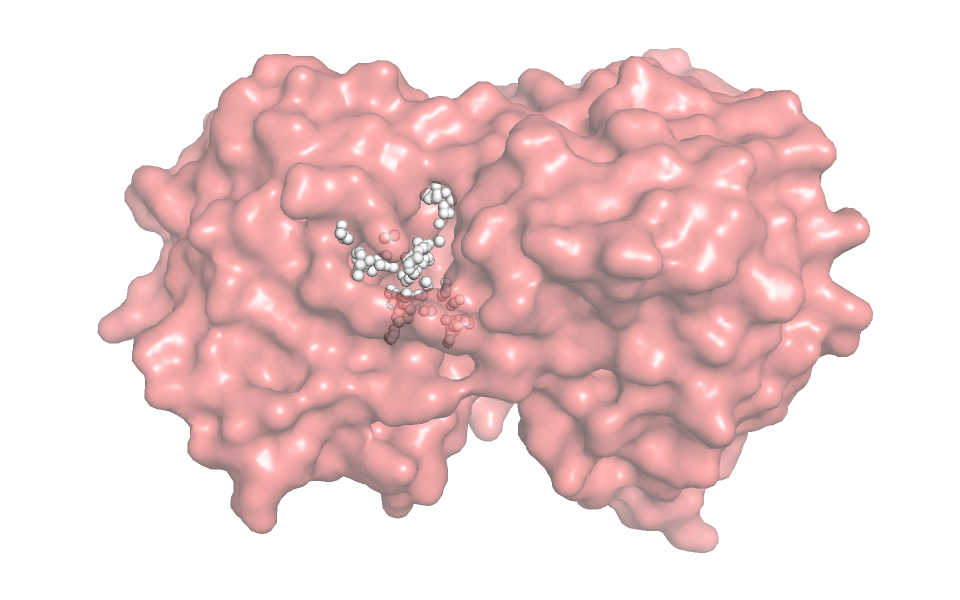
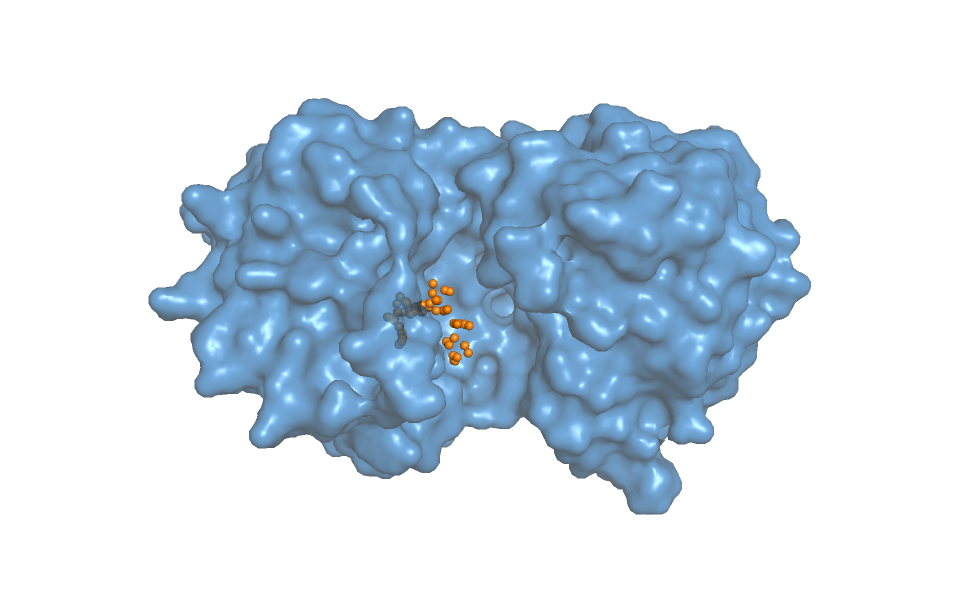
Объём кармана для закрытой конформации составил 2999.3823 Å3, а для открытой 1478.4198 Å3. Меньше почти в 2 раза. Это слишком большое различие в объёме скорее всего связано с тем, что для открытой конформации программа выбрала карман меньше, чем он есть на самом деле, т.е. программа нашла неправильный карман. Поэтому не думаем, что можно рассуждать над значением для процесса связывания лиганда/процессирования субстрата.
Вообще контринтуитивно, что объём открытой конформации меньше, чем объём закрытой. Мы предполагаем, что у открытой размер кармана будет больше, чтобы увеличить шансы связывания субстрата, а у закрытой объём будет меньше, потому что произойдёт компактизация в связи с изменением конформации.
Задание 3. Экспонированность
В исходной статье по DSSP acc задавался как SASA/10, но в версии на кодомо вместо этого числа выводится просто SAS, поэтому мы пересчитали результат выдачи кодомо. Везде представлена абсолютная экспонированность = SASA/10.
В данном задании для той же PDB пары с помощью программы mkdssp (CLI) на кодомо мы получили сопоставление "номер остатка - экспонированность" в обеих формах. Больше всего изменил свою экспонированность при "закрытии" белка остаток Ile-117, который как раз расположен в петле, сильнее всего изменившей конформацию. Причём такой результат получен и для относительной, и для абсолютной экспонированности. В открытой конформации Ile-117 экспонирован в раствор (Рис. 5), поэтому его ACC составляет 15.5 (Относительная ACC = 0.787). А в закрытой Ile-117 ACC = 0.4 (Относительная ACC = 0.020).
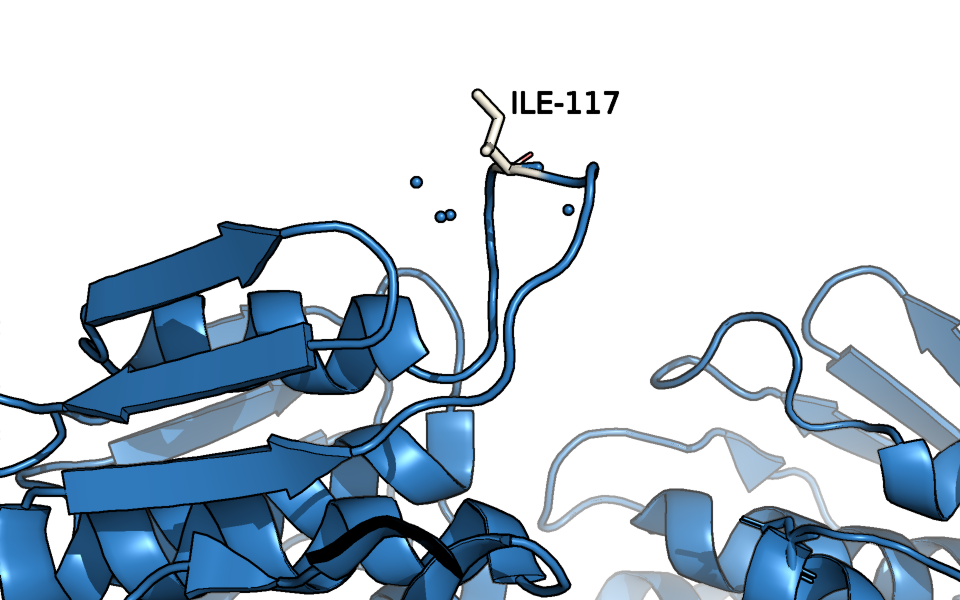
Изолейцин считается гидрофобным остатком, поэтому странно, что он "смотрит" в раствор. Так почему же так происходит? Давайте посмотрим на окружение этого остатка в закрытой конформации (Рис. 6).
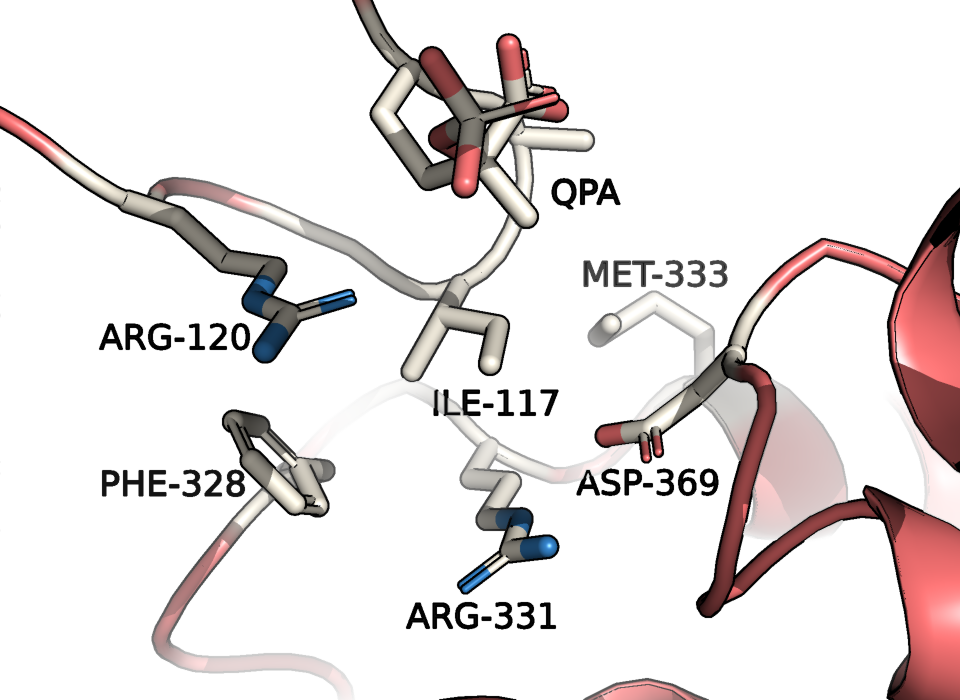
Мы видим гидрофобный Phe-328, Met-333, взаимодействующие Arg-331 и Asp-369, QPA - модифицированный цистеин 115, имитирующий субстрат белка - PEP и Arg-120. Так мы находимся в активном центре! Теперь понятно, почему Ile-117 так сильно меняет экспонированность. Хотя нет данных, свидетельствующих об участии этого остатка непосредственно в механизме реакции, возможно, Ile-117 помогает принимать правильную конформацию для осуществления реакции. Другой остаток, принимающий участие в реакции - Arg-120. Он стабилизирует интермедиат. С механизмом можно ознакомиться здесь.
Относительная и абсолютная экспонированность
DSSP вычисляет экспонированность как SASA(остатка)/10. В лекции звучало другое определение: SASA(остатка)/ SASA(остатка в Gly-X-Gly). SASA остатка в трипептиде Gly-X-Gly называют максимально возможной SASA для конкретного остатка. Этот показатель можно считать своего рода "нормировкой". Из литературы были получены референсные значения и произведён пересчёт. Часть данных представлена в таблице 2.
Кажется логичным при использовании абсолютной экспонированности для сравнения вычислять отношение, но тут могут возникнуть проблемы, т.к. экспонированность может равняться нулю. Непонятно, как действовать в такой ситуации, потому что делить на ноль нельзя. Поэтому, чтобы не заморачиваться с нулём лучше вычислять разность. Хотя можно использовать псевдокаунты, но это только усложнит вычисления.
При использовании относительной экспонированности точно не нужно вычислять отношение, потому что эта операция не имеет смысла - сокращение даст отношение абсолютной экспонированности. Поэтому здесь лучше использовать разность. Причём эта стратегия кажется оптимальной, потому что SASA здесь будет "отнормирована", поэтому экспонированность разных остатков вполне можно будет сравнивать друг с другом.
| Остаток | Абс. для открытой конформации | Отн. для открытой конформации | Абс. для закрытой конформации | Отн. для закрытой конформации | Разность абс. | Разность отн. | Отношение (откр/закр) |
| Ile-117 | 15.5 | 0.787 | 0.4 | 0.20 | 15.1 | 0.767 | 38.75 |
| Arg-91 | 15.4 | 0.562 | 2.1 | 0.076 | 13.3 | 0.485 | 7.33 |
| Met-333 | 12.1 | 0.540 | 4.3 | 0.192 | 7.8 | 0.348 | 2.81 |
Если мы хотим прикинуть, какой остаток, который больше всего изменил экспонированность, то достаточно будет взять разность абсолютных экспонированностей и не утруждать себя вычислениями. Мы получили, что Ile-117 больше всего изменил экспонированность, и когда смотрели разность, и когда отношение. Главный вывод - подбирать порядок действий (брать относительную или абсолютною экспонированность, отношение или разность) нужно под каждую конкретную задачу.