Разметка вторичной структуры
Задание 1. Знакомство с укладками
В данном задании нам было дано 10 записей PDB с попарным сходством последовательностей не более 40%. Они были выровнены относительно 3l8hA00 (Рис. 1), пробовались разные варианты, но с этой структурой получилось лучше всего. Из выравнивания выбивается структура 3ef0A01 (оранжевый). В целом выравнивания получились не очень хорошими. Было сложно сделать адекватную картинку, поэтому представляю вашему вниманию гифки.
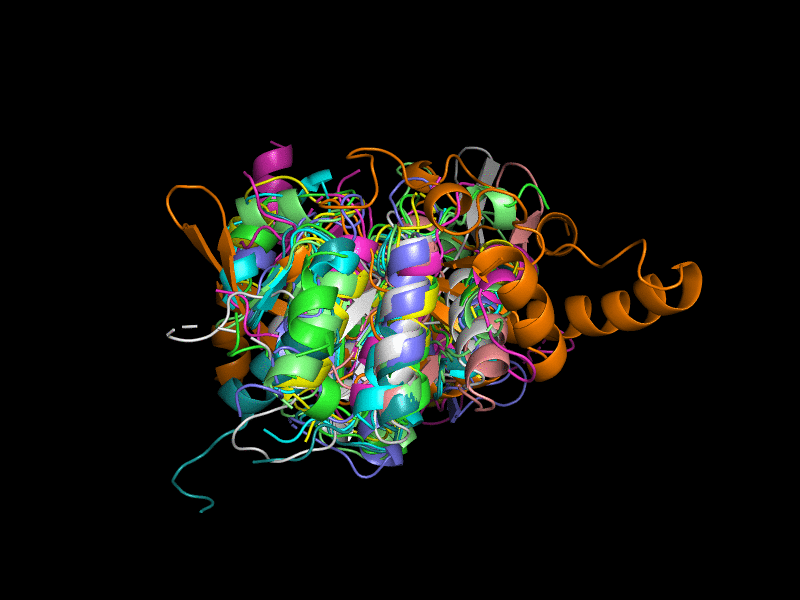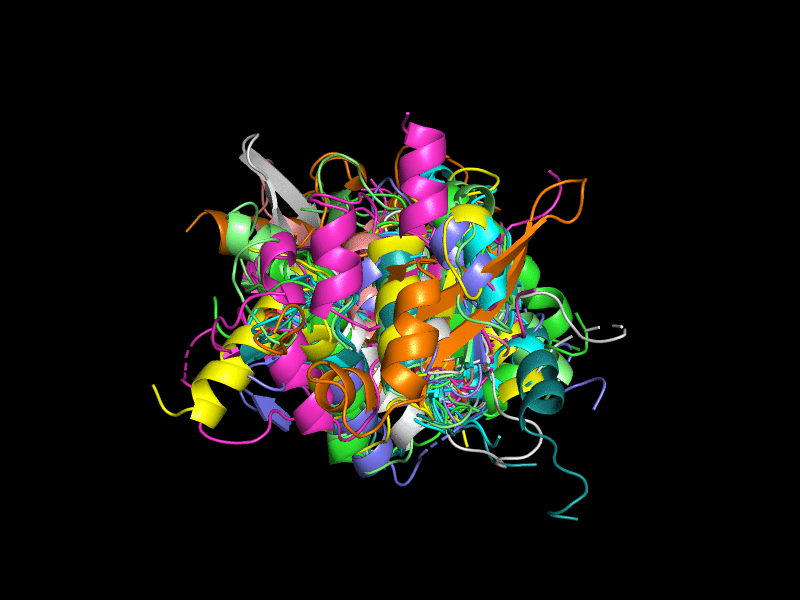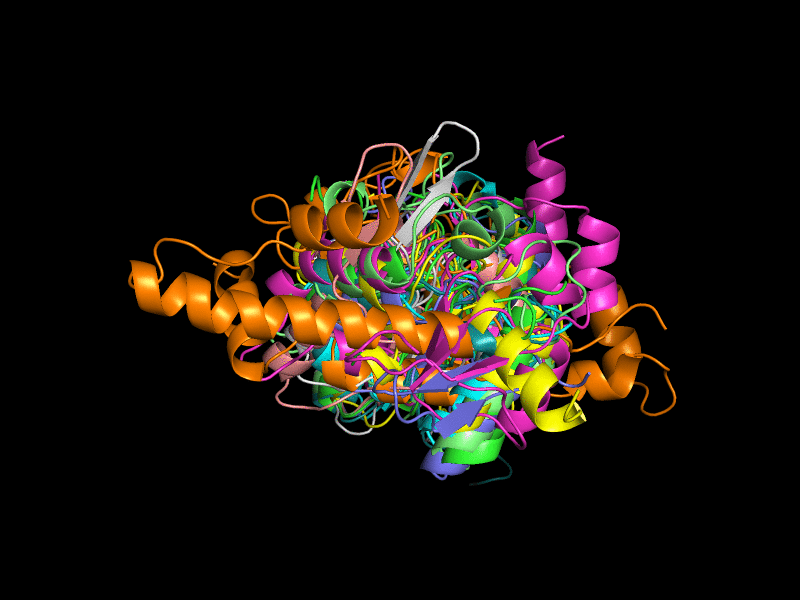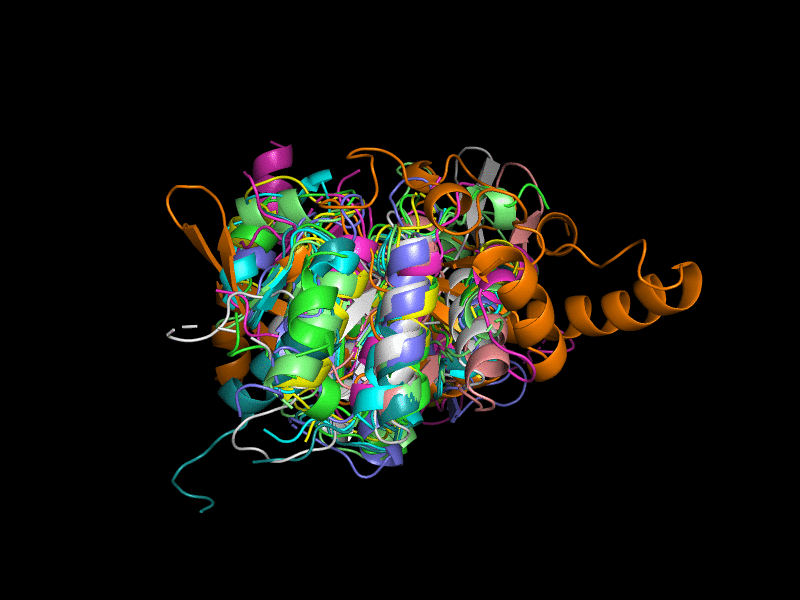
Было решено удалить из рассмотрения эту оранжевую структуру (Рис. 2). Теперь структуры больше похожи друг на друга, но всё равно не очень хорошо накладываются. В целом их третичная укладка довольно похожа - внутри большой бета-лист, окруженный альфа-спиралями.
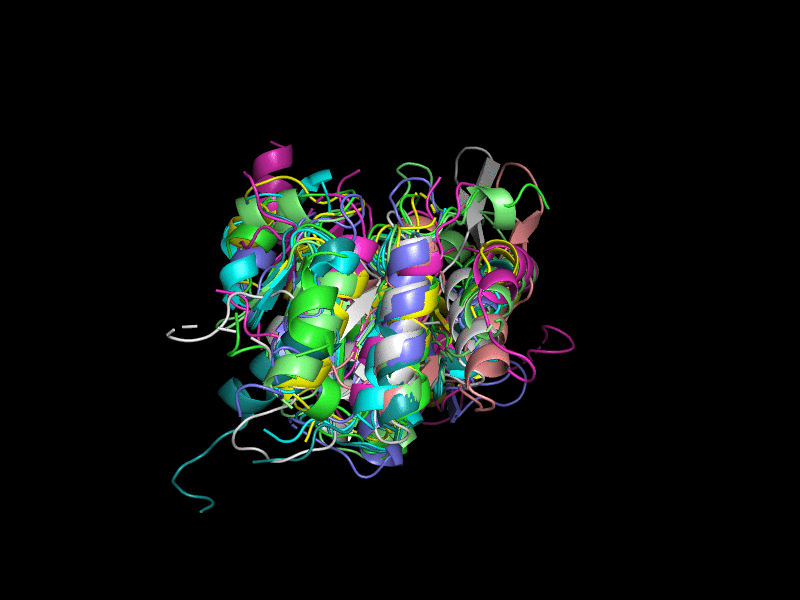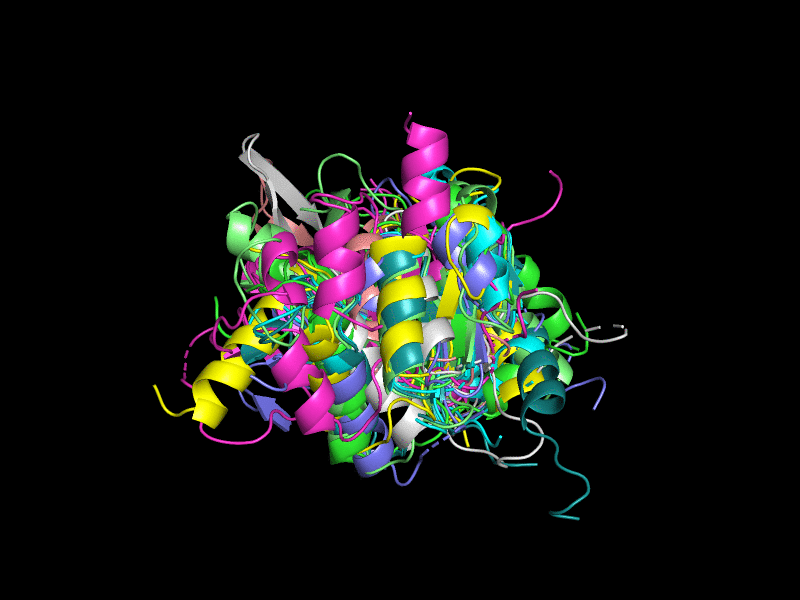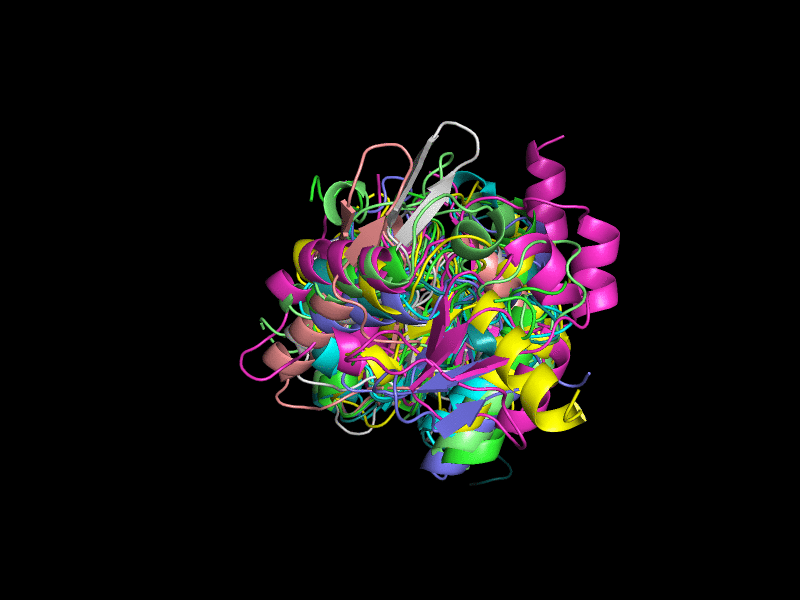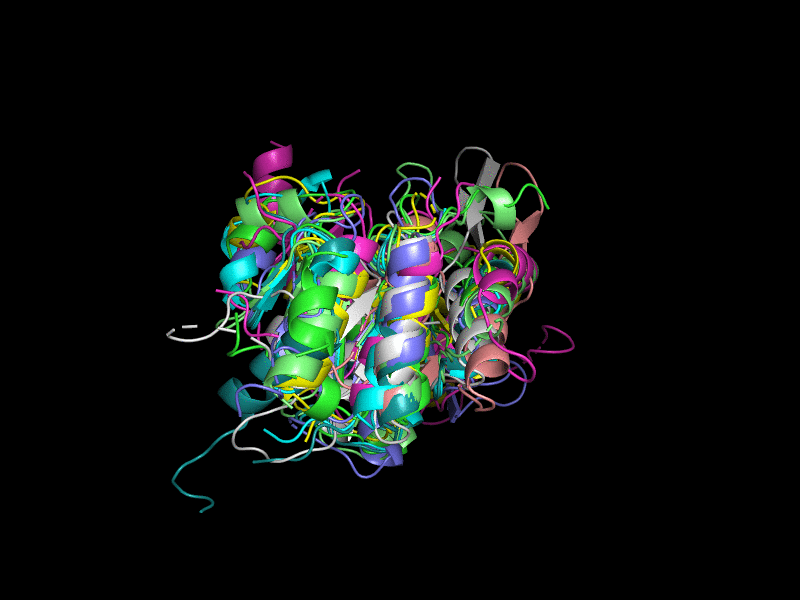
Исключения составляют 3l8hA00 (Рис. 3), состоящая из двух бета-листов, окруженных альфа-спиралями; 2oycA02 (Рис. 4) тоже состоит из двух бета-листов, окруженных альфа-спиралями.
Задание 2. Работа с разметкой вторичной структуры в ручном режиме
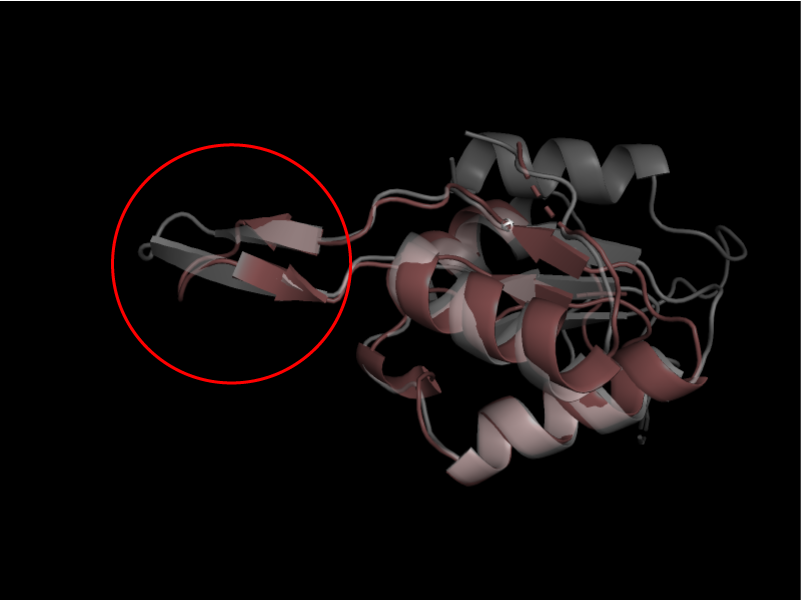
Рассмотрим 2ho4A02 (розовая) и 2oycA02 (белая). Красным показан отличающийся участок, который мы будем впоследствии детально изучать. У белой структуры бета-тяжи получились длинее, чем у розовой (Рис. 5).
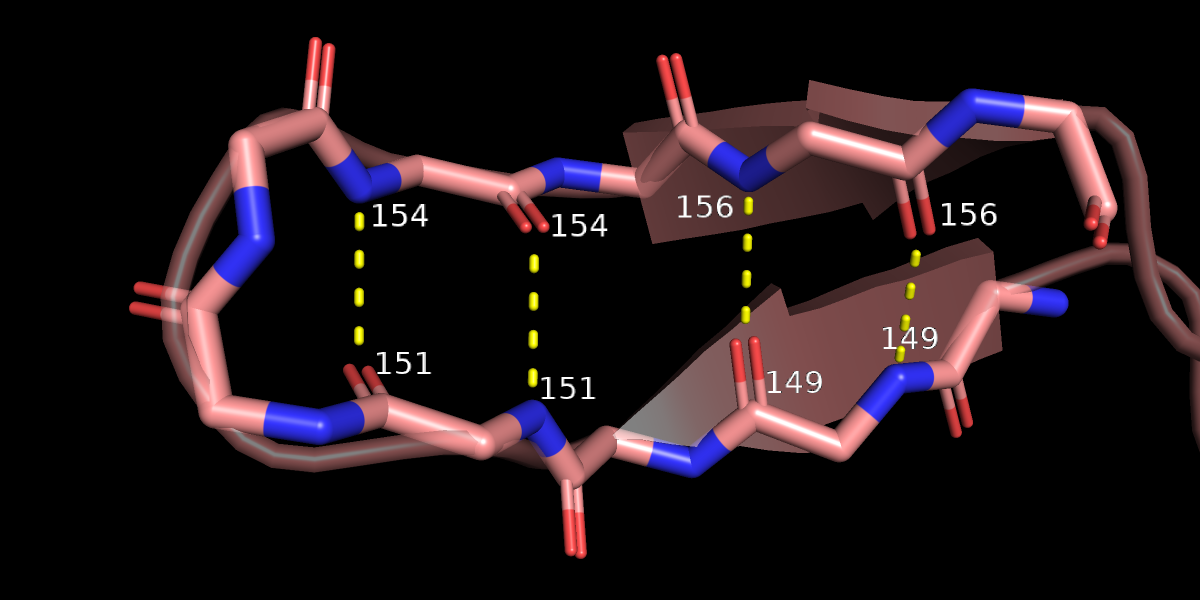
Отобразим в виде Sticks остов розового белка с 148 по 157 остаток (Рис. 6) и в белом белке 181-191 остатки (Рис.7), которые участвуют в образовании антипараллельного бета-листа. В розовой структуре мы видим два мостика одного типа, между ними остаток без связей. Мы помним, что минимальный антипараллельный бета-лист состоит из двух лестниц, которые как раз здесь есть, поэтому правильнее было бы здесь сделать бета-тяжи подлинее.
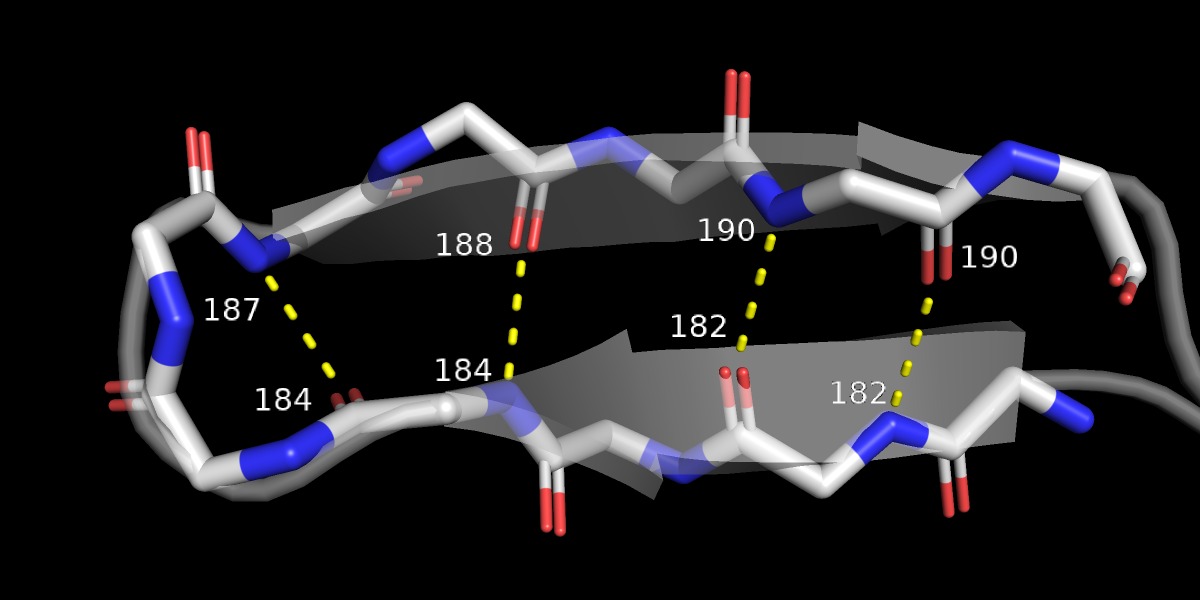
В белой структуре есть один мостик, характерный для антипараллельных бета-тяжей, между 182 и 190 остатками и что-то странное - одна связь 184 остатка со 187 и одна со 188. Это не похоже на обычный мостик, но тем не менее этот участок почему-то был размечен, как бета-тяж.
Также было интересно посмотреть на отличия в других структурах. Отобразим в виде Sticks остов 3dnpA01 (фиолетовый) белка с 46 по 157 остаток (Рис. 8) и в 1te2A01 (бирюзовый) белке 119-130 остатки (Рис.7). В фиолетовой структуре в данном месте альфа-спираль, а в бирюзовой этот участок показан в виде петли. Это связано с тем, что некоторые аминокислотные участки в этом месте не были расшифрованы, что печально. По ходу остова неплохо читается спираль. С другой стороны, странно, что другие остатки удалось расшифровать, а некоторые, находящиеся внутри предполагаемой спирали - нет. Я бы всё-таки разметила это место, как альфа-спираль, хотя и сильно бы рисковала.
Задание 3. Работа с разметкой вторичной структуры в автоматическом режиме
Для каждого из 10 pdb было сгенерирована разметка вторичной структуры с помощью dssp. Были расчитаны склонности каждого типа аминокислоты образовывать тот или иной тип вторичной структуры (amino acid secondary structure propensity):
P_ik = (n_ik/n_i) / (N_k/N)
В данной формуле P_ik это propensity аминокислотного остатка i образовывать тип вторичной структуры j
n_ik это количество остатков i в датасете, образующих тип вторичной структуры j
n_i это общее количество остатков i в датасете
N_k это общее количество остатков, образующих тип вторичной структуры j во всем датасете
N это общее количество остатков в датасете
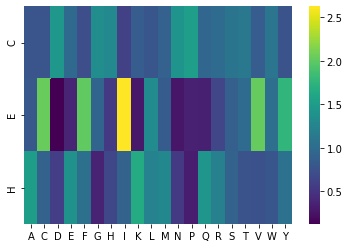
Мы использовали упрощенную классификацию, где всё, что не является бета-листом ('E') или альфа-спиралью ('H'), оценивали как петлю ('C'). С рассчитанными значениями можно ознакомиться в таблице или посмотреть на тепловую карту (Рис. 10). Склонность аминокислотного остатка i образовывать вторичную структуру j является не зависит от того, в каком белке он находится, поэтому в данном задании мы имитируем на более маленькой выборке такой расчёт, который обычно осуществляют по всей базе PDB. Поэтому следует понимать, что наша выборка несколько смещена, поскольку мы берём структуры с попарным сходством последовательности не более 40%.
В данном случае нам не понадобились псевдокаунты, поскольку отсутствовали нулевые значения, поэтому делить на ноль не приходилось.
Три примера
Оказалось, что пролин чаще всего склонен к образованию петель, что объясняется его конформационно жёсткой структурой, благодаря которой пролин способен сильно изгибать пептидную цепь. Также у атома азота пролина в составе белковой цепи нет водорода, поэтому пролин теряет способность быть донором водорода при формировании водородной связи в отличие от других аминокислот. По этой причине мы не сможем встретить пролин в середине альфа-спирали или бета-тяжа.
Чаще всего к образованию бета-листов склонен изолейцин, а также другие гидрофобные аминокислоты: фенилаланин, валин, тирозин и цистеин. Это можно объяснить тем, что бета-листы образуют гидрофобное ядро белка.
Лизин был чаще склонен образовывать альфа-спирали. На N-конце спирали образуется частично положительный заряд. И, возможно, наличие положительно заряженных лизинов увеличивает этот положительный заряд на N-конце, что делает N-конец местом связывания анионных субстратов. Но тут нужно проводить дополнительные статистические тесты - проверять действительно ли лизинов больше на концах или их столько же, сколько и в середине альфа-спирали.