Структурные выравнивания. Структура/функция
Задание 1. Что это за белок?
В данном задании мы получили координаты какой-то неизвестной структуры (Рис. 1). Можем представить, что это выдача какой-то черной коробочки, генерирующей структуру по последовательности, а значит здесь нет никаких кофакторов и лигандов. Наша задача состоит в том, чтобы предположить, что это за белок, какие функции выполняет, есть ли кофакторы в составе и т.д.
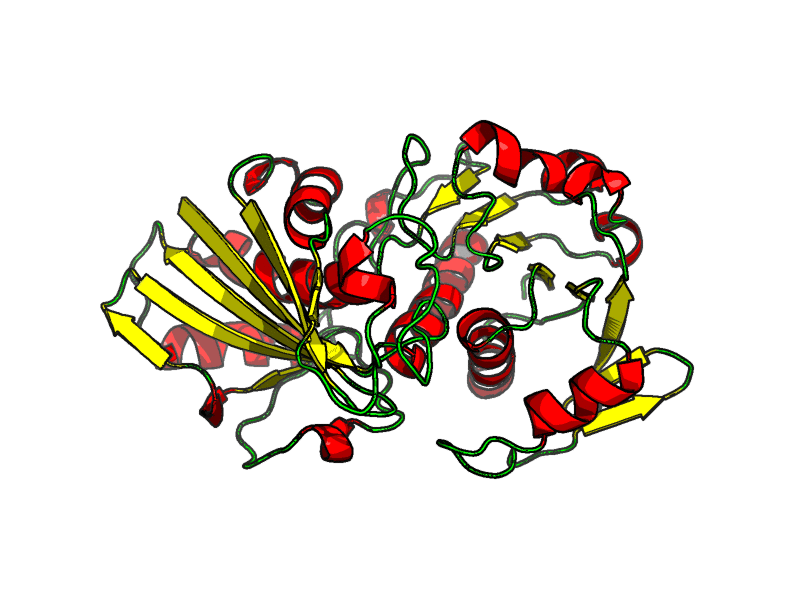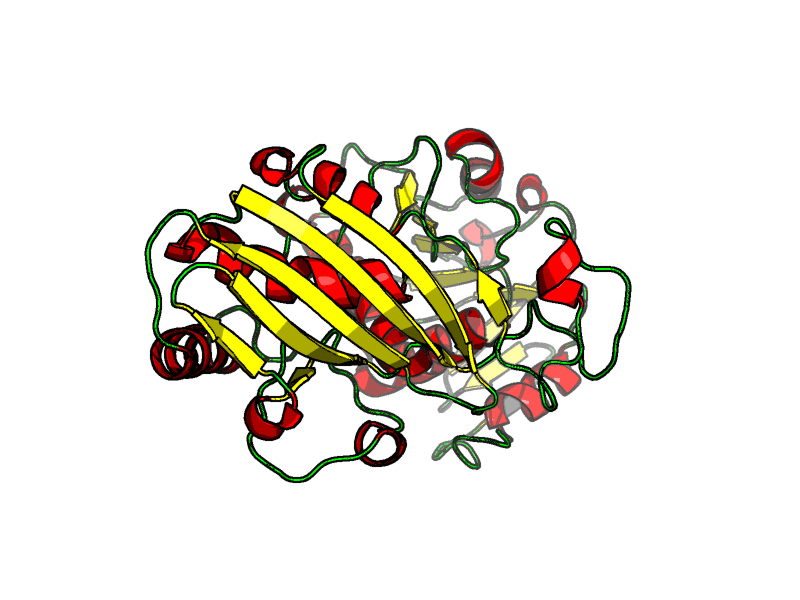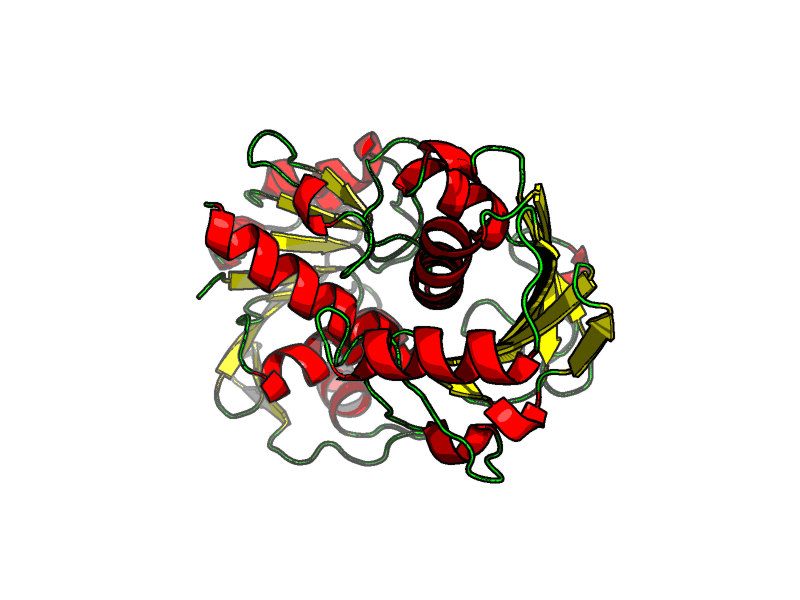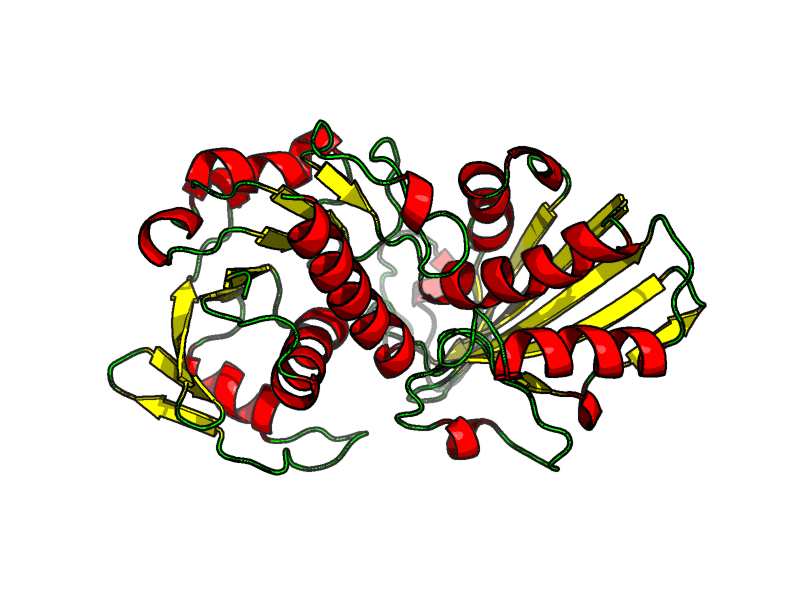
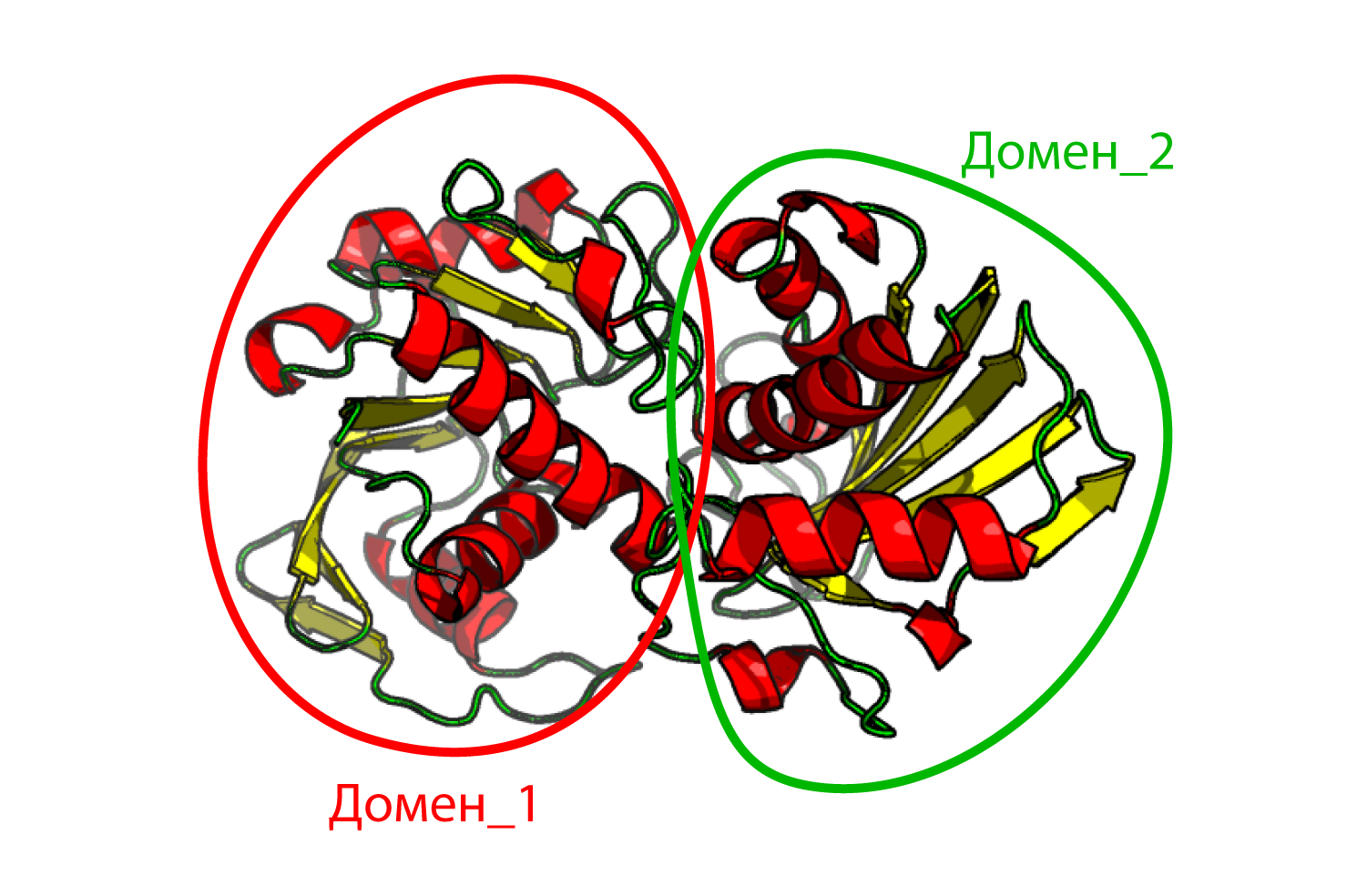
Можем предположить, что здесь есть два домена, но они не очень хорошо читаются (Рис. 2).
Кроме того, сделаю небольшое лирическое отступление. На физике белка утверждалось, что аминокислотная последовательность определяет пространственную структуру, структура - функцию, а не наоборот. Были приведены примеры белков с разной структурой, выполняющих одинаковые функции - сериновые протеазы: имотрипсин и субтилизин. Также был пример белков с похожей пространственной организацией: цитохром C, гемэритрин и белок оболочки вируса табачной мозаики, которые состоят из 4-ёх альфа-спиралей, но выполняют совершенно разные функции и имеют в составе разные кофакторы.
Верно ли обратное, т.е. определяет ли функция белка его структуру? Здесь имеются некоторые корреляции, но очень на грубом уровне и всё-таки ряд примеров говорит о том, что функция белка не определяет его пространственную структуру. Но не стоит забывать, что похожие по архитектуре белки гомологичны и часто имеют идентичную или схожую функцию.
Исходя из вышеизложенного, мы будем осторожно использовать сервис PDBeFold, который структурно попарно выравнивает наш "файл из чёрной коробочки" со всем банком PDB, т.е. мы будем иметь в виду, что наши выводы исходят из некоторых допущений, позволяющих на основе структурного сходства предположить некоторые функции белка.
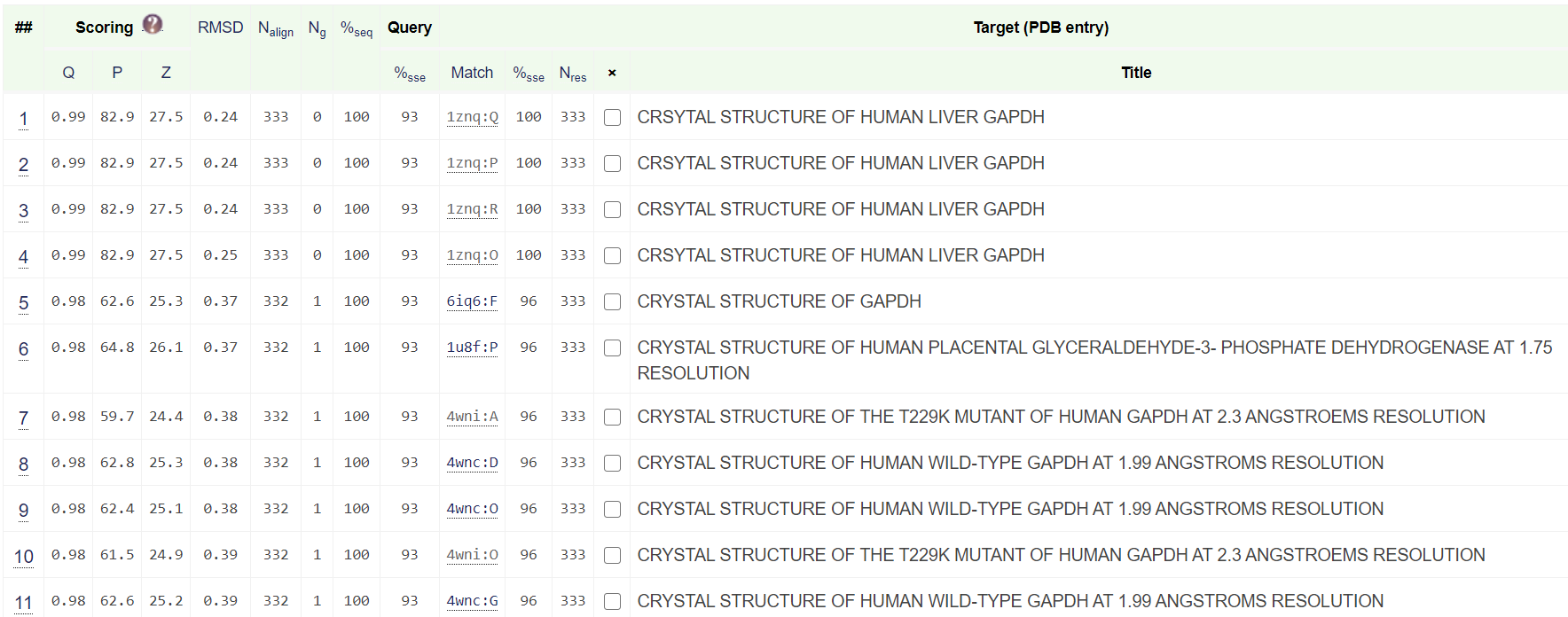
Топ выдачи состоит из различных структур белка GAPDH - глицеаральдегид-3-фосфат дегидрогеназа (Рис. 3). Было просмотрено около 120 структур топа. Это различные структуры этого белка, полученные из разных организмов, с разными мутациями и с разными кофакторами в составе.
Согласно обзору [1] GAPDH участвует в клетке в различных процессах: репарация ДНК, апоптоз, экспорт тРНК, транскрипция, но основной функцией считается катализ шестой реакции гликолиза (Рис. 4).
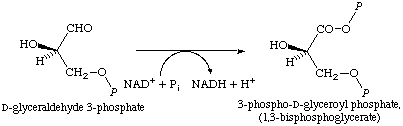
Кроме того, GAPDH используют в качестве housekeeping'ого гена, чтобы нормировать данные qPCR. Далее кратко рассмотрю некоторые наиболее интересные структуры в топе выдачи.
PDB: 6iq6
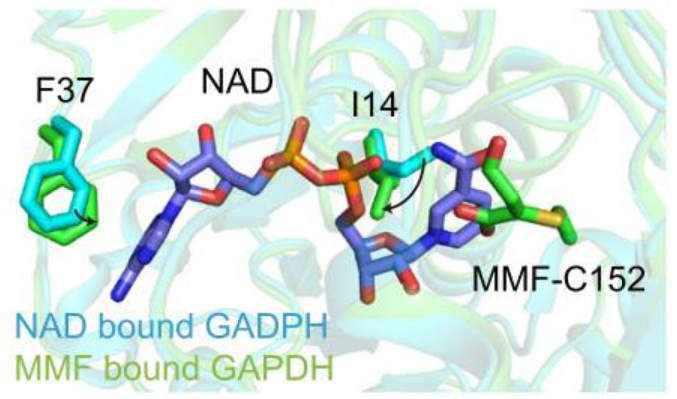
Структура содержит в составе монометил фумарат (MMF), который ковалентно связывается с каталитическим Cys-152 и ингибирует ферментативную активность GAPDH. Ещё MMF стерически блокирует связывание кофактора NAD+ [2], что показано на Рис. 5.
PDB: 4wni
Кроме участия в гликолизе, GAPDH может регулировать экспрессию белков, связываясь с AU-обогащёнными элементами различных 3'UTR мРНК. Эта структура с мутацией T229K препятствует формированию РНК-GAPDH комплекса. Эта мутация не мешает образовывать тетрамеры, а в норме GAPDH находится в цитоплазме в виде тетрамера, как мы знаем. Мутация способствует динамическим изменениям в местах контакотов мономеров и в сайте связывания NAD+ [3].
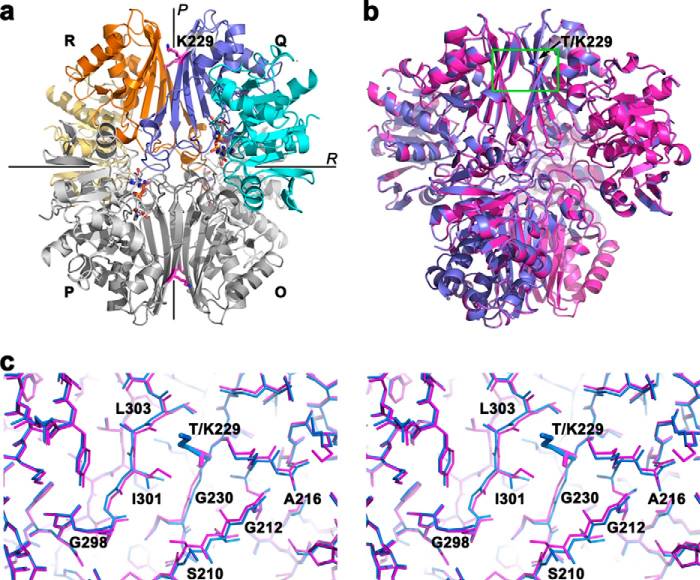
PDB: 1znq
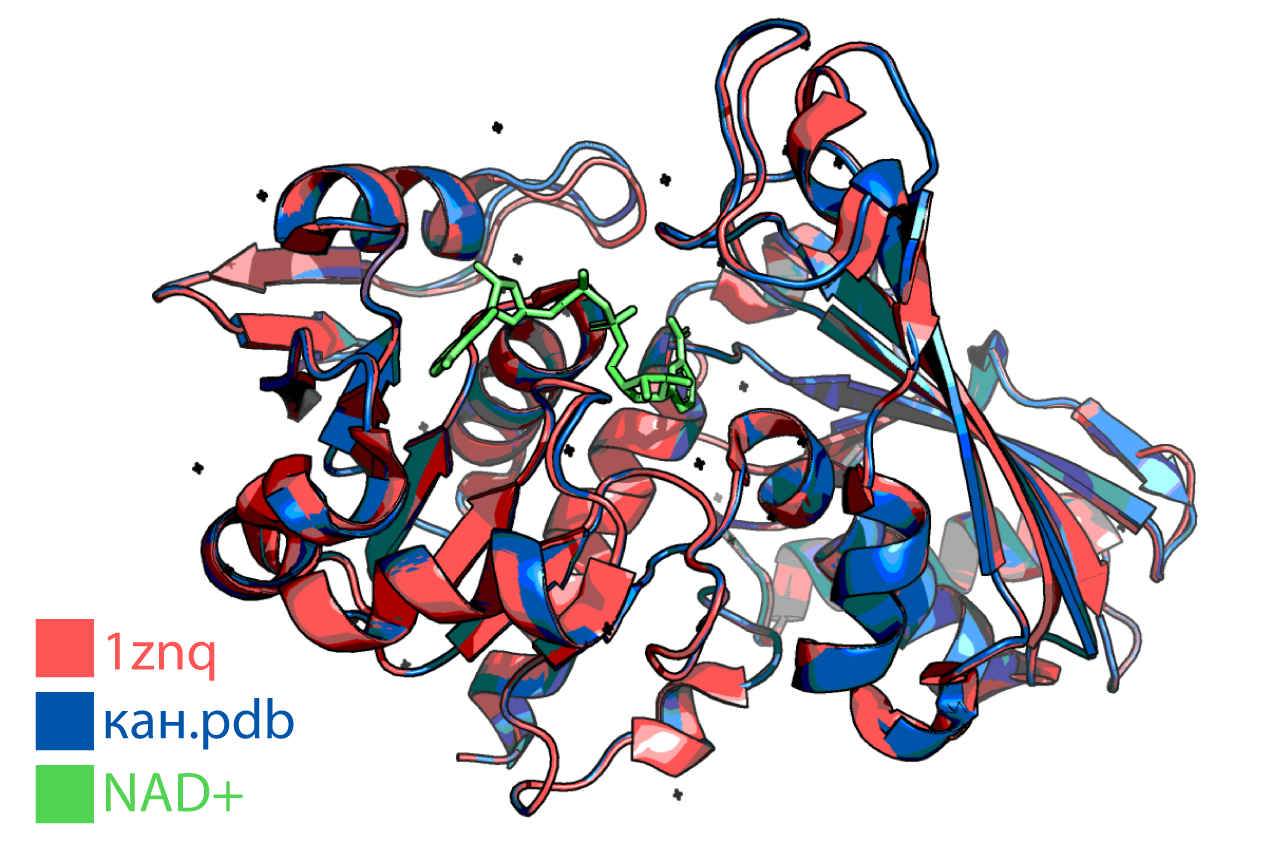
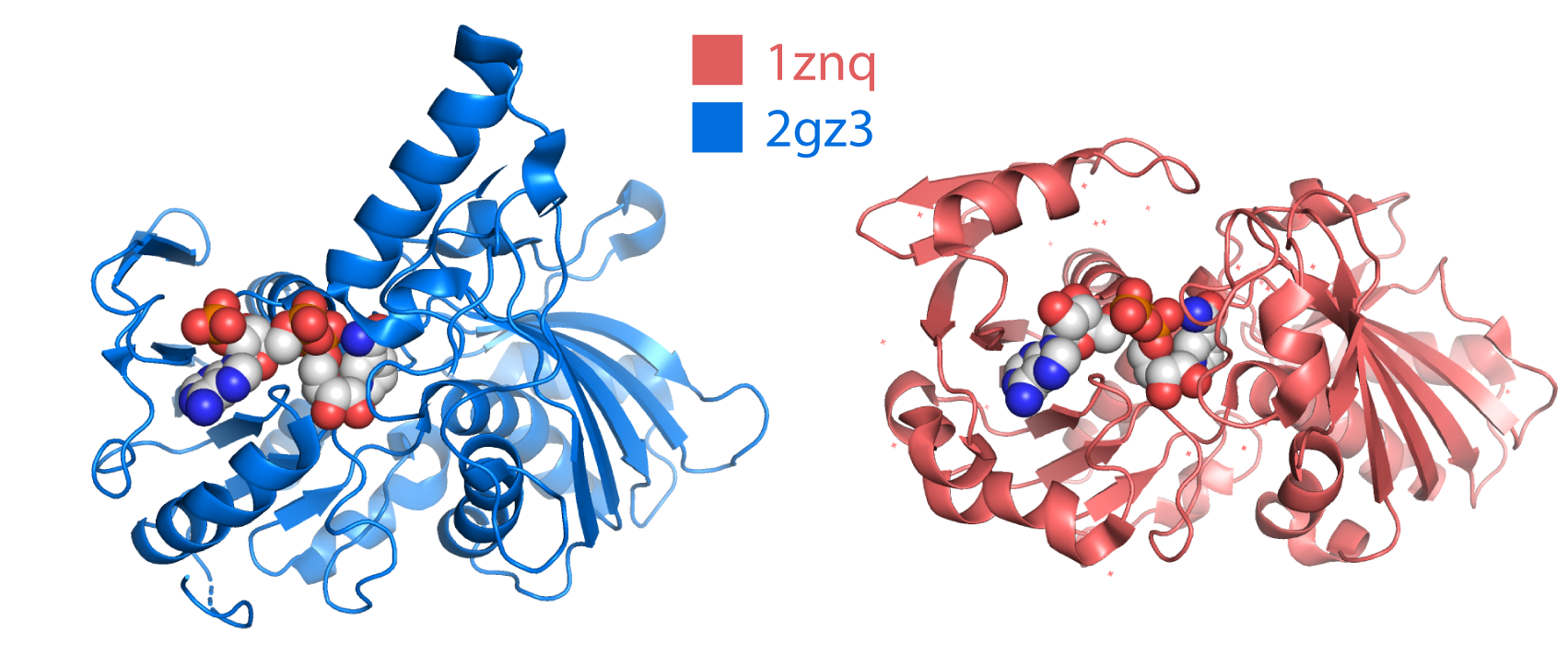
Подробнее мы остановимся на этой структуре, потому что все её цепи были в топе выдачи PDBeFold, а также по той причине, что данный тетрамер кокристаллизован с кофактором NAD+, который необходим для протекания реакции на рис. 3. Картинки, полученные мной будут лучшего качества и представлены далее. Видим, что наша структура неплохо накладывается на цепь Q структуры 1znq, некоторые петли не очень хорошо соответствуют друг другу (Рис. 7).
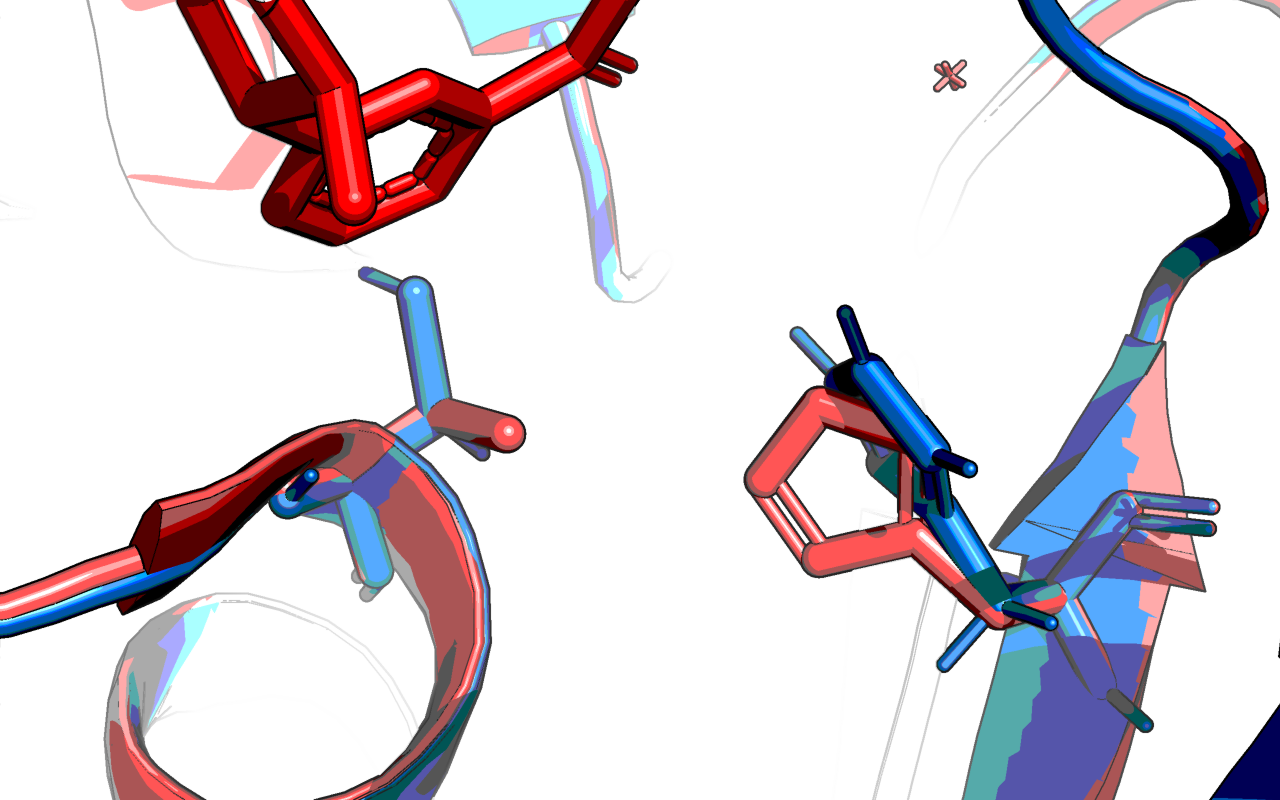
В M-CSA пишут, что механизм реакции плохо изучен, но предполагается, что в процессе реакции образуется интермедиат, ковалентно связанный с Cys-149, а His-176 выступает в качестве основания, активирующего тиоловую группу в процессе катализа (Рис. 8).
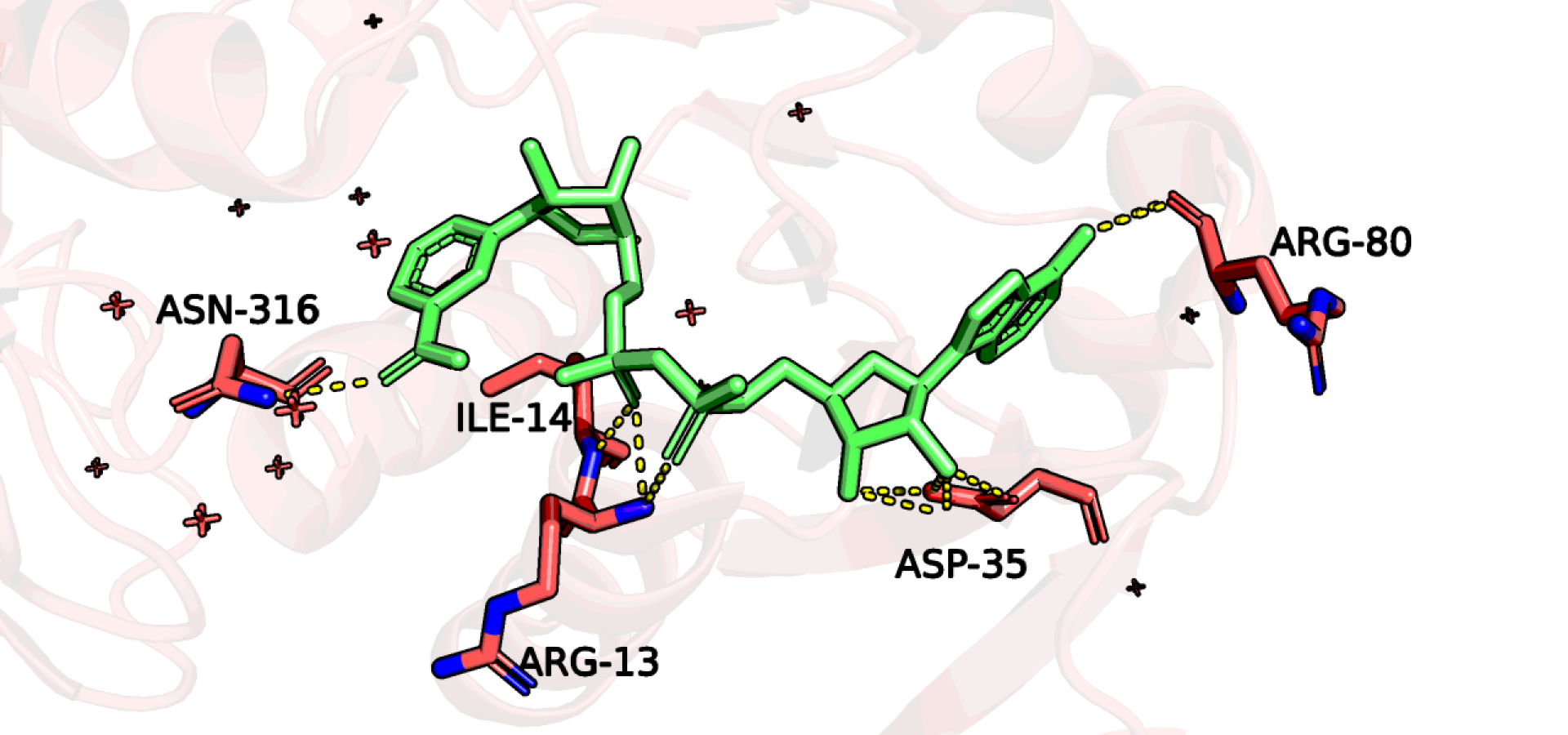
Данному белку для работы необходим кофактор NAD+, который связывается с GAPDH в нескольких местах (Рис. 10). Ещё белку для осуществления реакции необходим фосфат и субстрат, но их нет в данной РСА структуре.
Далее по PDB ID: 1znq был произведён поиск в базе данных CATH. Было выявлено два домена на уровне суперсемейства: NAD(P)-связывающий Россман-подобный домен и дипиколинатредуктазный домен, которые я неплохо выделила визуально, хотя и с сомнениями (Рис. 11). Получается механизм и структурные домены очень хорошо соотносятся: NAD(P)-связывающий Россман-подобный домен связывает NAD+, как нетрудно догадаться из названия, а дипиколинатредуктазный домен является каталитическим и осуществляет реакцию. В начале были не очень очевидны домены, посколько они должны быть сближены для осуществления реакции.
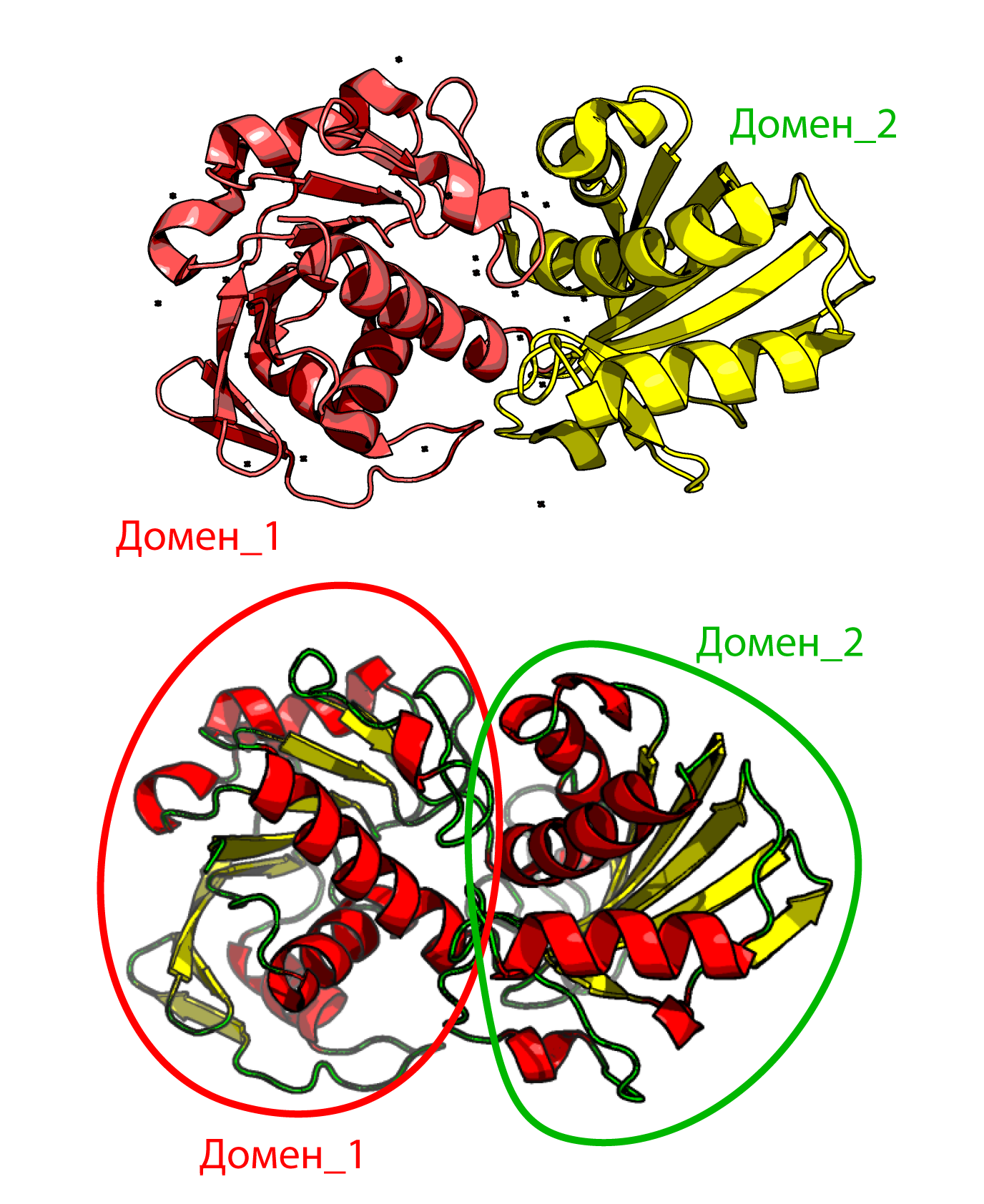
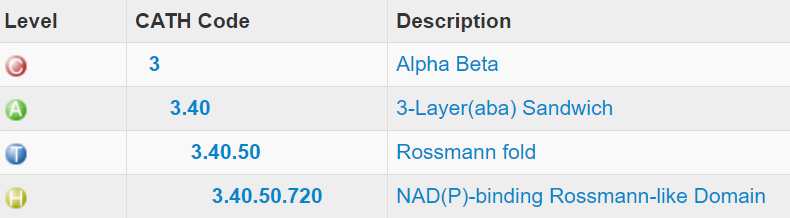
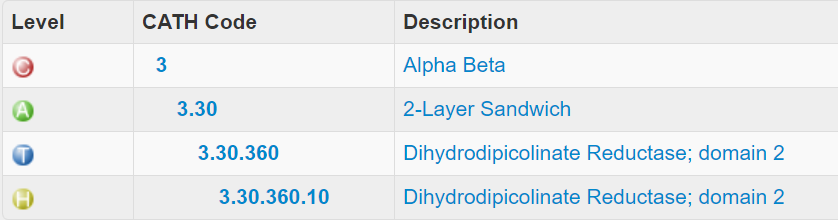
Место этих доменов в иерархии CATH на разных уровнях представлено ниже (Рис. 12 и Рис. 13).
Таким образом, мы определили при помощи PDBeFold, что нашему белку скорее всего соответсвует GAPDH. Два домена в составе этого белка неплохо выделяются визуально. Один из них осуществляет каталитическую функцию, а другой, образуя укладку Россмана, связывает кофактор NAD+.
Задание 2. Функциональный мотив
В данном задании мы использовали рассмотренный выше PDB: 1znq и запускали PDBeFold с выключенными Match connectivity и Best matches only. Параметры сопоставления количества вторичных структур были 70-70. Нужно было найти 2 разных белка с не более 35% идентичности по последовательности. Основная масса белков была ортологами, что существенно затруднило поиск (Рис. 14).
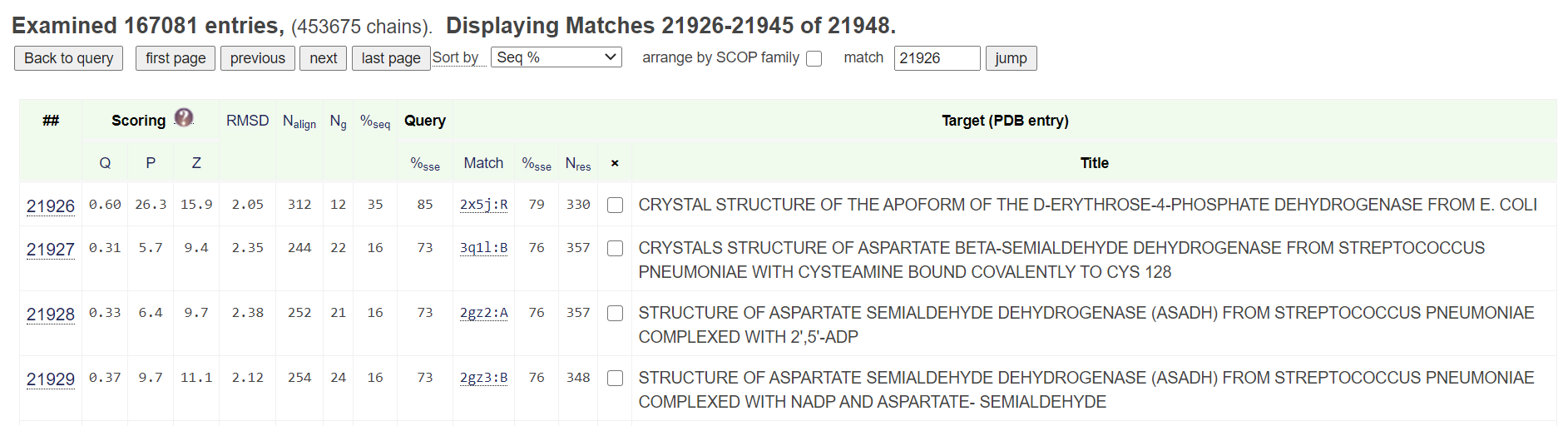
Для анализа помимо глицеральдегид-3-фосфат дегидрогеназы были выбраны два белка: D-эритроза-4-фосфат дегидрогеназа (35% идентичности) и аспартат-полуальдегид дегидрогеназа (16% идентичности). Классификация по CATH полностью совпадала для трёх белков. Кроме того, все три белка существуют в клетках в форме тетрамера. Согласно EC, общим является то, что эти ферменты - оксидоредуктазы, работающие с альдегидной или кето- группой донора и использующие NAD+ и NADP+ в качестве акцептора. Основное различие белков - процессирование разных субстратов. Остальные - перечислены в таблице 1.
| PDB код | 1znq | 2x5j | 2gz3 |
| Название (Eng) | Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | D-Erythrose-4-phosphate dehydrogenase (GapB-encoded protein) | Aspartate Semialdehyde Dehydrogenase (ASADH) |
| EC | 1.2.1.12 | 1.2.1.72 | 1.2.1.11 |
| Организм | Homo sapiens | Escherichia coli K-12 | Streptococcus pneumoniae |
| Субстрат | D-glyceraldehyde 3-phosphate 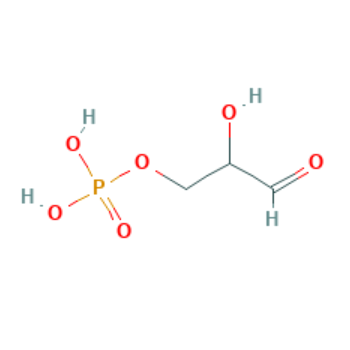 |
D-erythrose 4-phosphate 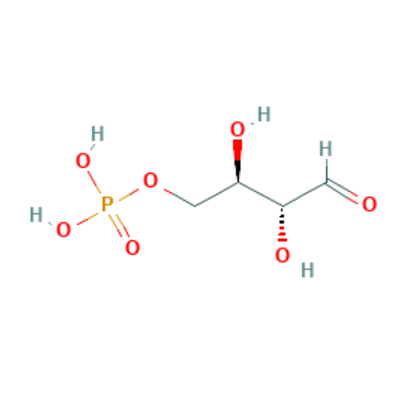 |
L-aspartate 4-semialdehyde 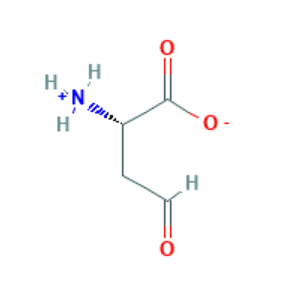 |
| Кофактор | NAD+ | NAD+ | NADP+ |
| Осуществляемая реакция | D-glyceraldehyde 3-phosphate + phosphate + NAD(+) = 3-phospho-D-glyceroyl phosphate + NADH | D-erythrose 4-phosphate + NAD(+) + H2O = 4-phosphoerythronate + NADH | L-aspartate 4-semialdehyde + phosphate + NADP(+) = L-4-aspartyl phosphate + NADPH |
| Некоторая информация про структуру | Комплекс с NAD+ | Комплекс с фосфатом | Комплекс с NADP и aspartate-semialdehyde |
По CATH белки совпадают. Кроме того, белки неплохо накладываются друг на друга (Рис. 15). Особенно два структурных домена. Я бы сказала, что это можно назвать общим функциональным мотивом: один домен связывает NAD(P)+, а другой выполняет каталитическую функцию.
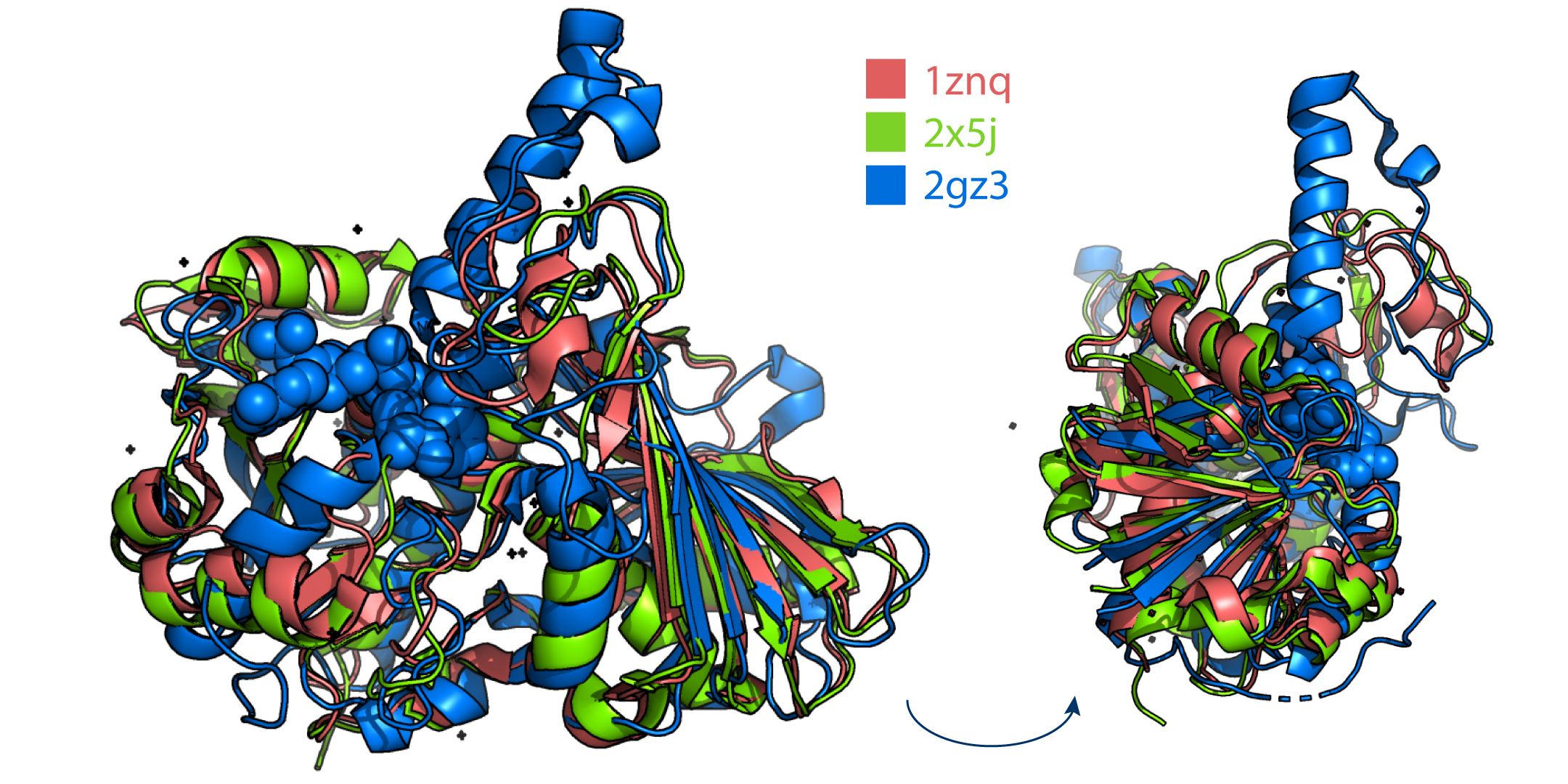
Заметим, что домен, образующий укладку Россмана отличен в "синей" структуре - альфа-спираль торчит наружу своим C-концом, а N-концом ориентирована внутрь, что по-видимому необходимо для лучшего связывания кофактора, ведь "розовая" и "зелёная" структуры используют NAD+, а "синяя" NADP+, а это на одну фосфатную группу больше. С другой стороны, изменение в структуре может быть связано с тем, что в составе 2gz3 имеется субстрат и кофактор, а это приводит к конформационным изменениям.
К сожалению, в наших структурах нет субстрата, поэтому мы не можем рассмотреть участки, участвующие в распознавании субстрата, а значит определить специфические остатки. Отметим, что GapB-кодирующий белок не использует фосфат в отличие от других белков и может неэффективно использовать субстрат GAPDH, что возможно вызвано тем, что вода в этом случае выступает в качестве лучшего нуклеофила, атакующего тиоацильный интермедиат [4].
Также отметим, что все три белка выделены из разных организмов. ASADH выделен из S.pneumoniae и задействован в биохимическом пути, который полностью отсутствует в млекопитающих [5].
Список литературы:
- Tristan, Carlos, et al. "The diverse functions of GAPDH: views from different subcellular compartments." Cellular signalling 23.2 (2011): 317-323.
- Park, Jun Bae, et al. "Structural study of monomethyl fumarate-bound human GAPDH." Molecules and cells 42.8 (2019): 597.
- White, Michael R., et al. "A dimer interface mutation in glyceraldehyde-3-phosphate dehydrogenase regulates its binding to AU-rich RNA." Journal of Biological Chemistry 290.3 (2015): 1770-1785.
- Boschi-Muller, Sandrine, et al. "Comparative Enzymatic Properties of GapB-encoded Erythrose-4-Phosphate Dehydrogenase of Escherichia coli and Phosphorylating Glyceraldehyde-3-phosphate Dehydrogenase." Journal of Biological Chemistry 272.24 (1997): 15106-15112.
- Faehnle, Christopher R., et al. "Examination of key intermediates in the catalytic cycle of aspartate-β-semialdehyde dehydrogenase from a Gram-positive infectious bacteria." Journal of Biological Chemistry 281.41 (2006): 31031-31040.