Задание 1. Альтернативные положения
В этом задании были рассмотрены альтернативные положения 55-го аргинина цепи Е фермента DPS,
выделенного из E.coli (PDB ID: 6B0D).
Так как остов в обеих альтернативных конформациях имеет одинаковое положение, то для
определения более стабильного положения рассматривались взаимодействия, образуемые радикалом.
Положение “А” и стабилизирующие его взаимодействия показаны на рис.1. Так, аргинин в данной конформации
образует водородные связи с аспарагином 53 цепи Е и валином 85 цепи С.
Конформация В (рис.2) стабилизируется водородной связью с остатком тирозина 16 цепи С и водородной связью
с молекулой воды, которая выступает в качестве линка для дополнительной стабилизации этого положения остатком валина
85 цепи С (расстояние между остатком аргинина 55 цепи Е и остатком валина 85 цепи С составляет более 4 ангстрем,
но через молекулу воды такое взаимодействие возможно).
Взаимное расположение двух альтернативных положений и их стабилизирующих связей показано на рис.3 Кажется,
что обе конформации примерно равновероятны, так как обе стабилизируются лишь водородными связями примерно
одинаковой длины. Это предположение подтверждается записью в PDB, согласно которой обе конформации имеют одинаковую населенность (рис.4).
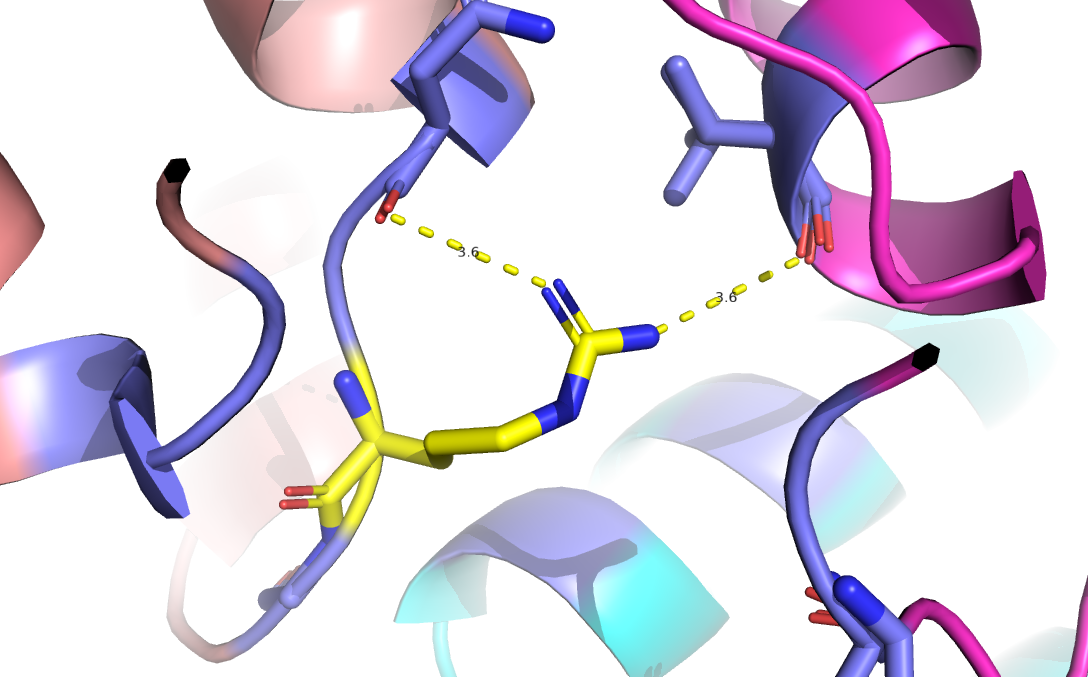
Рис.1. Взаимодействия (водородные связи) стабилизирующие конформацию А аргинина 55 цепи Е белка DPS c PDB ID:6D0D
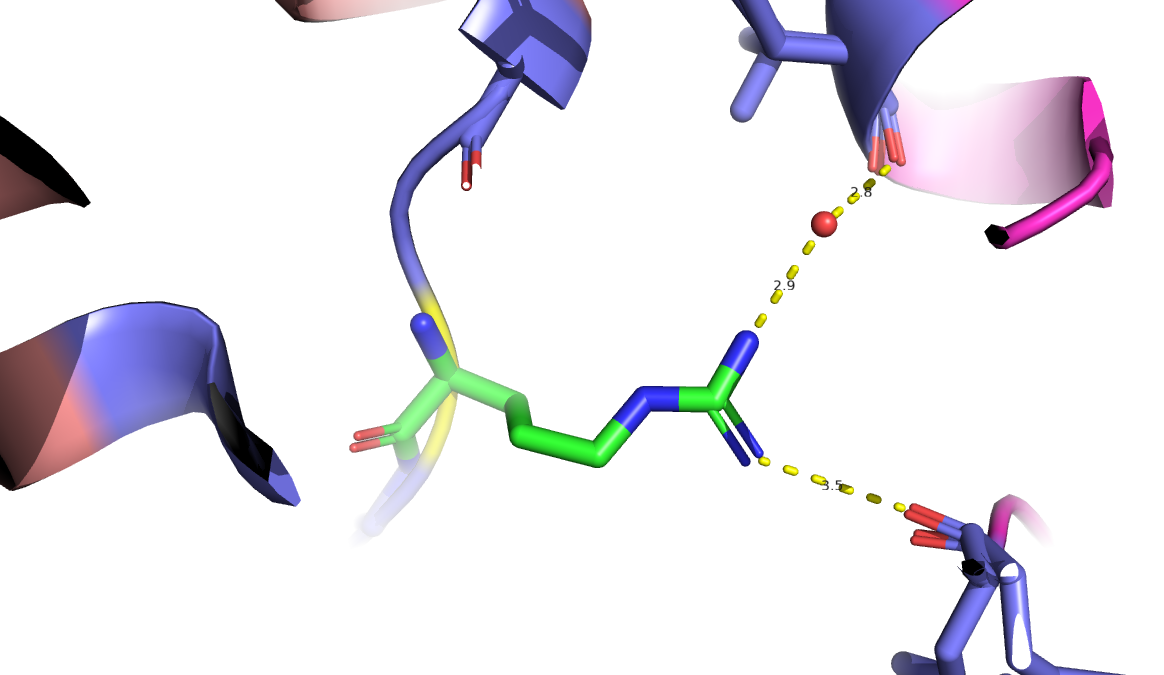
Рис.2. Взаимодействия (водородные связи) стабилизирующие конформацию B аргинина 55 цепи Е белка DPS c PDB ID:6D0D
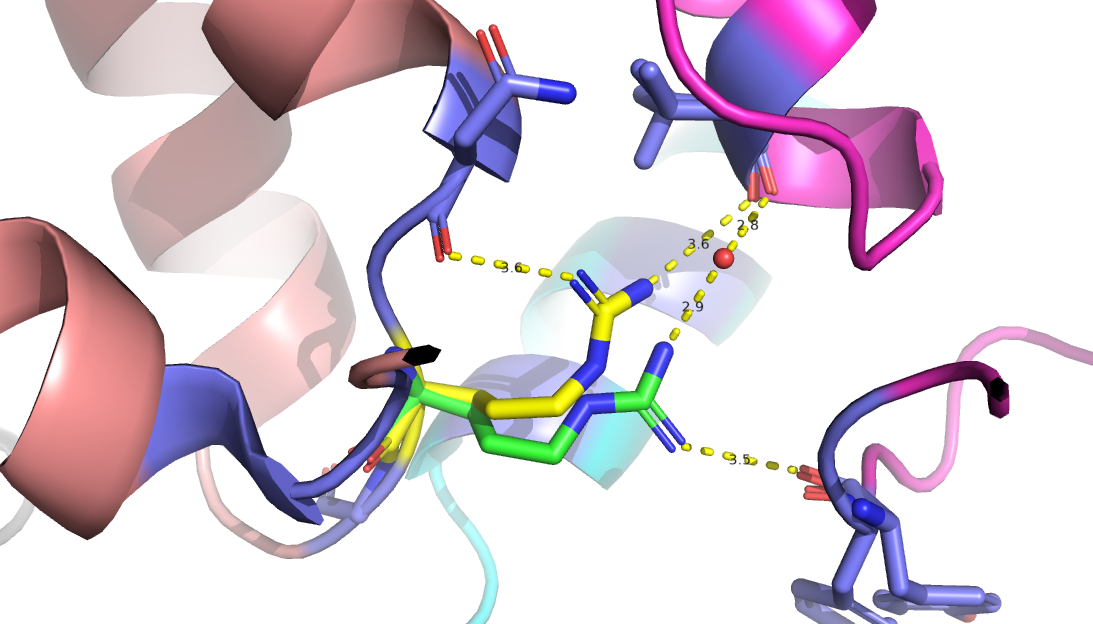
Рис.3. Bзаимное расположение конформаций аргинина 55 цепи Е белка DPS c PDB ID:6D0D и стабилизирующие их взаимдойствия (водородные связи)
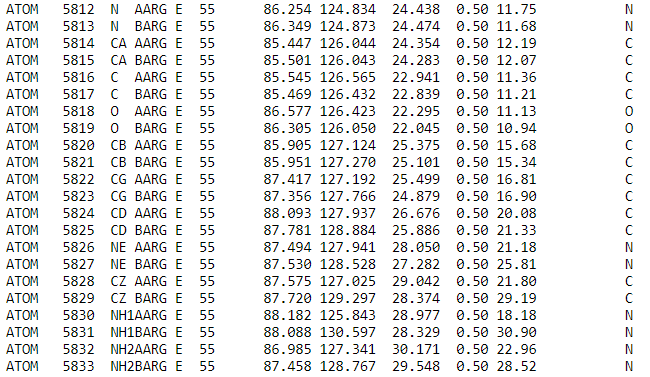
Рис.4. Данные о населенности атомов аргинина 55 цепи Е белка DPS c PDB ID:6D0D
Задание 2. B-фактор
B-фактор (температурный фактор) отражает термическую подвижностью атома (то есть обусловленную температурой).
Так, на рис.5, на котором показан остов белка DPS с PDB ID: 6B0D, покрашенный по В-фактору, видно, что более высокий В-фактор
(атомы остова красного цвета), или другими словами большую подвижность, имеют атомы аминокислотных остатков, расположенных по краю белка,
тогда как ближе к центру атомы имеют более низкий В-фактор. Это можно объяснить тем, что в центральной части белковой глобулы большая плотность
и между атомами остатков много стабилизирующих взаимодействий, предотвращающих подвижность атомов и, соответственно, снижающих В-фактор,
по сравнению с периферией.
Для второй части задания был выбран остаток аспарагина 13 цепи F. Как видно на рис.6, атомы этого аминокислотного остатка имеют
разную окраску по В-фактору, что говорит об их различии в подвижности. Так, от остова к радикалу подвижность увеличивается.
Рассматривая электронную плотность на 1, 2 и 3 уровнях подрезки (рис.7-8) можно заметить, что с увеличением уровня электронная
плотность исчезает с регионов с более высоким В-фактором (красные атомы). Это говорит о размытии электронной плотности более подвижных
атомов (то есть из-за неопределённого положения электронной плотности этих атомов они дают более слабый сигнал).
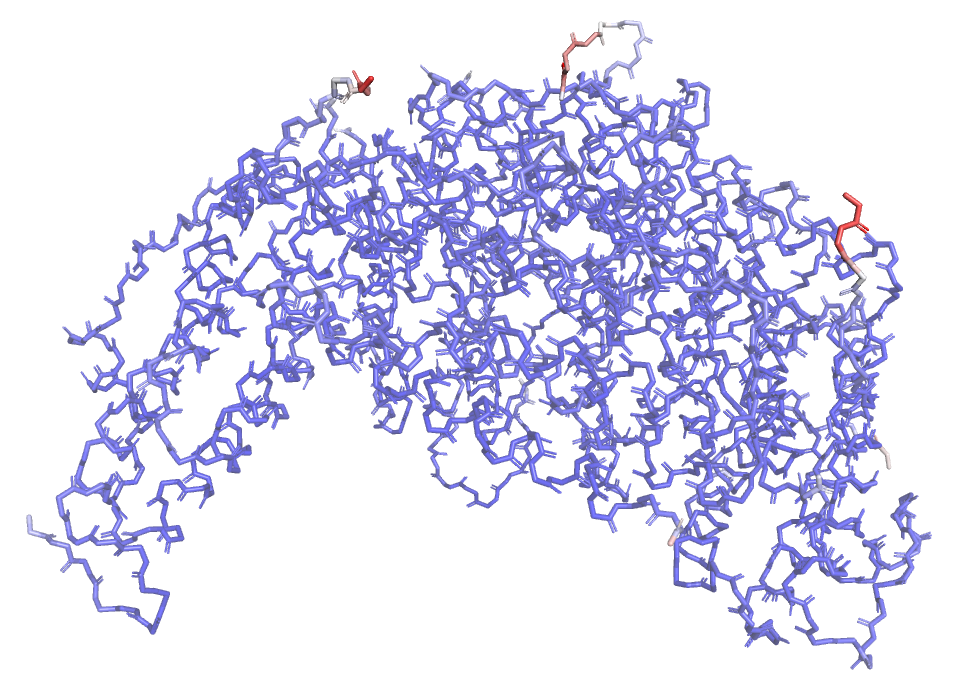
Рис.5. Остов белка DPS c PDB ID:6D0D, покрашенный по В-фактору (красные участки имеют большую подвижность, по сравнению с синими)
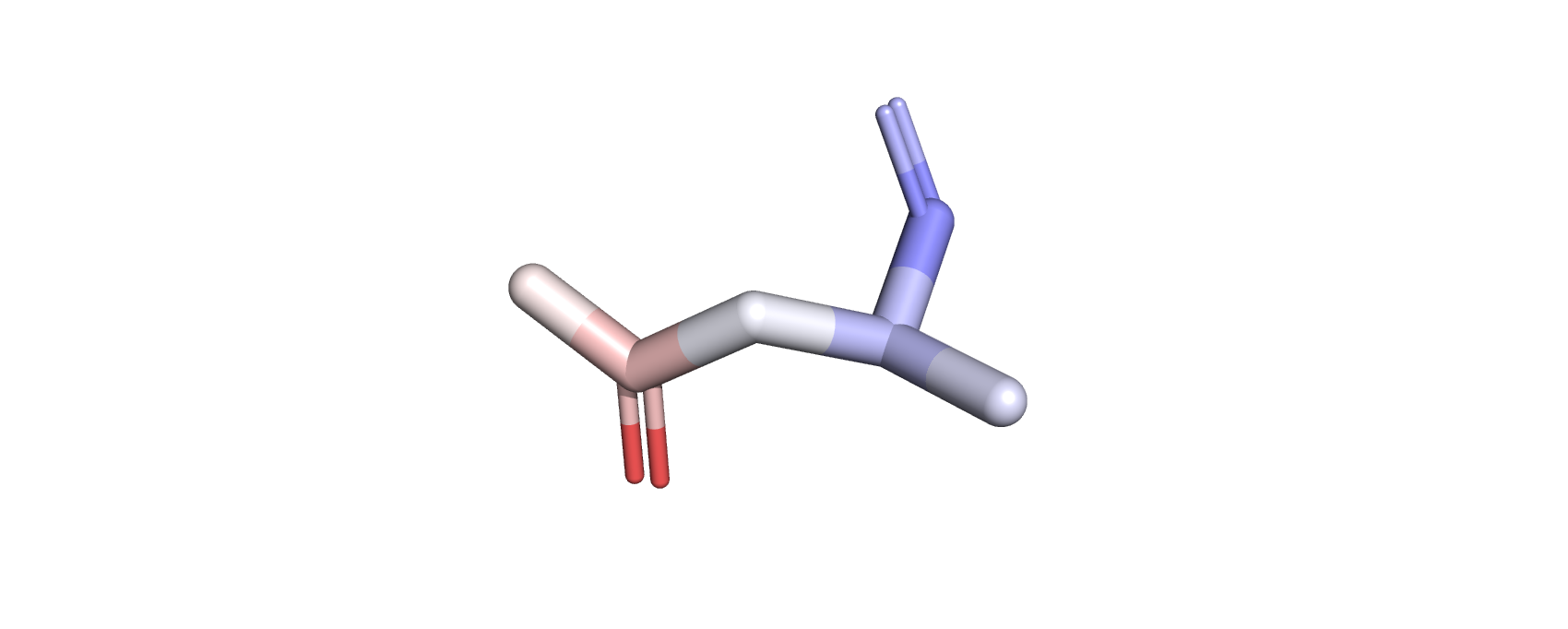
Рис.6. Остаток аспарагина белка DPS c PDB ID:6D0D, покрашенный по В-фактору (остов имеет меньшую подвижность (окрашен синим), чем радикал (окрашен красным))
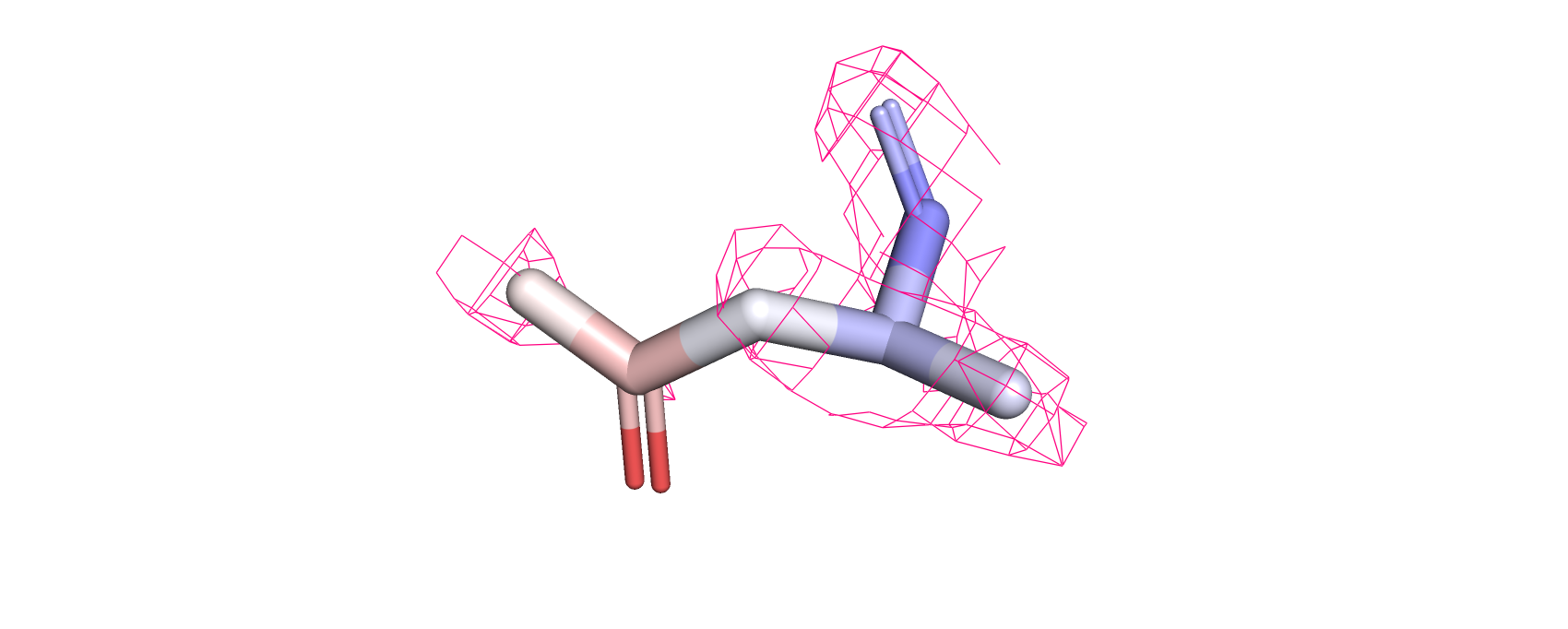
Рис.7.Остаток аспарагина белка DPS c PDB ID:6D0D, покрашенный по В-фактору, и с визуализированной электронной плотностью атомов (уровень подрезки=1)
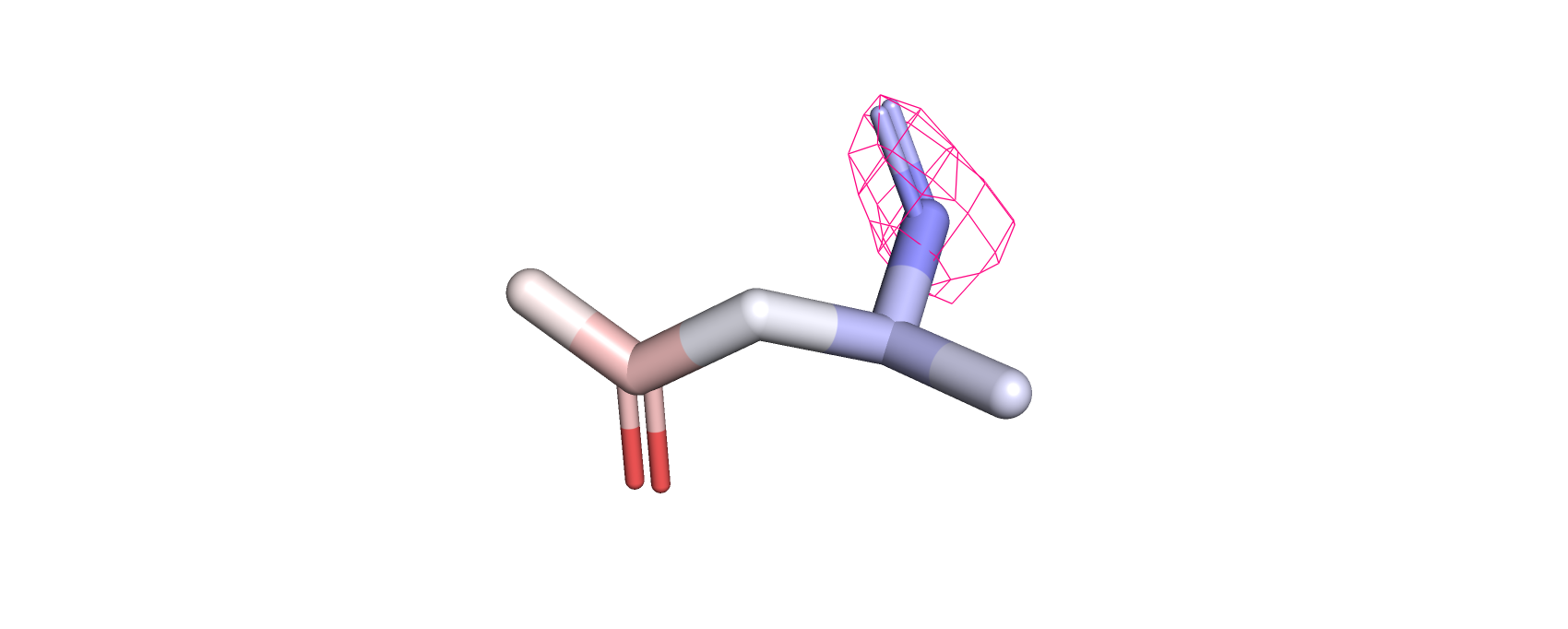
Рис.8.Остаток аспарагина белка DPS c PDB ID:6D0D, покрашенный по В-фактору, и с визуализированной электронной плотностью атомов (уровень подрезки=2)
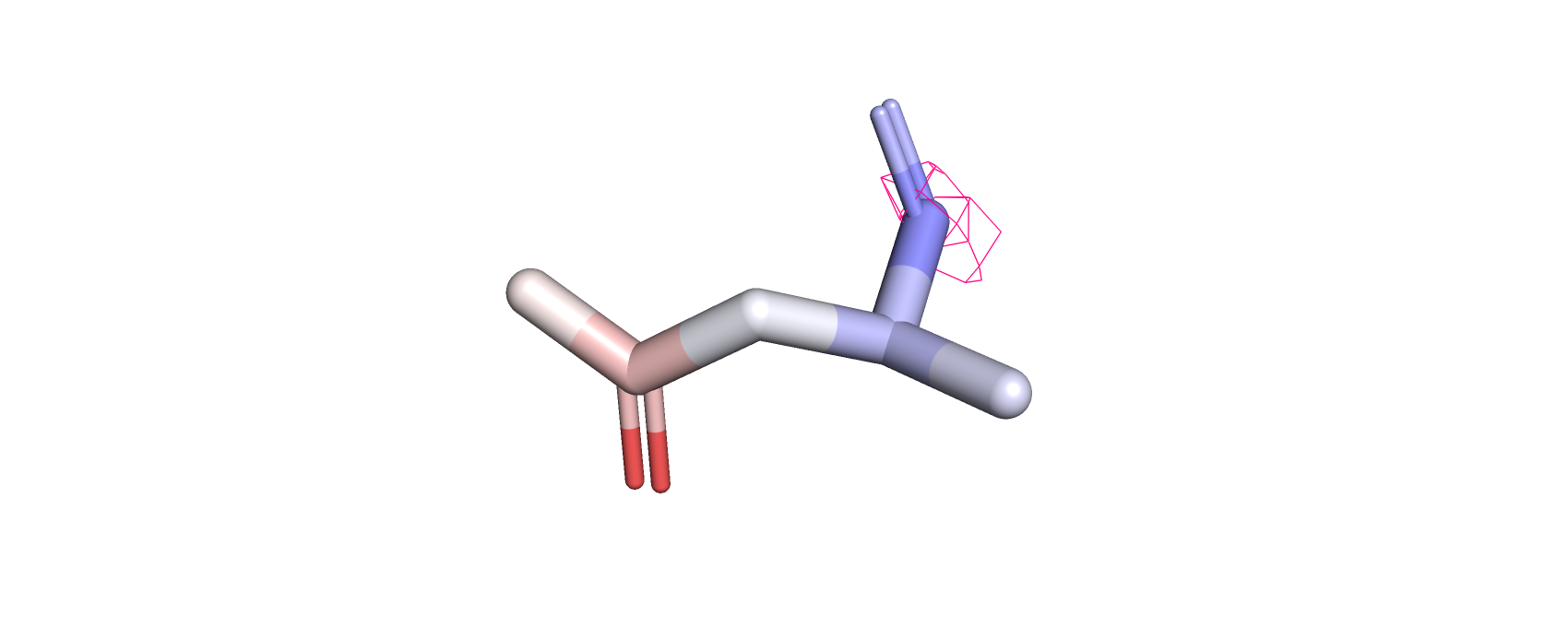
Рис.9.Остаток аспарагина белка DPS c PDB ID:6D0D, покрашенный по В-фактору, и с визуализированной электронной плотностью атомов (уровень подрезки=3)
Задание 3. Соседи
В этом задании был восстановлен фрагмент кристалла (отсечка по расстоянию 50 Å), состоящего из
белков DPS c PDB ID:6D0D (рис.10).
Исходная же молекула (покрашена в ярко-розовый) контактирует с 11 соседями (отсечка по расстоянию 3.6 Å) (рис.11-12)
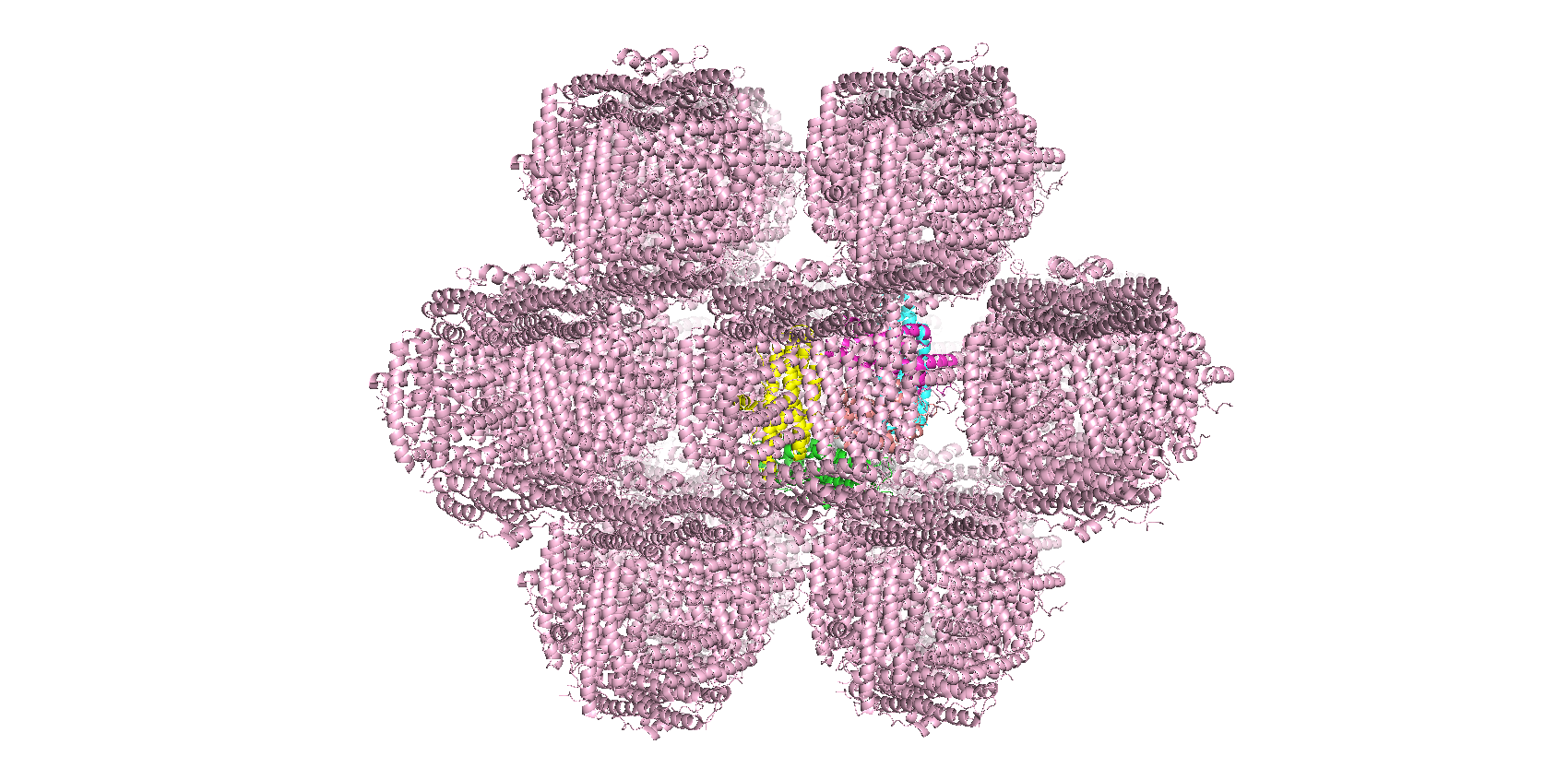 Рис.10. Фрагмент кристалла (отсечка по расстоянию 50 Å), состоящий из
белков DPS c PDB ID:6D0D
Рис.10. Фрагмент кристалла (отсечка по расстоянию 50 Å), состоящий из
белков DPS c PDB ID:6D0D
 Рис.11. Соседи кристалла (11 соседей), с которыми взаимодействует исходная молекула (ярко-розовая) (первый ракурс изображения)
Рис.11. Соседи кристалла (11 соседей), с которыми взаимодействует исходная молекула (ярко-розовая) (первый ракурс изображения)
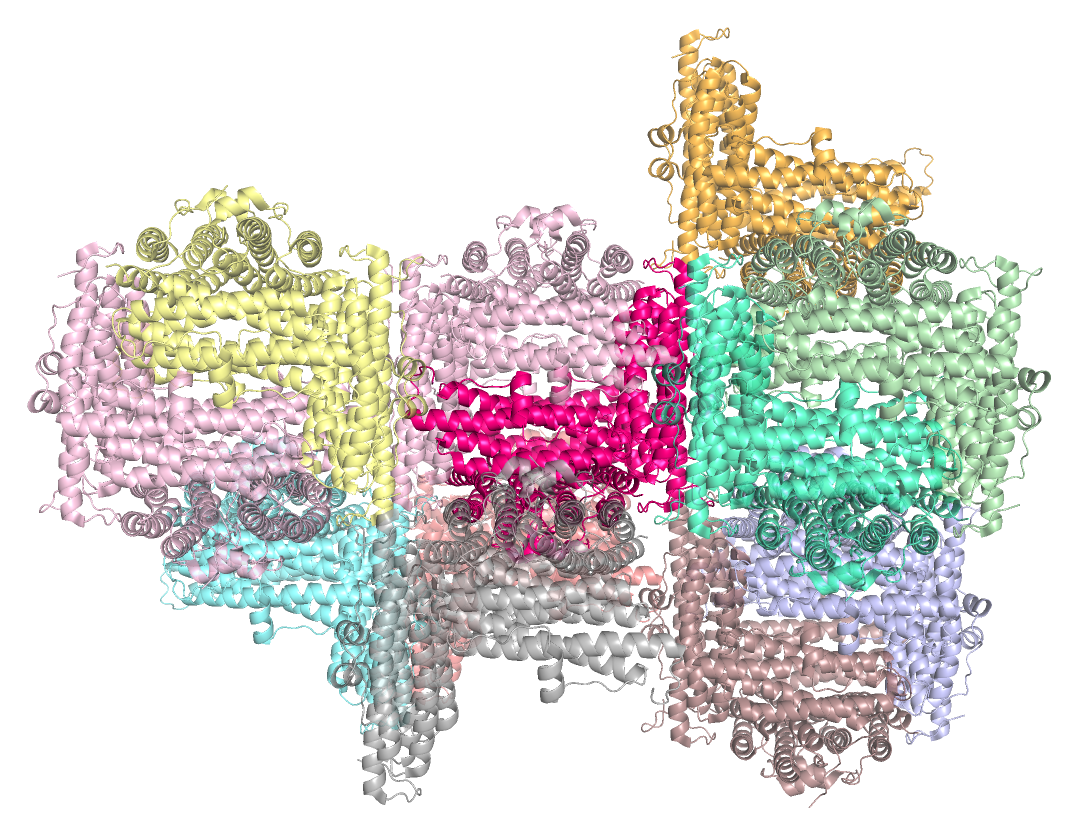 Рис.12. Соседи кристалла (11 соседей), с которыми взаимодействует исходная молекула (ярко-розовая) (второй ракурс изображения)
Рис.12. Соседи кристалла (11 соседей), с которыми взаимодействует исходная молекула (ярко-розовая) (второй ракурс изображения)









 Рис.10. Фрагмент кристалла (отсечка по расстоянию 50 Å), состоящий из
белков DPS c PDB ID:6D0D
Рис.10. Фрагмент кристалла (отсечка по расстоянию 50 Å), состоящий из
белков DPS c PDB ID:6D0D
 Рис.11. Соседи кристалла (11 соседей), с которыми взаимодействует исходная молекула (ярко-розовая) (первый ракурс изображения)
Рис.11. Соседи кристалла (11 соседей), с которыми взаимодействует исходная молекула (ярко-розовая) (первый ракурс изображения)
 Рис.12. Соседи кристалла (11 соседей), с которыми взаимодействует исходная молекула (ярко-розовая) (второй ракурс изображения)
Рис.12. Соседи кристалла (11 соседей), с которыми взаимодействует исходная молекула (ярко-розовая) (второй ракурс изображения)