Задание 1. Вводное
1) PDB ID структуры белка кристаллина, полученного методом РСА 6FD8; разрешение
данной структуры 2.1 Å.
2) PDB ID структуры белка кристаллина, полученного методом ЯМР 2M3T; всего было обработано 200 моделей, а загружено в PDB 21 модель.
3) На рис.1. приведено изображение выровненных структур белка кристаллина, полученных методом ЯМР и РСА. На уровне макроструктуры, не
считая отсутствия молекул растворителя в структуре, полученной методом РСА,
струкруры максимально похожи, лишь иногда немного смещаются свободные бета-листы, но,
скорее всего, это происходит из-за альтернатив конформаций в моделях, полученных методом ЯМР (так как анализируется несколько структур, полученных
в эксперименте и они могут неколько отличаться между собой). Отличия на микроуровне данных структур исключительно в различных альтернативных
положениях аминокислот (аминокислотный состав этих структур идентичен, в структуре, полученной методом ЯМР есть лишь 4 дополнительные аминокислоты
на N-конце, который является наиболее конформационно вариабельным участком белка)- так, примером этому может служить рис.2., где в структуре белка кристаллина,
полученного методом РСА аминокислоты лейцин 132 и валин 131, и изолейцин 95 и лизин 94 образуют бета-лист, тогда как в структре,
полученной методом ЯМР эти аминокислоты не входят в состав бета-листа (аминокислоты лейцин 133 и валин 132, и изолейцин 96 и лизин 95) (приведен
пример на рис.2. по одной из 21-ой структуры, но в остальных ситуация такая же).
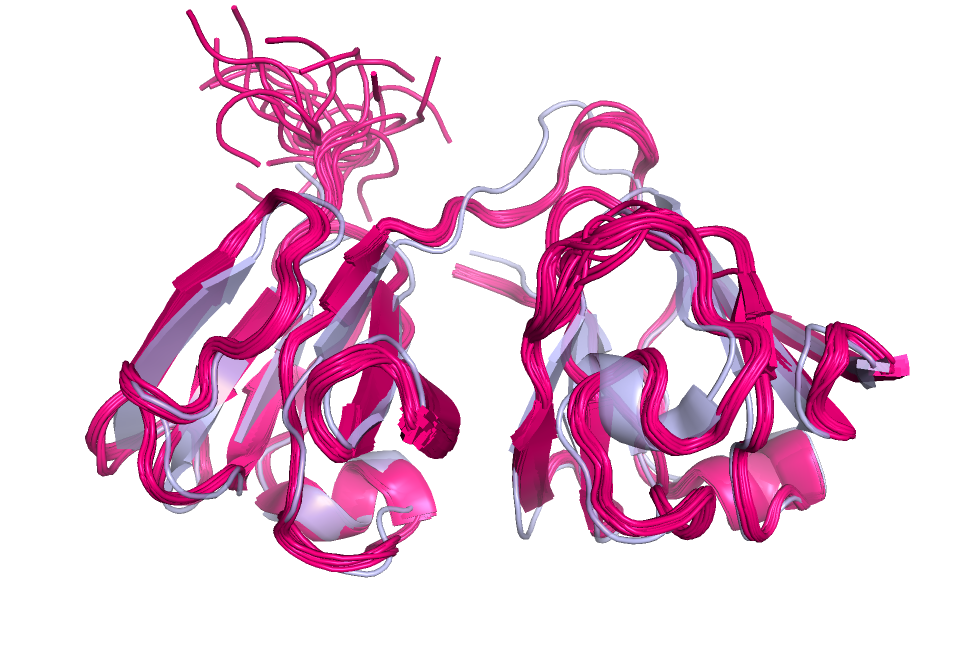
Рис.1 Выровненные структуры белка кристаллина, полученные методом ЯМР (розовая структура) и РСА (серая структура)
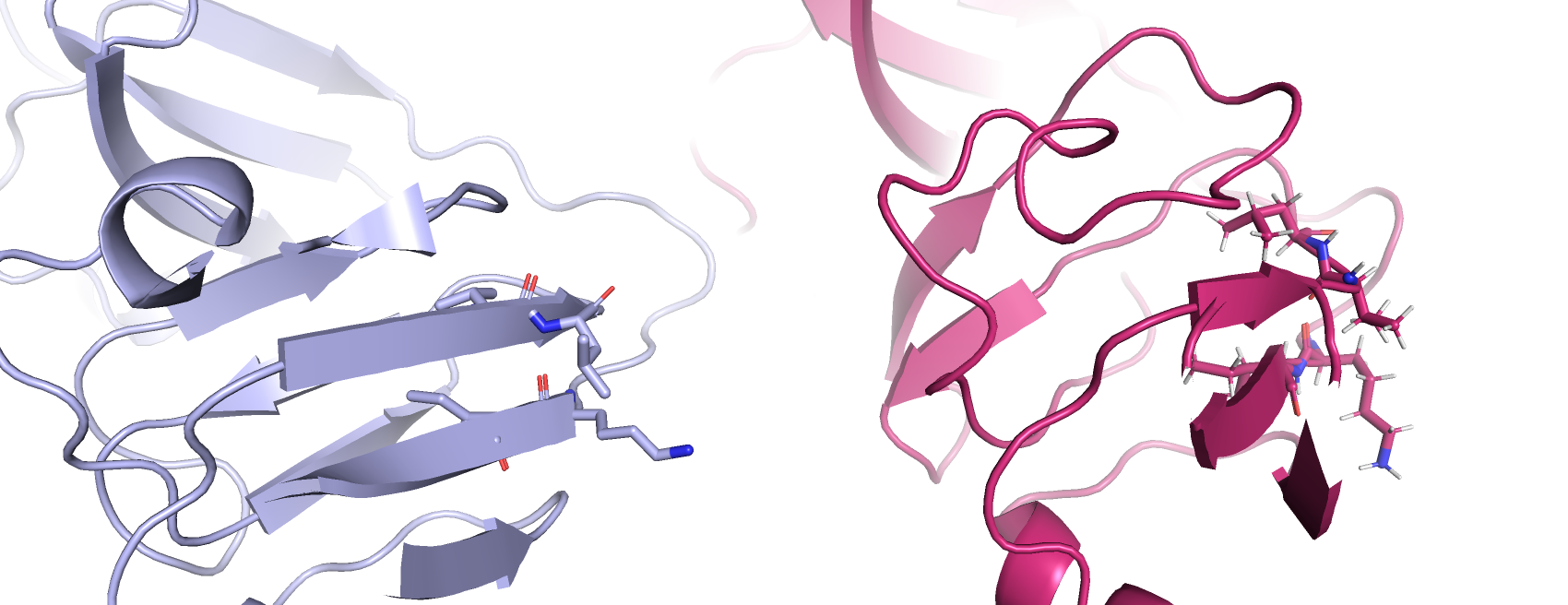
Рис.2 Пример отличий структуры белка кристаллина на микроуровне, полученных методом ЯМР (розовая структура) и РСА (серая структура):
аминокислоты лейцин 132 и валин 131, и изолейцин 95 и лизин 94 образуют бета-лист, тогда как в структре,
полученной методом ЯМР эти аминокислоты не входят в состав бета-листа (аминокислоты лейцин 133 и валин 132, и изолейцин 96 и лизин 95)
Задание 2. RMSF
В записи PDB о модели, полученной методом ЯМР, находится информация о наборе моделей,
которые авторы посчитали наиболее соответствующими реальной структуре. Однако, в такой модели все равно существуют ограничения
на расстояния и ковалентную связность между атомами, которые могут быть связаны с подвижностью этих атомов или же обуславливается
неточностями эксперимента. Если бы не существовало явления шума в эксперименте, то модели ЯМР отражали бы вариацию в позициях
белка, а значения RMSF, соответственно, относились бы к реальной подвижности отдельных ее участков. На рис.3 приведен график
соотношения значений RMSF, рассчитанных по модели, полученной методом ЯМР, и средних B-факторов остатков, рассчитанных по
модели, полученной методом РСА. Сравниваются значения для одних и тех же аминокислот белка кристаллина (при сравнении
структур в PyMOL оказалось, что первые четыре аминокислоты отсутствуют в модели PCA, поэтому значения RMSF рассматривались
с пятой аминокислоты). По моему мнению, исходя из графика на рис.3, значения, характеризующие подвижность аминокислот
при разных методах получения структур, не соотносятся- остатку с большим B-фактором, в большинстве случаев, не соответствует
большее значение RMSF. Таким образом, для белка кристаллина RMSF из ЯМР модели не отображает подвижность.
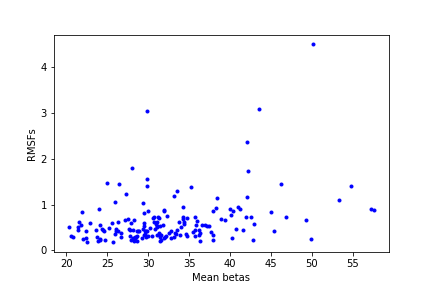
Рис.3.Cоотношение средних B-факторов аминокислот из РСА модели c PDB ID 6FD8 , и RMSF из ЯМР модели c PDB ID 2M3T.
Задание 3.
Таблица с расстояниями и другими запрошенными характеристиками:
| положение в структуре | связанные остатки | Расстояниев РСА, Å | % моделей ЯМР со связью | минимальное расстояние в ЯМР, Å | максимальное расстояние в ЯМР, Å | медиальное расстояние в ЯМР, Å |
|---|---|---|---|---|---|---|
| между атомами остова в ядре белка | валин 48 и тирозин 59 | 3.0 | 100% | 2.7 | 3.3 | 2.9 |
| между атомами боковых цепей в ядре белка | тирозин 140 и аргинин 174 | 3.0 | 0% | 5.0 | 5.5 | 5.2 |
| между атомами в петлях, выходящих на поверхность глобулы | аргинин 146 и пролин 143 | 3.5 | 80% | 3.2 | 3.7 | 3.4 |
1)Водородные связи между атомами остова в ядре белка (рис.4.): была рассмотрена водородная связь между атомами остова валина 48 и тирозина 59, которые входят в соства бета-листа. Во первых, тут наиболее маленькое расстояние между образующими водородную связь группами, среди остальных пунктов этого задания. И, как и стоило ожидать, во всех 21 полученных ЯМР структурах кристаллина эта связь присутствует.
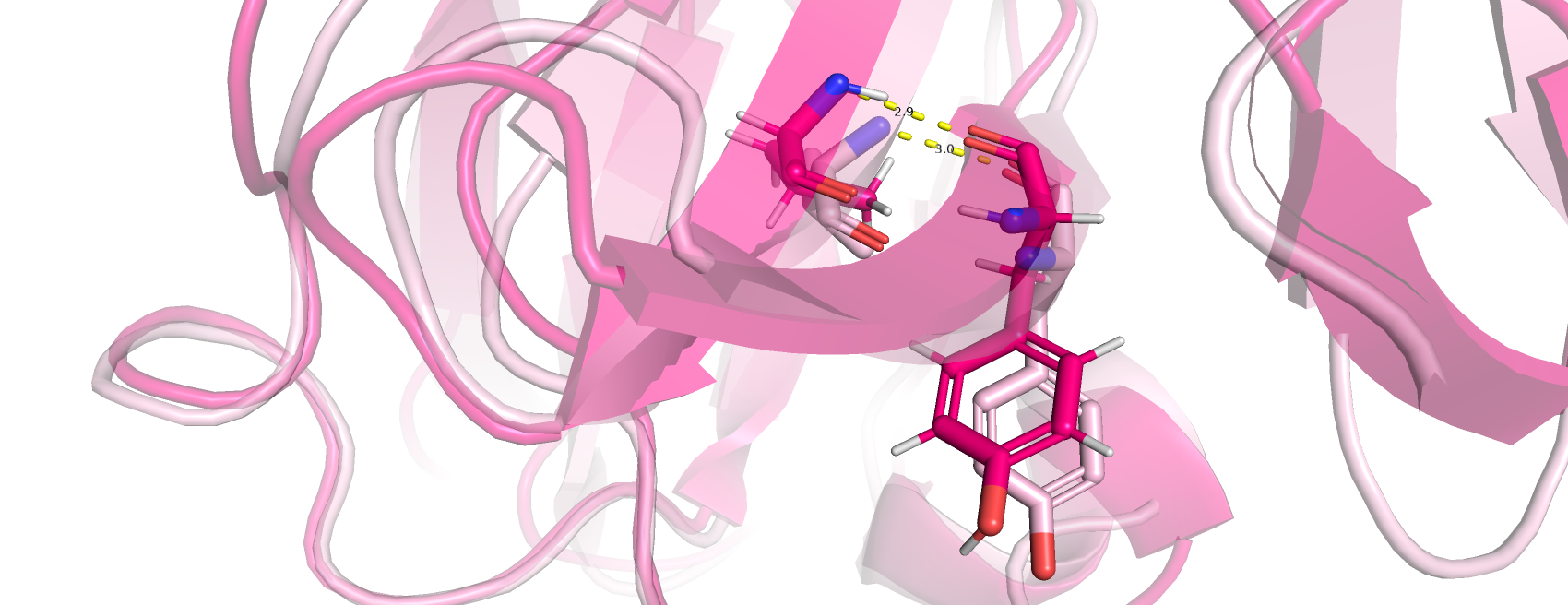
Рис.4.Водородные связи между атомами остова в ядре белка: валин 48 и тирозин 59 (светло-розовая структура получена методом РСА, ярко-розовая- ЯМР)
2)Водородные связи боковых цепей в ядре белка (рис.5.): стоит сказать, что доставшийся мне белок имеет гидрофобные ядра, в которых мне не удалось найти водородные связи, поэтому я выбрала водородную связь между остатками тирозина 140 и аргинина 174 (они входят в состав бета-листов), которые еще можно считать не экспонированными наружу. Однако оказалось, что в ЯМР модели этой связи нет ни в одной из 21 структур, хотя, по-идее, хоть в части она должна была бы сохраниться (то есть скорее всего это особенность данных структур, а не правило)
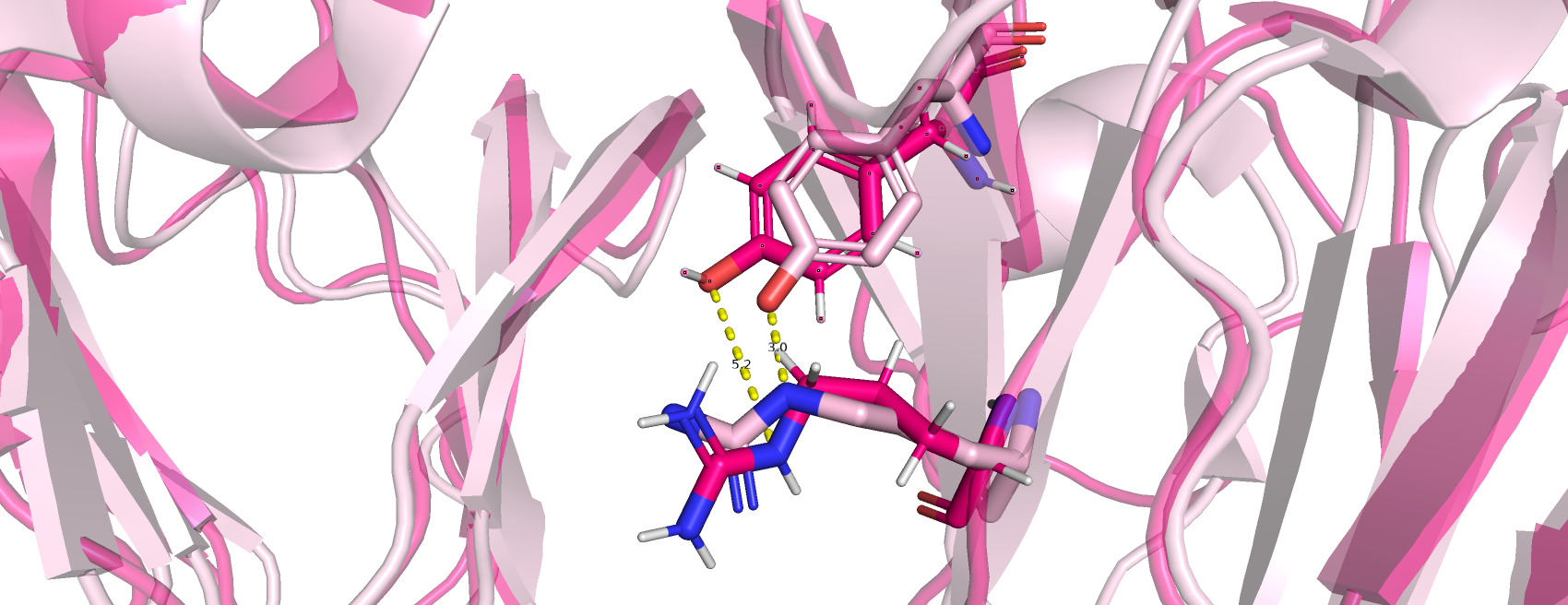
Рис.5.Водородные связи боковых цепей в ядре белка: тирозин 140 и аргинин 174 (светло-розовая структура получена методом РСА, ярко-розовая- ЯМР)
3) водородна связь в петлях, выходящих на поверхность глобулы (рис.6.): были выбраны остатки аргинина 146 и пролина 143, входящие в состав свободной пептидной цепи, экспонированной наружу. Оказалось, что несмотрея на "пограничное" значение расстояния между образующими водородную связь остатками, эта водородная свзяь присутсвует в 80% структур белка кристаллина, полученного методом ЯМР. Казалось, что процент должен быть меньше, учитывая конформационную вариабельность свободных пептидных цепей.
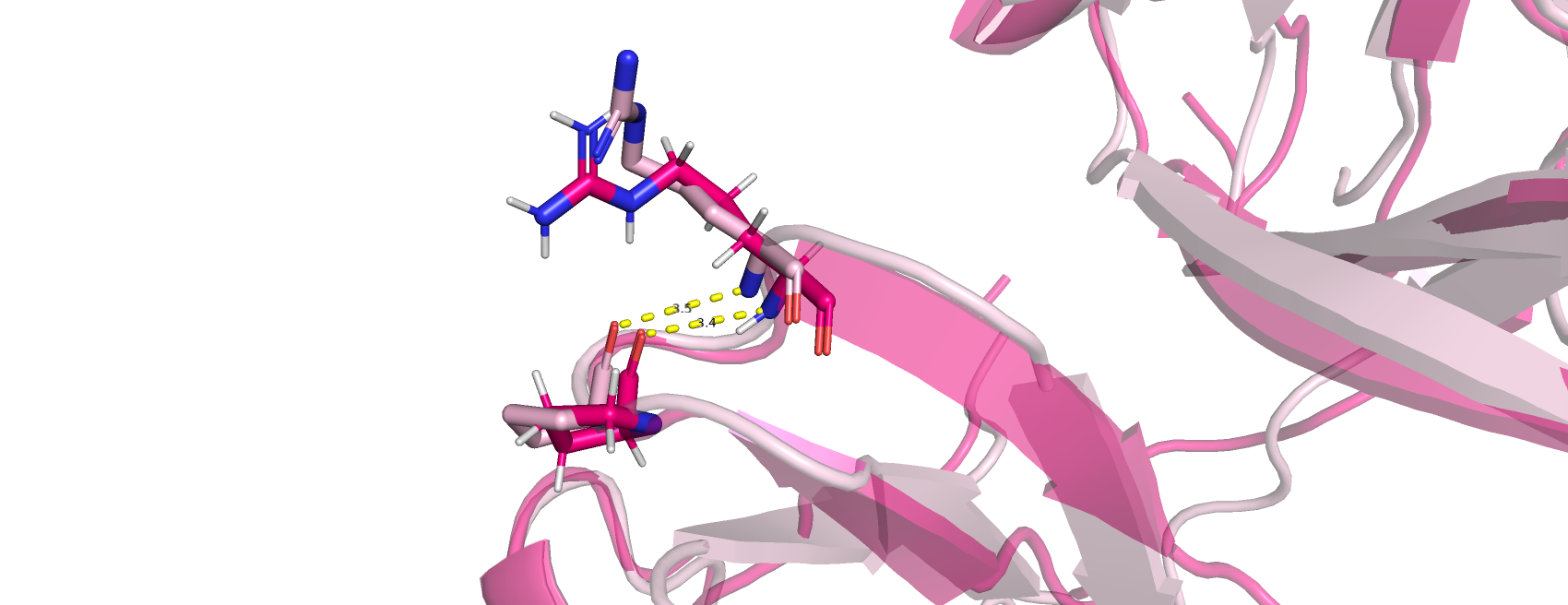
Рис.6. Водородна связь в петлях, выходящих на поверхность глобулы: аргинин 146 и пролин 143 (светло-розовая структура получена методом РСА, ярко-розовая- ЯМР)