
Идентификатор белка: 3DL0.
Русское название: аденилат-киназа (adenilate-kinaze).
В PDB-файле две белковых цепи (A и B).
В PDB-файле присутствуют координаты атомов отличных от белка и воды. Это 2 иона цинка, 2 иона магния и 2 молекулы бис(аденозин)-5'-пентафосфата. Эти структуры в составе белка показаны на рисунке 1.
Каждая из цепей белка содержит как альфа-спирали так и бета-листы, что показано на рисунке 2.
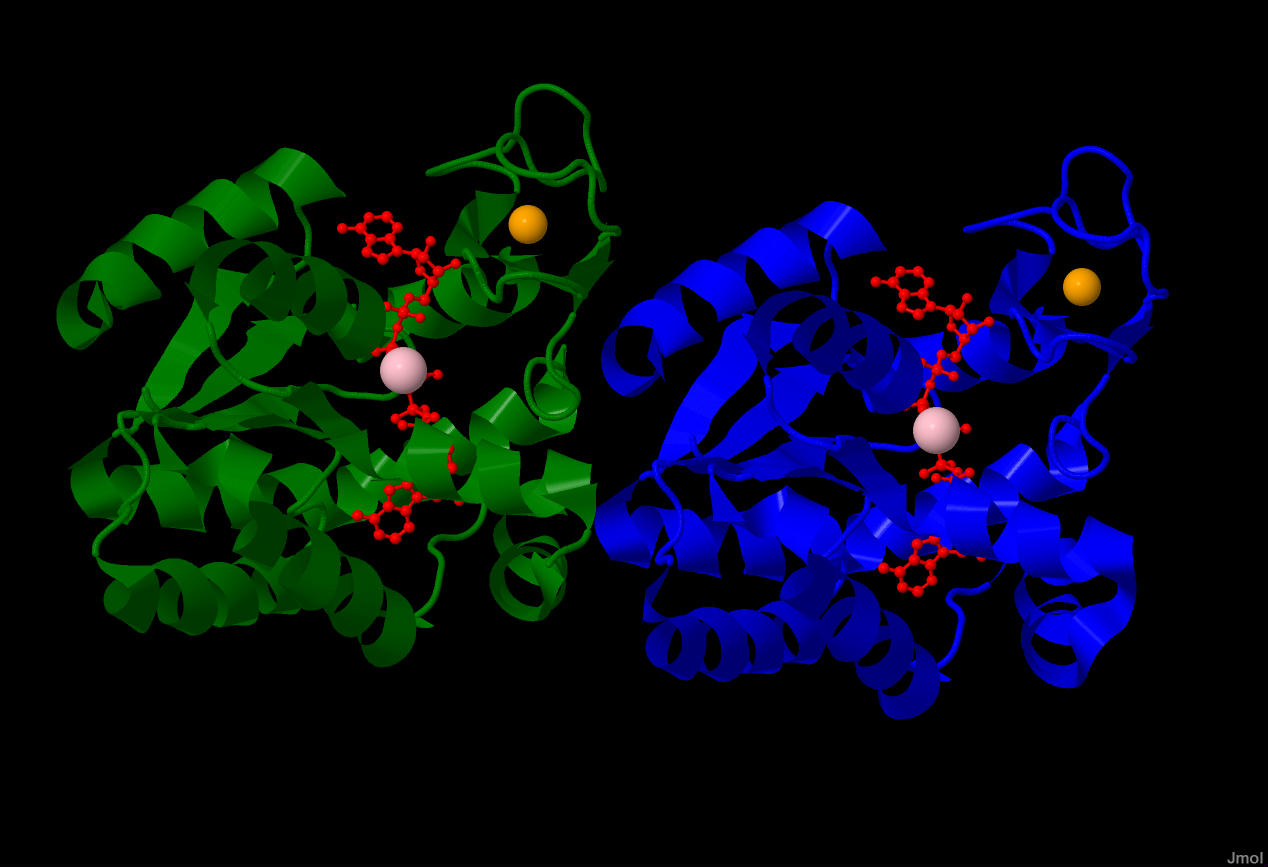
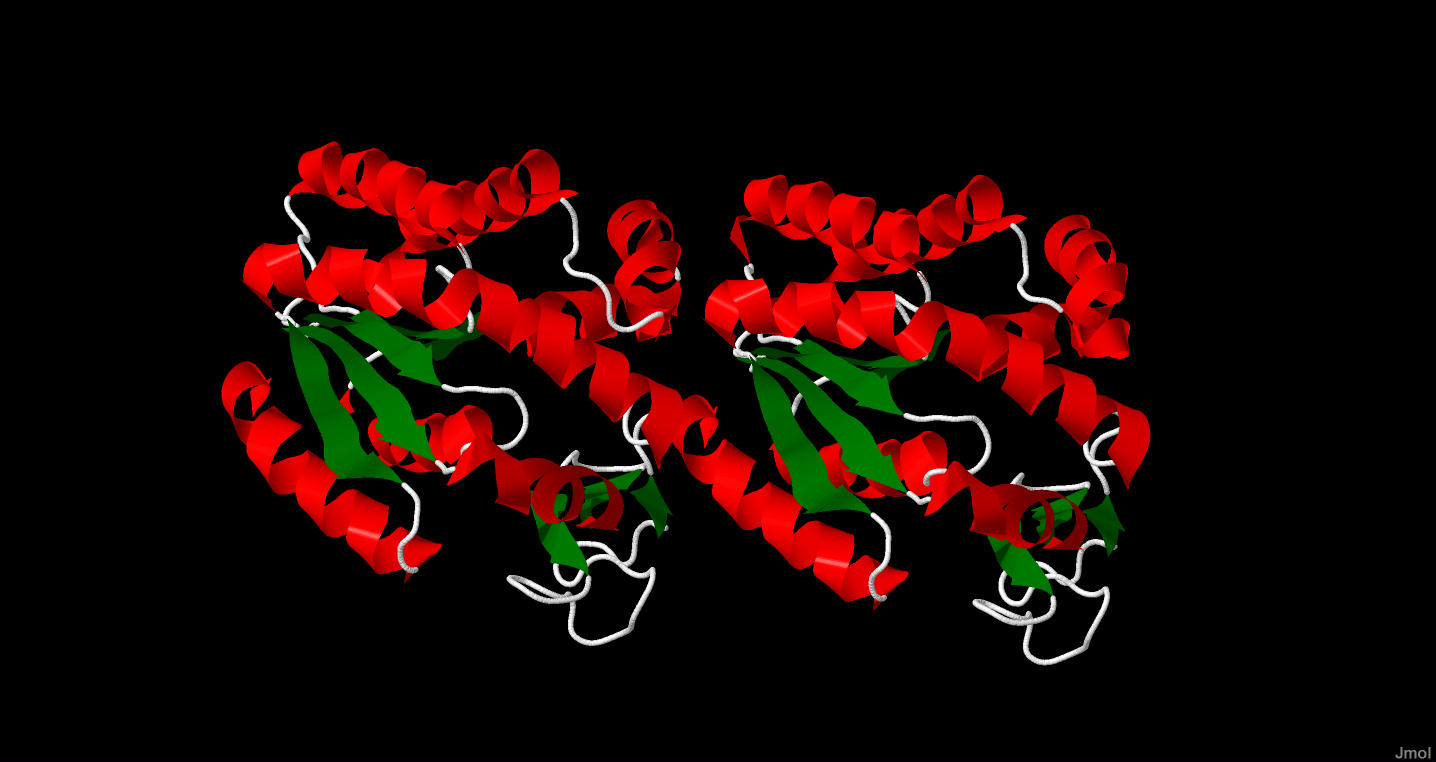
Рисунок 1. Зеленым цветом показана цепь A, зеленым - цепь B. Красным показаны молекулы бис(аденозин)-5-пентафосфата, оранжевым - атомы цинка, розовым - атомы магния.
Рисунок 2. Красным выделены альфа-спирали белка, зеленым бета-листы.

Рисунок 3. Цепь A, крсным цветом обозначен C-конец, синим N-конец.
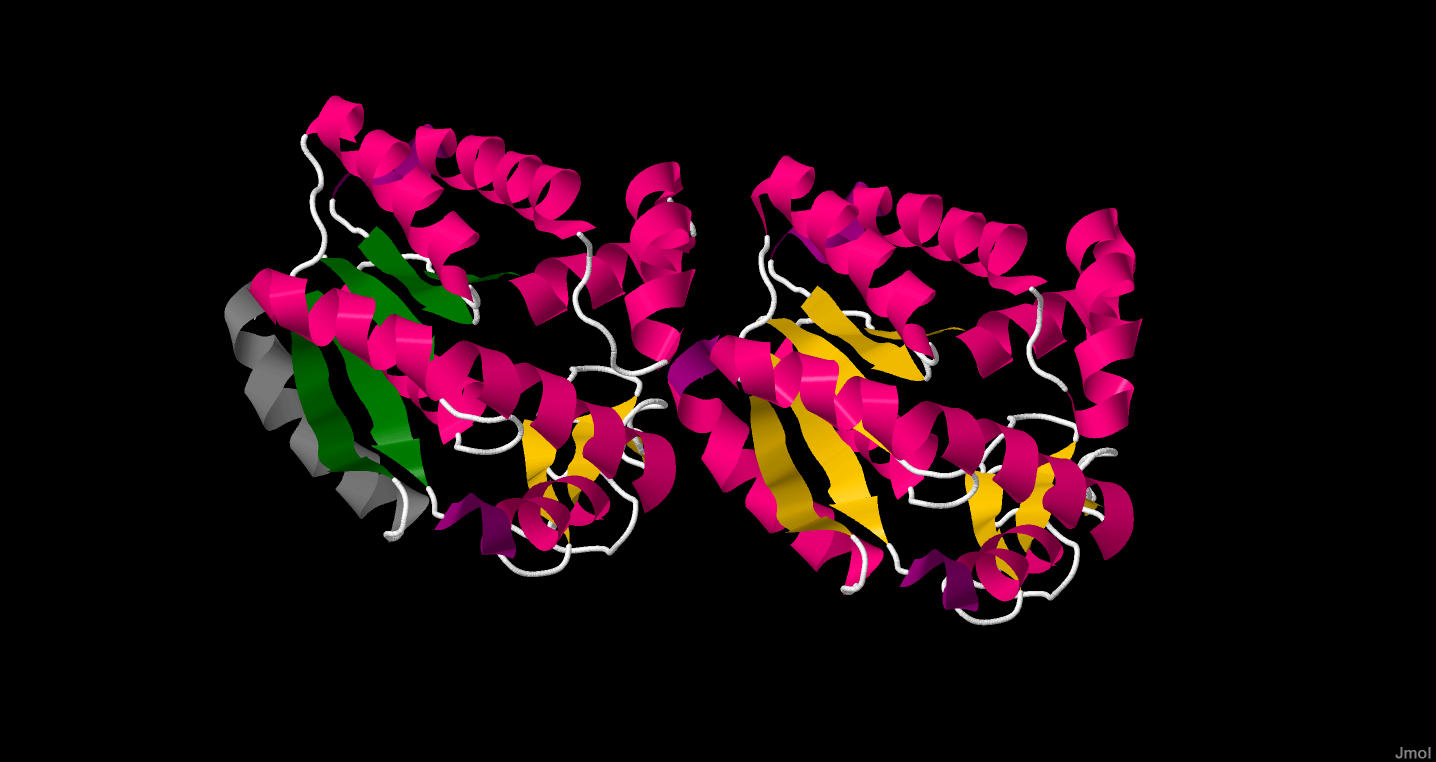

Рисунок 4. Зеленым выделен исследуемый бета-лист, серым - исследуемая альфа-спираль.
Рисунок 5. Те же структуры, что и на рисунке 4, но в отдельности от остального белка.
Рассмотрим сначала альфа-спираль (с 200ого по 215ый остаток цепи А). Установим ее шаг в ангстремах. Для этого измерим расстояние между С-альфа атомами в соответствующих положениях этой спирали, как показано на рисунке 6.
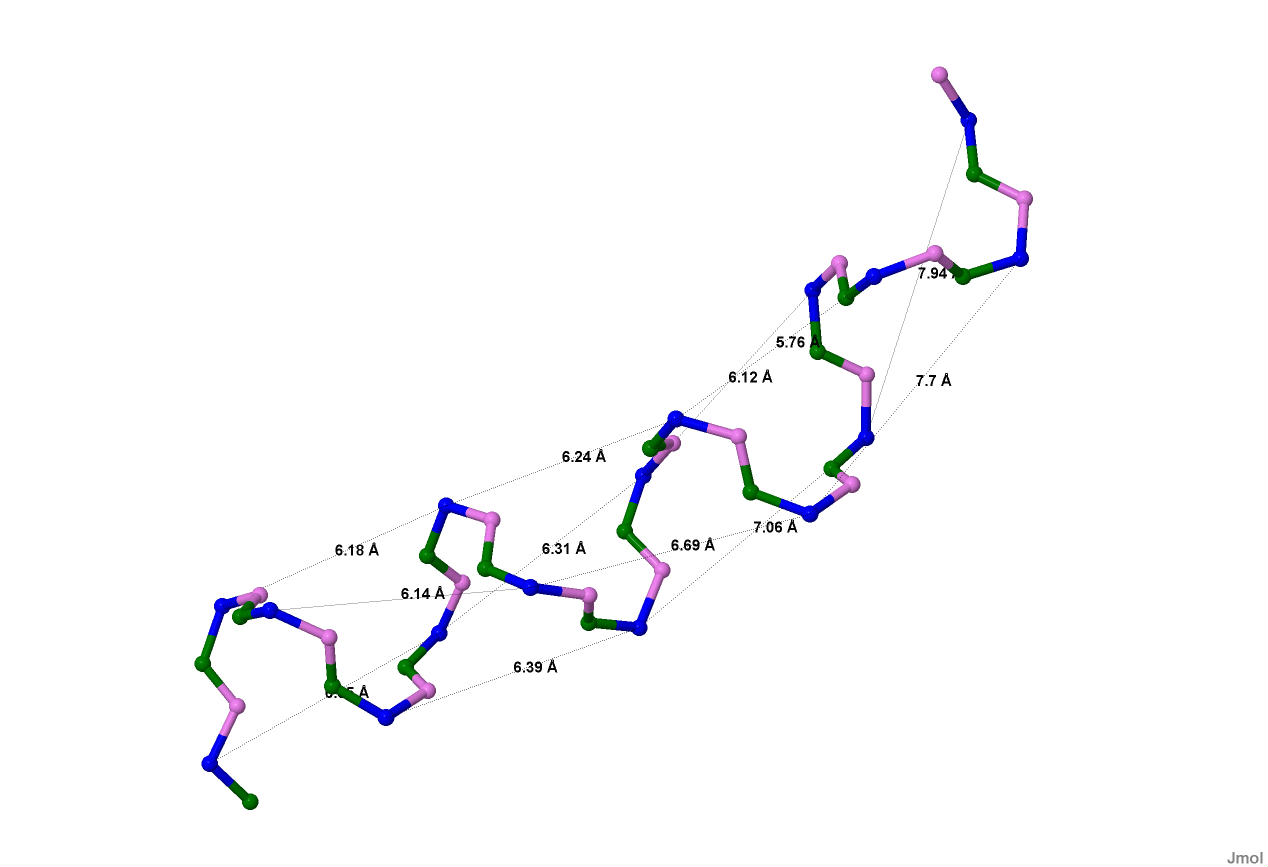
Рисунок 6. Показана рассматриваемая альфа-спираль без боковых радикалов. Синим цыетом выделены С-альфа атомы, зеленым - азот аминогрупп, серым - углерод карбоксильных групп. Показаны связи в ангстремах между С-альфа атомами в соответствующих позициях спирали.
Измерив эти раастояния легко определить шаг спирали: [(7,7+6,69+6,14)+(7,94+7,06+6,39)+(5,76+6,24+6,18)+(6,12+6,31+6,35)]/4*3=(20,53+21,39+18,18+18,78)/12=6,57 ангстрем.
Из рисунка 6 хорошо видно, что аминокислотный остаток с номером n образует водородную связь с остатком n+4.
Определим также сколько аминокислот содержится в одном витке спирали.
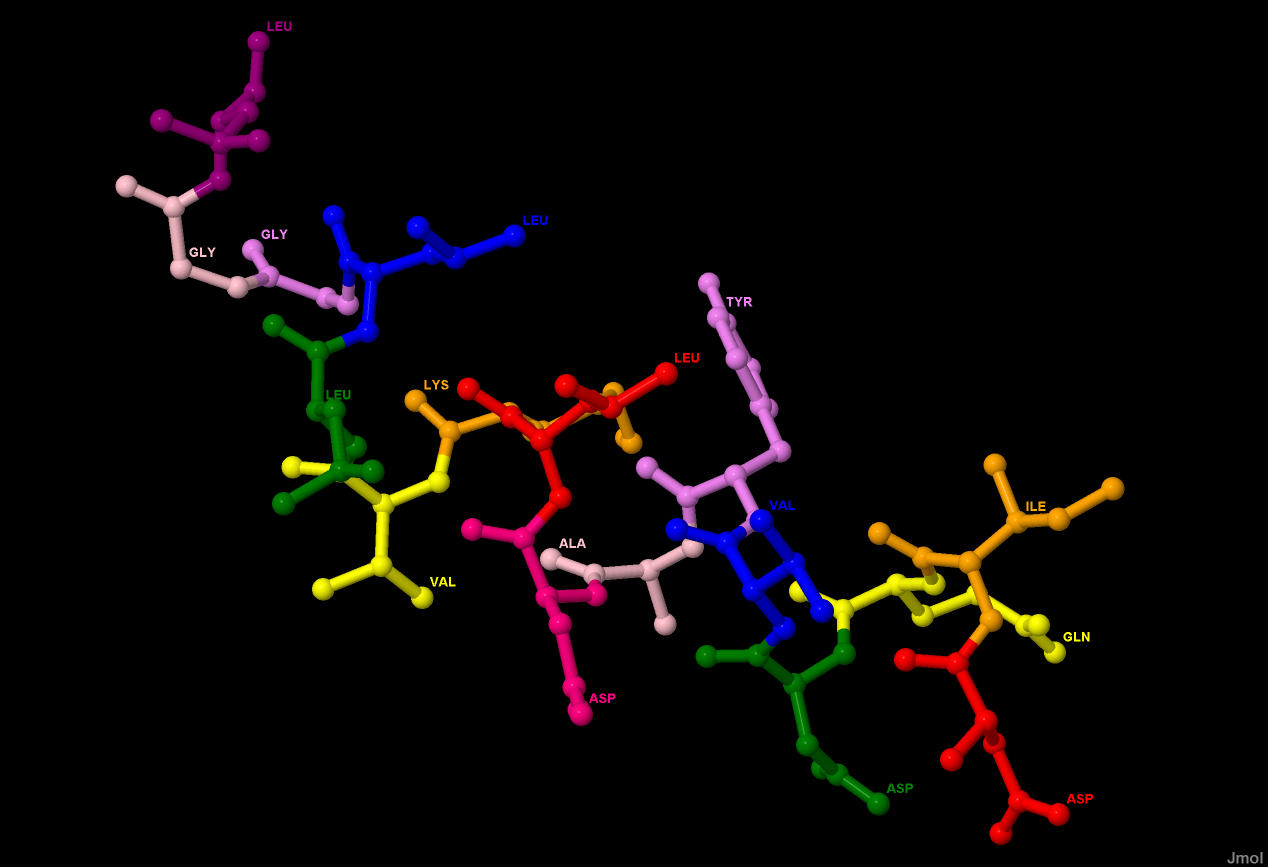
Рисунок 7. Структура рассматриваемой альфа-спирали. Подписаны 15 аминокислот, из которых она состоит.
Из рисунка 7 видно, что спираль состоит из 15и аминокислот, а из рисунка 6 - что она имеет 4 витка. Таким образом аминоксилот в одном витке равно 15/4=3,75.
Теперь рассмотрим бета-лист. В данном бета-листе есть только параллельные тяжи. Параллельность и антипараллельность это виды коллинеарности векторов данных тяжей (стрелочки тяжей идут в одном или противоположных направлении). Бета-лист представляет собой вогнуто-выпуклую поверхность, так как нельзя однозначность определить относительно чего в пространстве следует считать значение выпуклости, однако очевидно, что лист не плоский.

Рисунок 8. Рассматриваемый бета-лист как вогнуто-выпуклая поверхность.
В цепи А (как и в цепи В) 4 остатка цистеина, из которых 3 находятся на сравнительно близком расстоянии, они показаны на рисунке 9. Однако расстояния их серами 3,78, 3,77 и 3,82 ангстрема, что больше чем две средних ковалентных связи, которые присутствуют в цистеиновом мостике (примерно 2 ангстрема). Таким образом, в белке нет ни одного дисульфидного мостика, а данные серы координируют ион цинка, находящийся между ними.
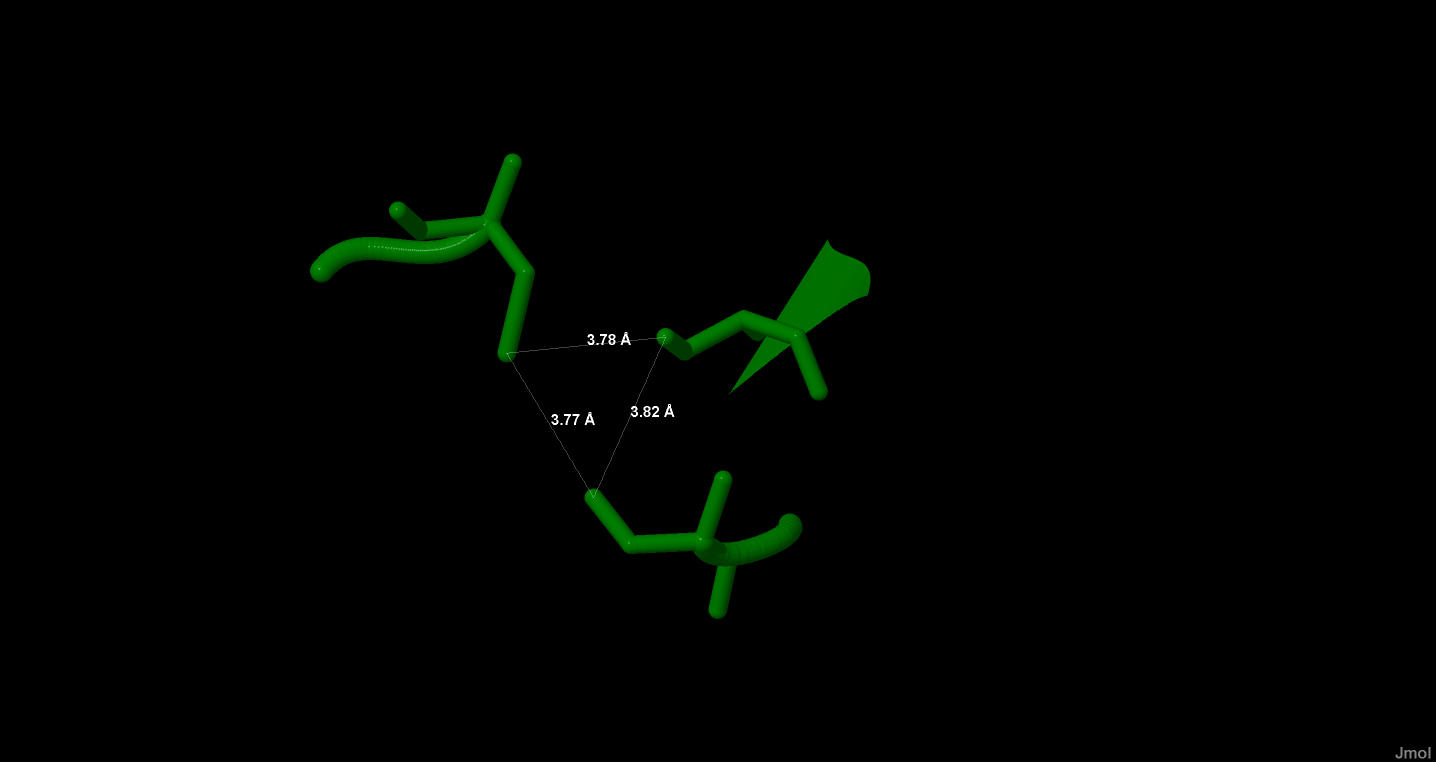
Рисунок 9. 3 близко расположенных цистеиновых остатка и расстояния между серами в их боковых цепях.
В белке есть солевые мостики в цепи А их 8 штук, соответственно в белке их 16. Солевые мостики цепи А показаны на рисунке 10.
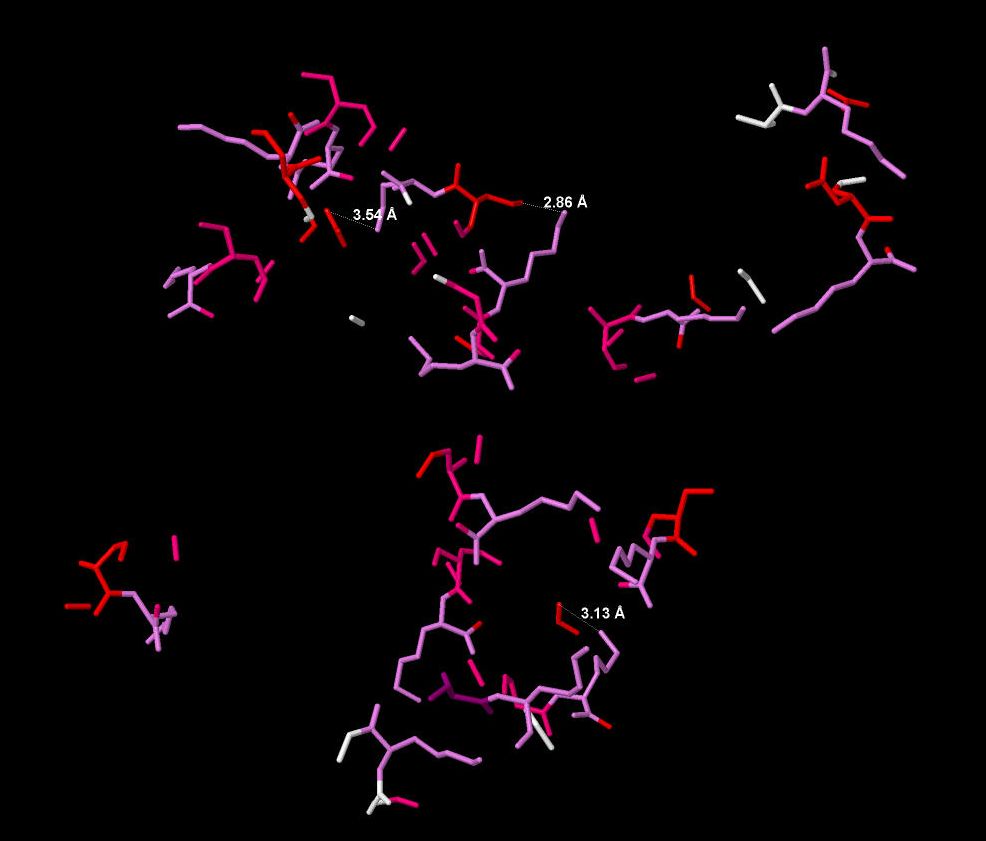

Рисунок 10. Солевые мостики в цепи А. Красным показаны аспартат и глутамат, синим - гистидин, зеленым - аргинин, сереневым - лизин. Показаны длины мостиков в ангстремах
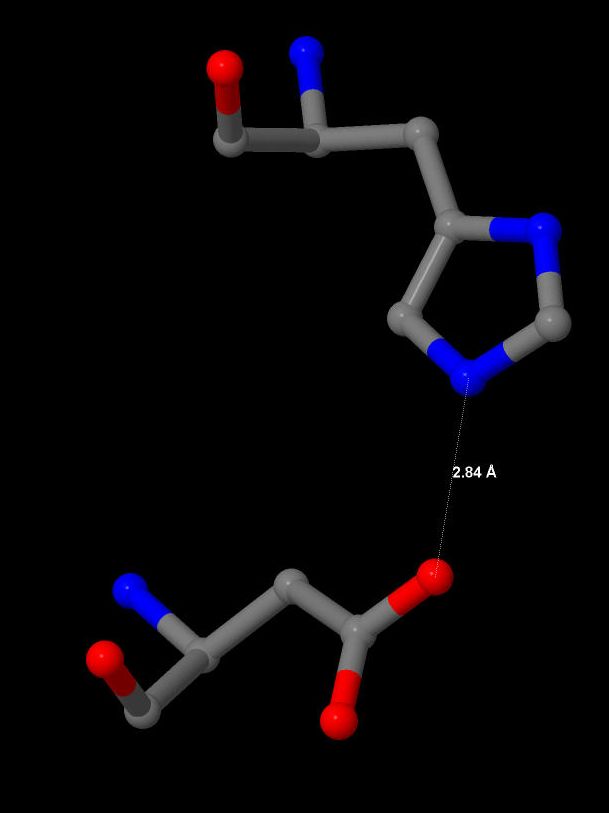
Рисунок 11. Солевой мостик между 28 остатком (гистидин) и 84 остатком (аспартат) цепи А.
| Главная страница | Первый семестр | Второй семестр | Обо мне | Ссылки |