| PDB код | Тип
(спираль, баррель) |
Какая мембрана (внутренняя или внешняя, организм, органелла) |
Толщина гидрофобной части мембраны в ангстремах | Медиана числа остатков в одном трансмембранном участке |
| 4dkl | спираль | плазматическая мембрана эукариот (Mus musculus) | 25.4 ± 1.3 A | 24 |
| 3rlb | спираль | мембрана Грам-положительных бактерий (Lactococcus lactis) | 30.8 ± 1.8 A | 18 |
| 1l9b | спираль | внутренняя мембрана Грам-отрицатеьных бактерий (Rhodobacter sphaeroides) | 31.6 ± 0.8 A | 20 |
| 3csl | баррель | внешняя мембрана Грам-отрицательных бактерий (Serratia marcescens) | 25.4 ± 1.3 A | 8 |
| 1uyn | баррель | внешняя мембрана Грам-отрицательных бактерий (Neisseria meningitidis) | 25.3 ± 1.3 A | 9 |
| 1i78 | баррель | внешняя мембрана Грам-отрицательных бактерий (Escherichia coli) | 26.5 ± 1.6 A | 9 |
 |
 |
 |
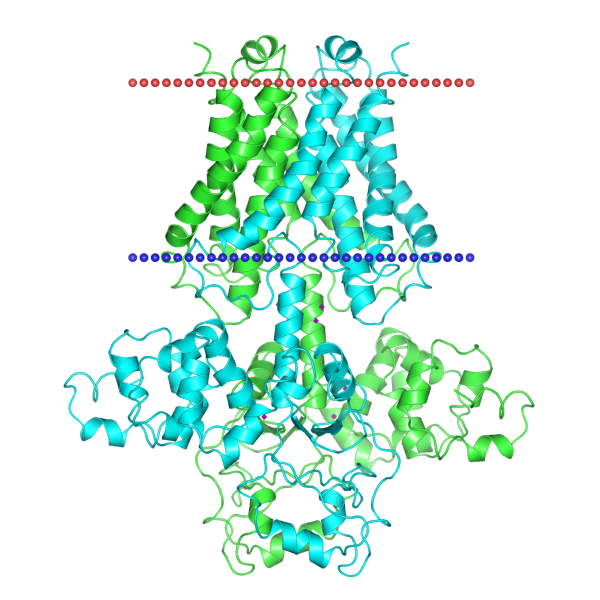
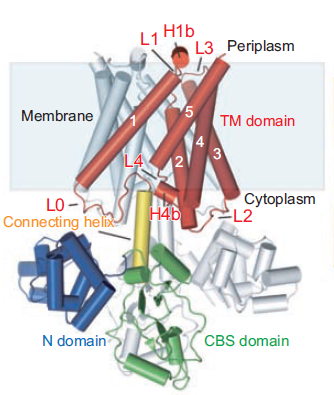
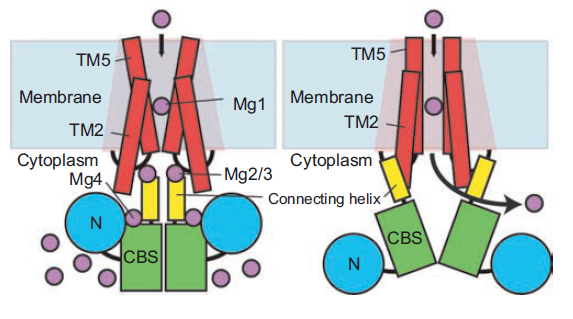
| Рисунок 1. Струткра димера белка MgtE в мембране согласно базе данных OPM (слева), та же структура с указанием доменов (в центре) и схема работы белка (справа). |
| PDB ID | Организм | Тип мембраны | TC-код | Угол наклона спиралей к нормали | Количество трансмембранных спиралей |
| 2YVX | Thermus thermophilus | Внутренняя мембрана Грам-отрицательных бактерий | 1.A.26.1.2 | 19° | 5 |
 |
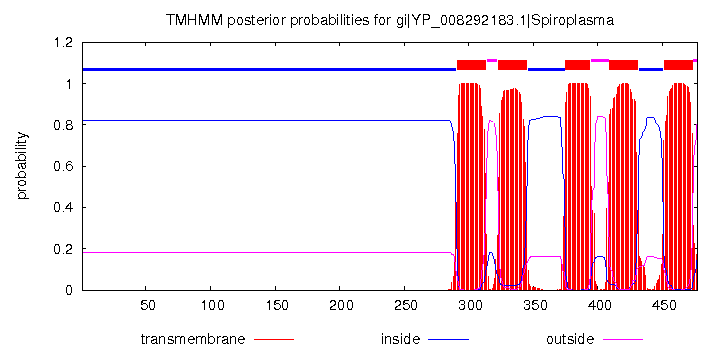 |
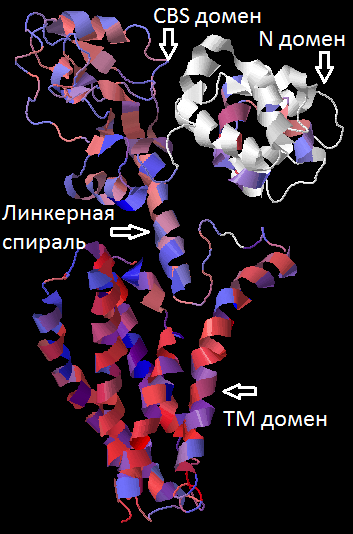
| Рисунок 2. Струтура мономера исходного белка с раскрасокй по гидрофобности (порог консервативности 10) (слева), предсказание расположения трансмембранных спиралей (красные) в последовательности гомолога по результатам работы программы TMHMM (справа). |

| 2YVX (TM_REAL) |
Гомолог (TM_PREDICTED) |
||
| Начало | Конец | Начало | Конец |
| 277 | 306 | 291 | 313 |
| 319 | 336 | 323 | 345 |
| 355 | 381 | 375 | 394 |
| 388 | 412 | 409 | 431 |
| 424 | 443 | 451 | 473 |
| Главная страница | Первый семестр | Второй семестр | Третий семестр | Обо мне | Ссылки |