Структура белковых кристаллов и взаимодействия в них
Восстановление кристалла из PDB файла
Работа велась со структурой аденилаткиназы из Bacillus subtilis - 3DL0. PDB-файл содержит информацию о кристаллографической ячейке в поле CRYST1:
CRYST1 34.003 76.688 77.993 90.00 95.30 90.00 P 1 21 1 4
- Первые три числа - длины направляющих векторов ячейки.
- Следующие три числа - углы между этими векторами.
- P 1 21 1 - тип кристаллографической ячейки. В данном случае она простая моноклинная.
- Последнее число (4) - число молекул в одной ячейке.
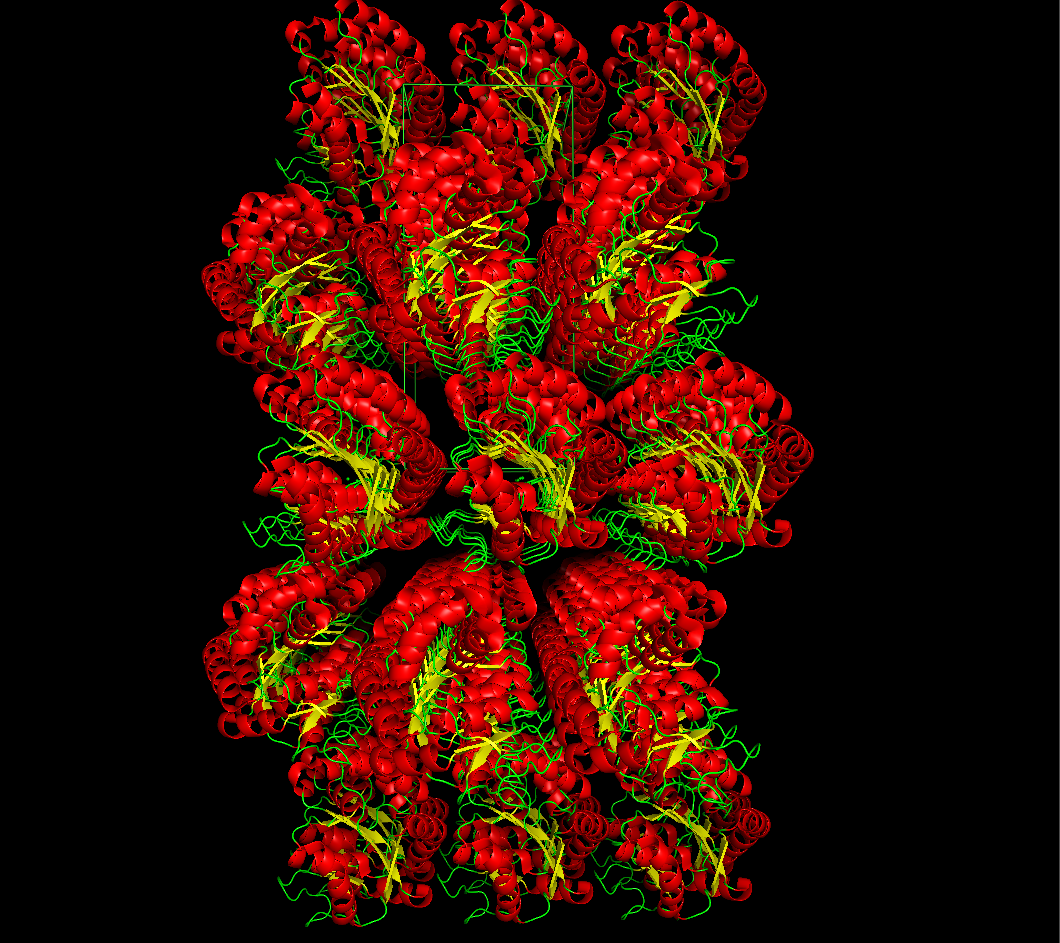
PDB-структура 3DL0 была загружена в программу PyMOL для восстановления структуры кристалла. Полученные с помощью команды symexp изображения фрагмента кристаллической решетки показаны на рисунке 1.
Рисунок 1. Фрагмент кристалла изучаемого белка (вид с разных ракурсов). Раскраска по участкам вторичной структуры.
Из изображений видно, что молекулы белка в кристалле уложены слоями. Эти слои чередуются - молекулы белка в них уложены в противоположных ориентациях. Слои в свою очередь состоят
из рядов молекул. Таким образом,
можно предположить несколько типов межмолекулярных взаимдействий, определяющих структурур кристалла:
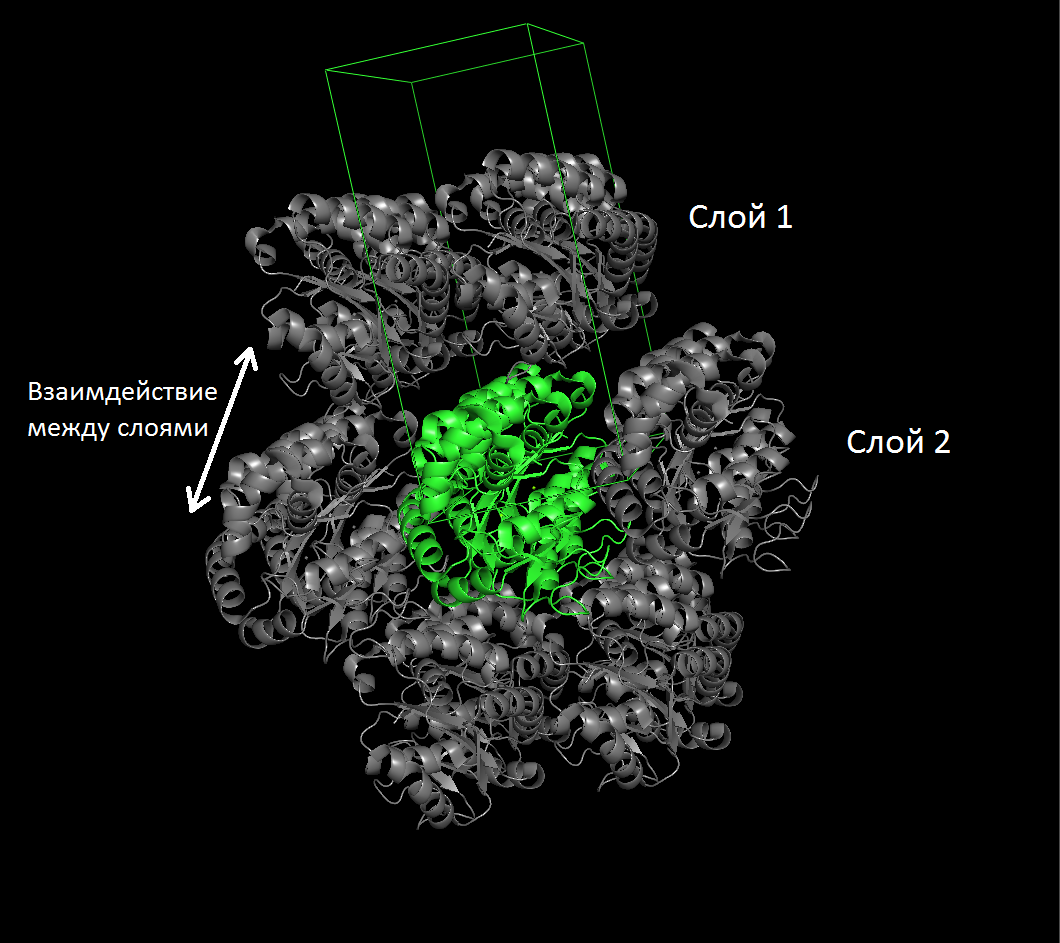
- Взаимодействие между слоями
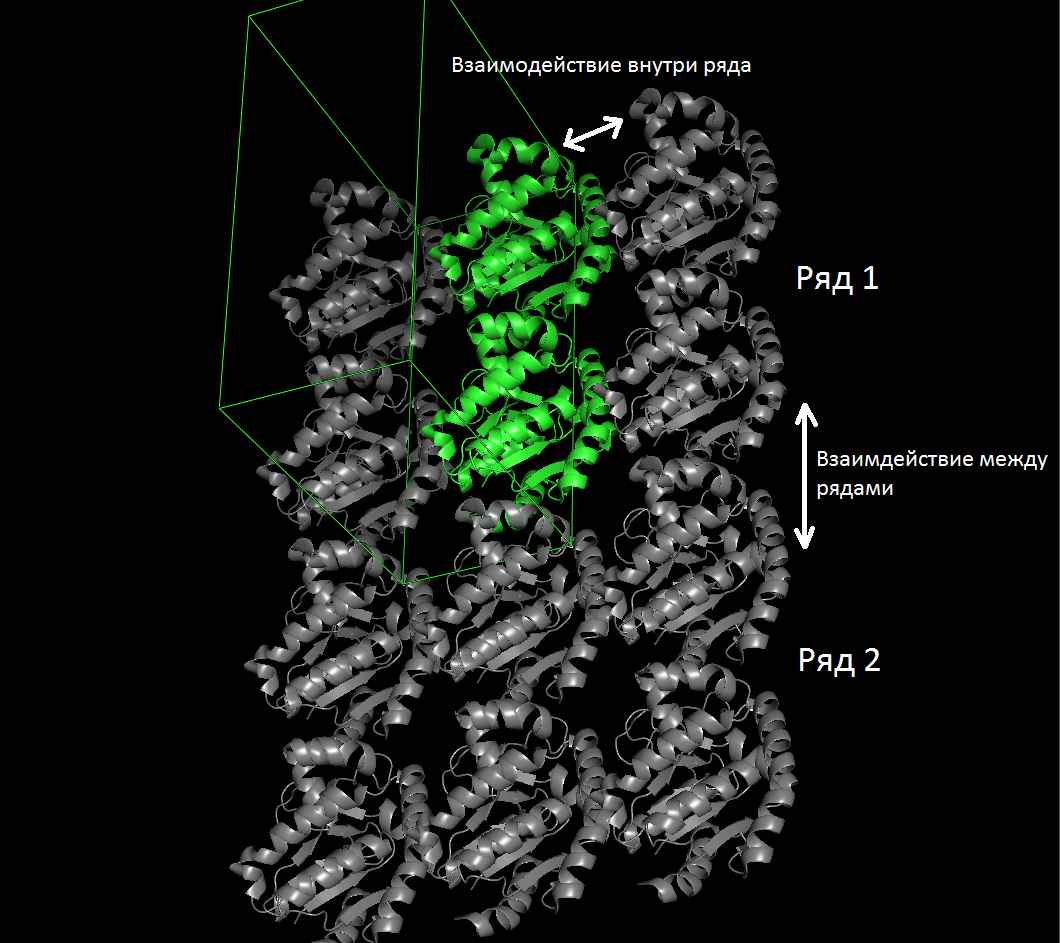
- Взамимодествие внутри слоя между молекулами ряда
- Взамимодествие внутри слоя между молекулами соседних рядов
Рисунок 2. Фрагмент кристалла изучаемого белка (вид с разных ракурсов). Зеленым показан исходный димер и контур ячейки, серым - восстановленные молекулы.
На рисунке 3 представлены области контактов.
Рисунок 4. Межмолекулярные контакты в структуре исследуемого белка. Слева направо: между слоями, между рядами, внутри ряда.
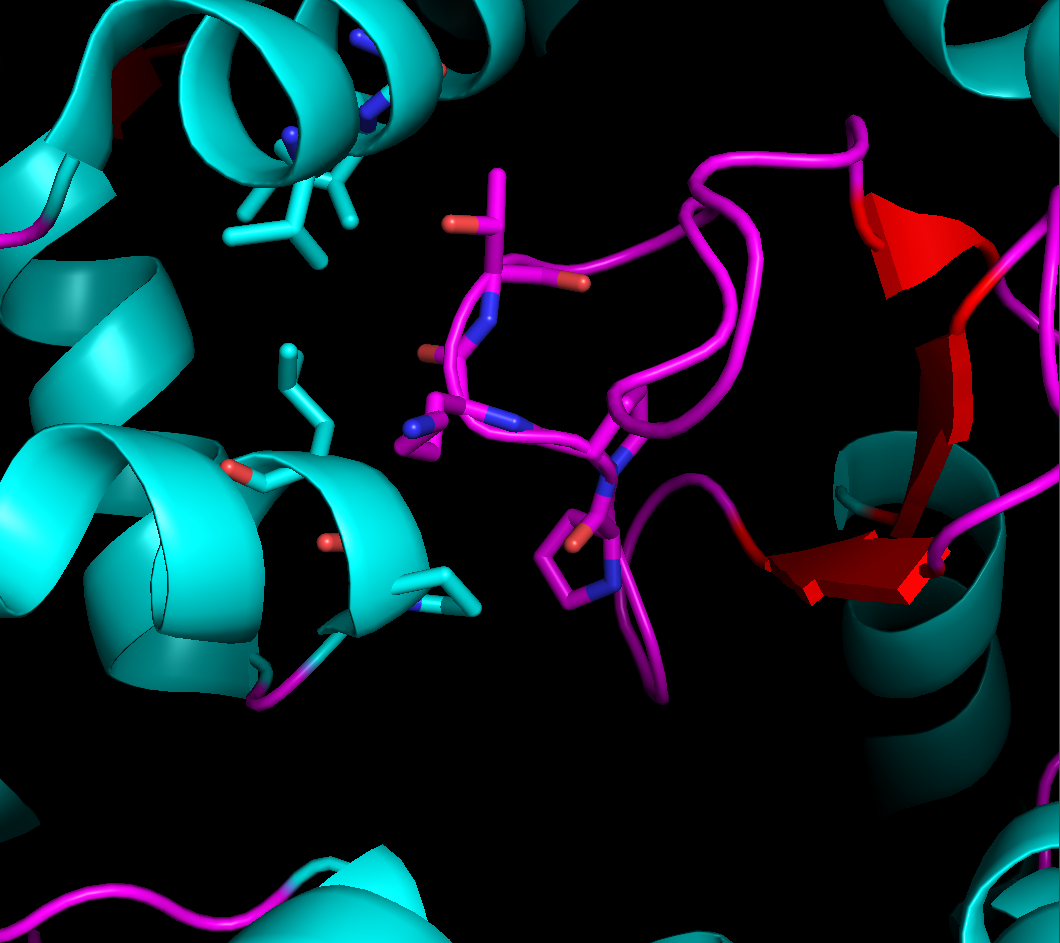
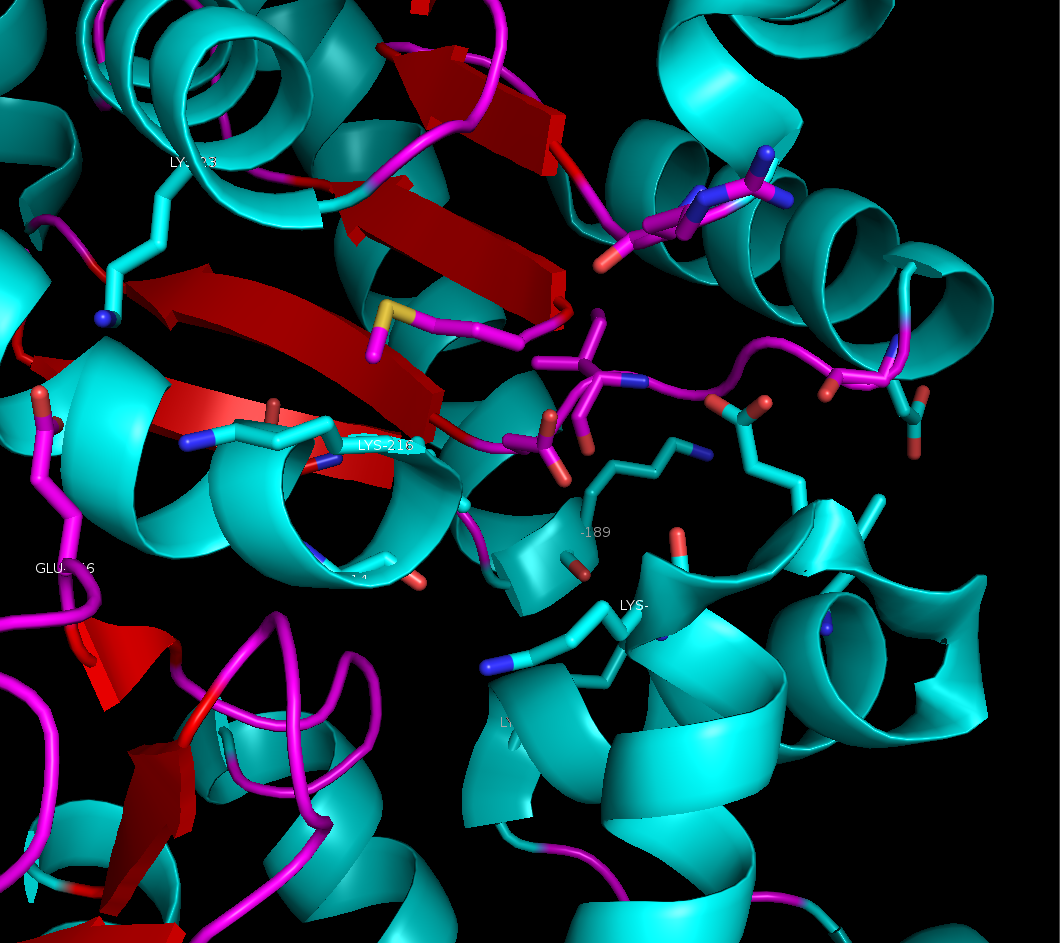
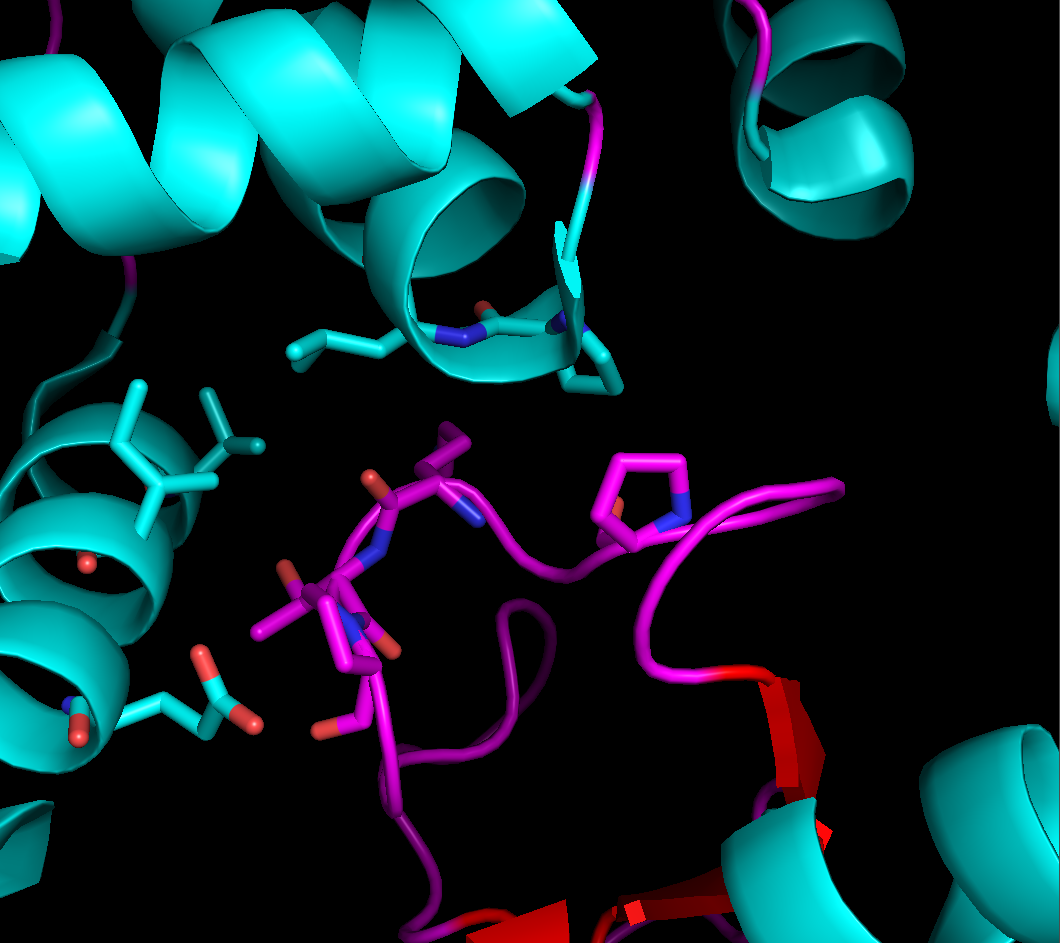
Области контактов довольно обширны, но в них не так уж много явных гидрофобных или полярных взаимодействий между аминокислотами. Те взаимодействия, что мне удалось обнаружить, представлены на рисунке 4.
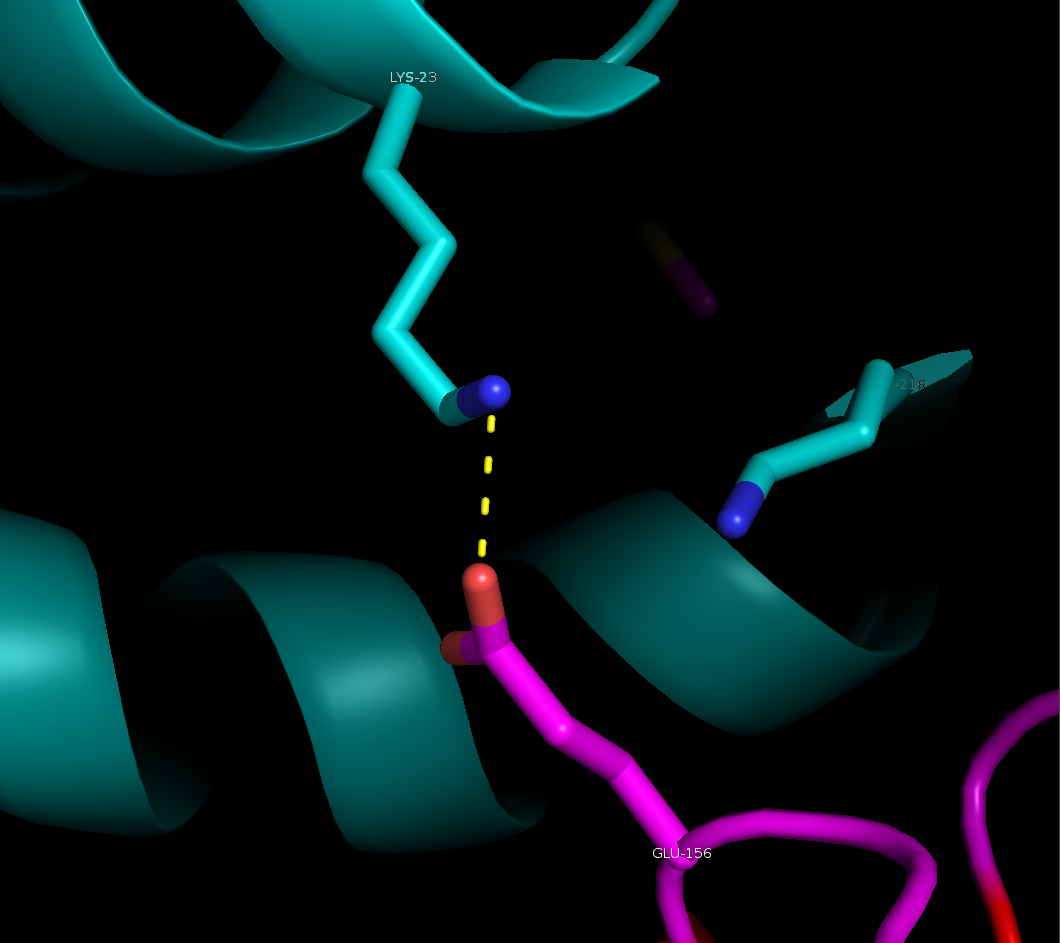
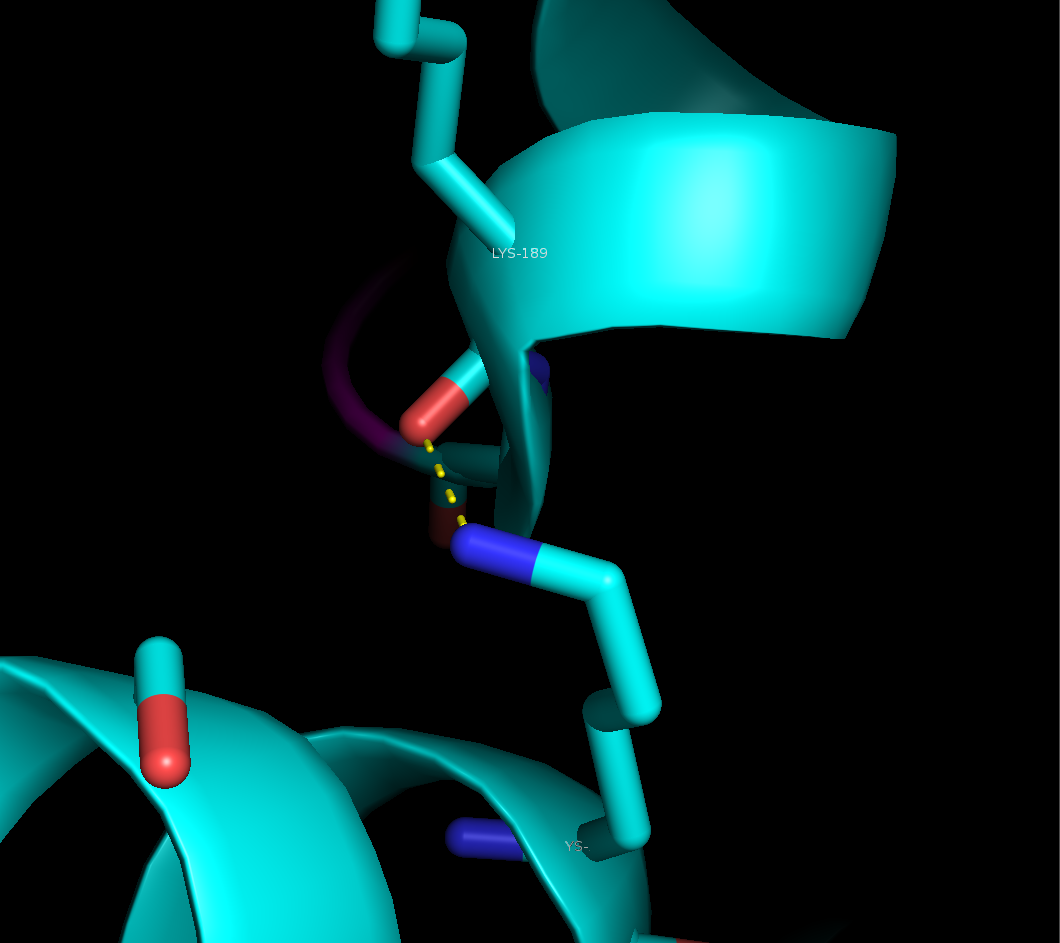
Рисунок 4. Солевые мостике в области контакта между рядами. Слева: между боковыми группами остатка лизинва 23 цепи А и глутамата 156 цепи B, справа - между боковой группой лизина 55 цепи B и основной цепью цепи А (лизин 189).
Итак, можно скзать, что явных межмолекулярных взаимодействий немного, однако белок всё равно кристаллизуется. Я бы сказал, что на кристталлизуемость белка в данном случае повлияла форма молекула: мономер имеет довольно правильную форму без явных выступов, в объеме это практически параллелепипед. Поэтому небольшого количества взаимодействий достаточно, чтобы уложить белок в регулярную структуру.
Объяснение странностей расположения белковых цепей в структуре ДНК-белкового комплекса
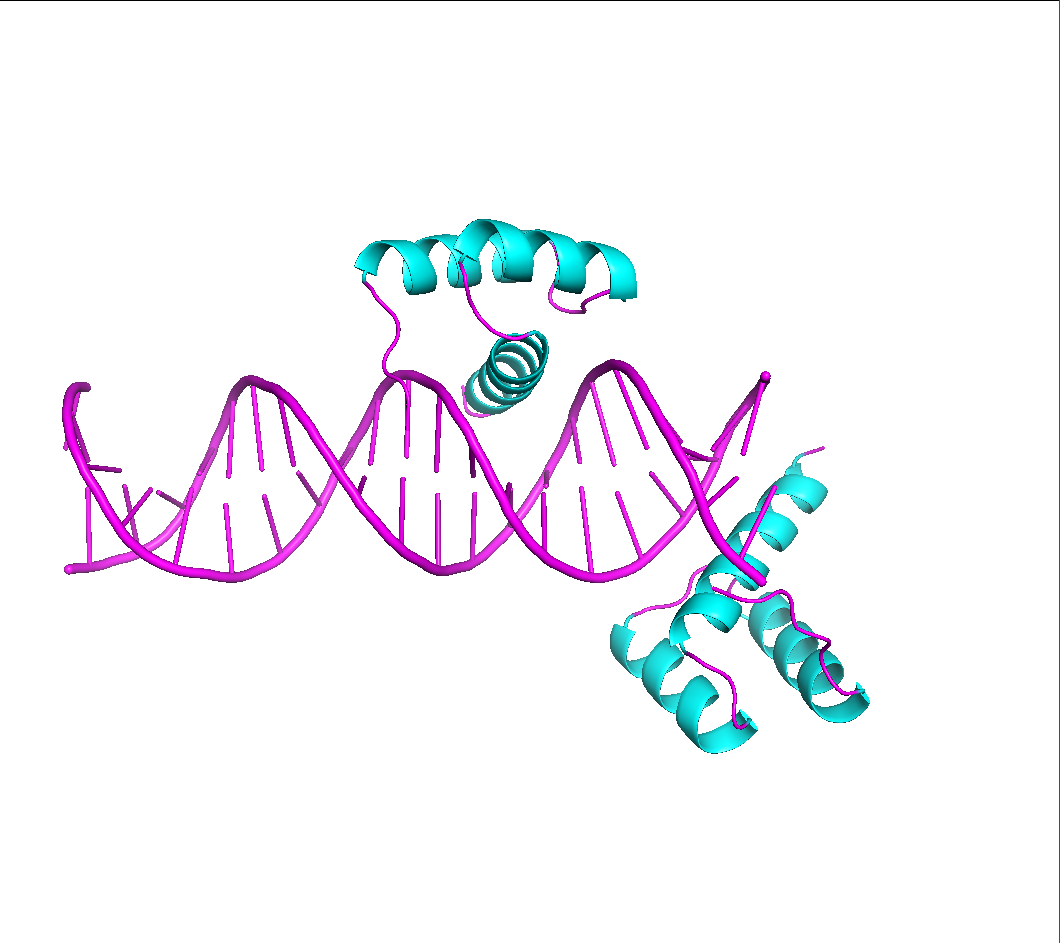
Файл 3hdd содержит 3D-структуру гомеодомена engrailed из Drosophila в комплексе с молекулой ДНК, с разрешением 2,2 ангстрема. Как видно из рисунка 1 цепь расположена на краю молекулы ДНК, что не совсем естественно, теряется часть связей, которые белковая цепь образует с ДНК.
Для того, чтобы разрешить эту странность, с помощью команды symexp были восстановлены соседние ячейки.
Рисунок 5. Слева - стркутура 3hdd, справа - восстановленные соседние ячейки.
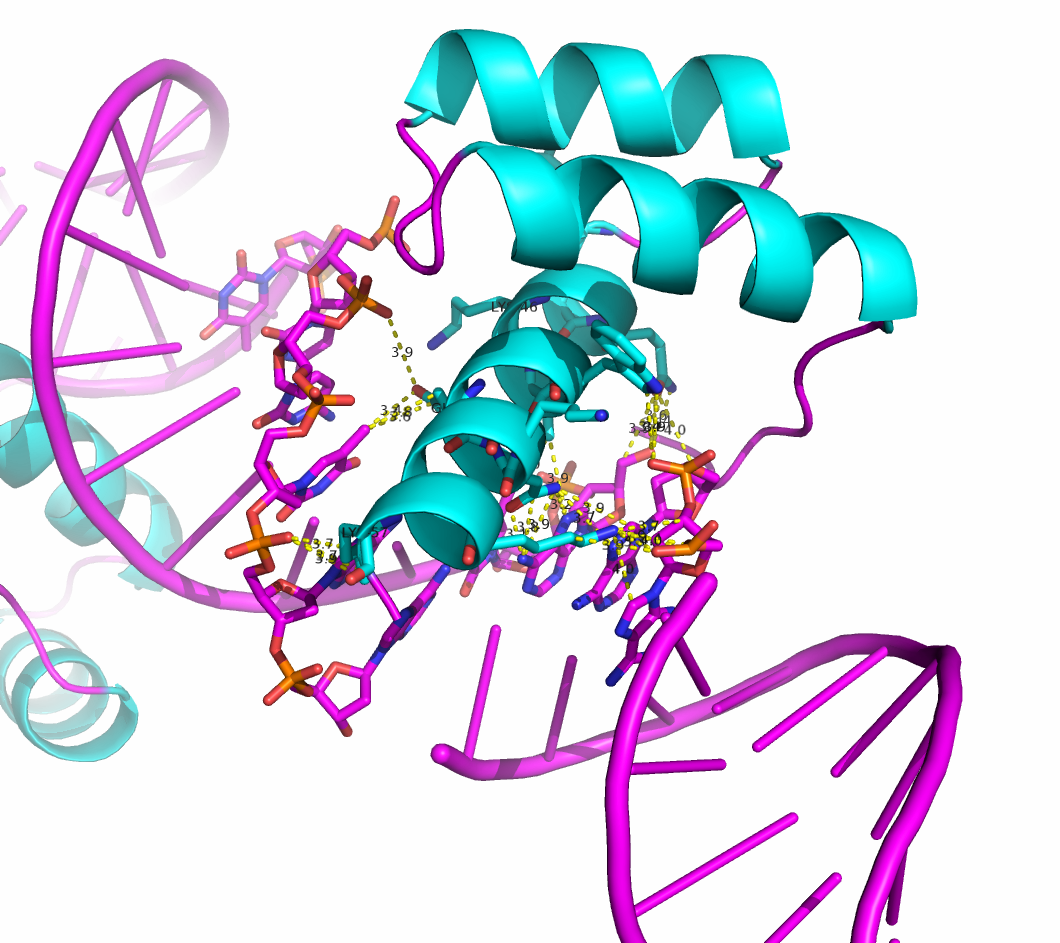
После восстановления видно, что белковая цепь, находящаяся на краю одной молекулы ДНК, на сомом деле контактирует с молекулой ДНК из соседнея ячейки. Область контакта показана на рисунке 6.
Рисунок 6. Область контакта цепи B с молекулами ДНК из соседних ячеек. Остатки, образующие связи с ДНК из соседней ячейки: Lys46, Gln50, Lys57.
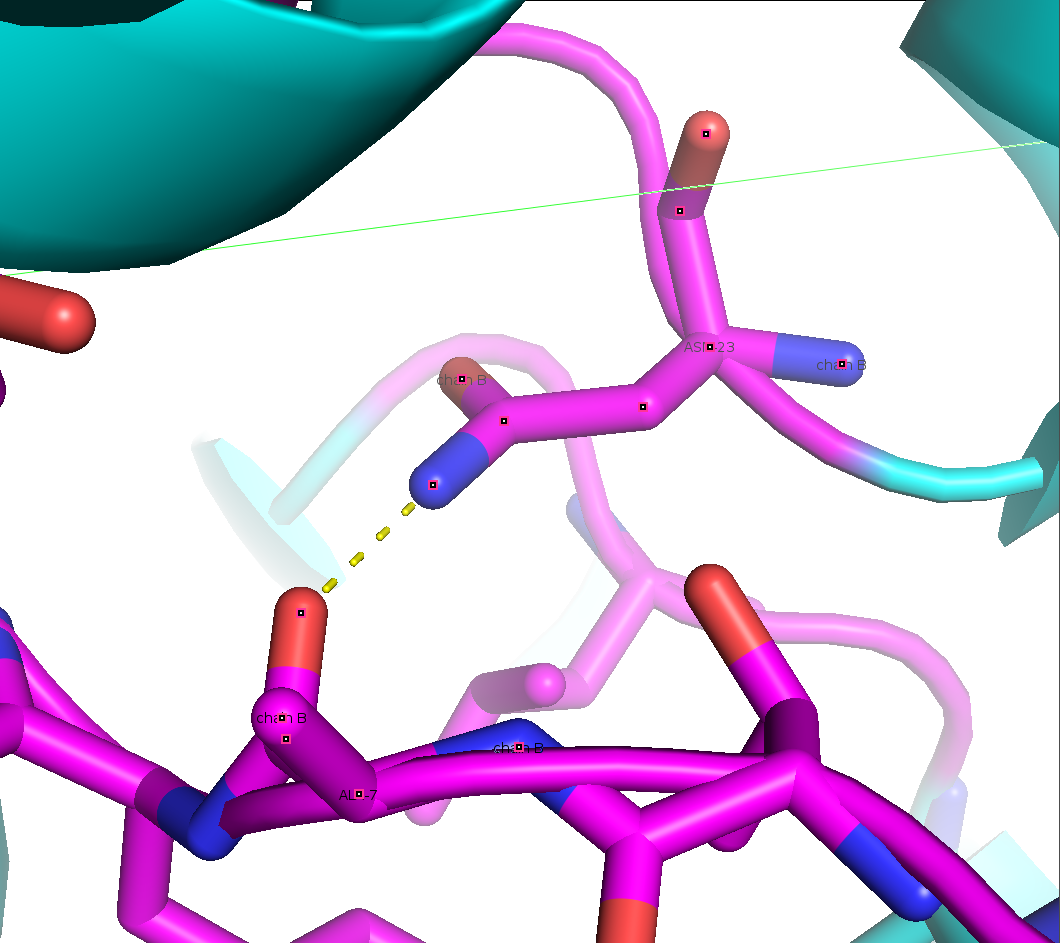
Кроме того, похоже что эта цепь еще и контактирует с другой цепью B из тертьей ячейки, пример взаимодействия между белковыми цепями показан на рисунке 7.
Рисунок 7. Пример водородной связи между цепями B из разных ячеек.
Таким образом, можно сказать, что никакой странности по сути нет, просто рассмотрения одной ячейки в данном случае не достаточно для полного понимания строения ДНК-белкового комплекса.
© Марк Меерсон, 2015
Последнее обновление 09.11.2015